Szerkesztő:BélaBéla/Atakamit

A kémiai elemek periódusos rendszere a kémiai elemek egy táblázatos megjelenítése, amelyben az elemek rendszámuk (vagyis protonszámuk), elektronszerkezetük, és ismétlődő kémiai tulajdonságaik alapján vannak elrendezve. Ez az elrendezés jól szemlélteti az elemek periodikusan változó tulajdonságait, mivel a kémiailag hasonlóan viselkedő elemek így egy oszlopba kerülnek. A táblázat négy téglalap alakú mezőt (s-, p-, d-, f-mezők) is tartalmaz amelyeken belül egyes kémiai tulajdonságok hasonlóságokat mutatnak. Általánosságban elmondható, hogy a sorok (periódusok) bal oldalán fémek a jobb oldalán nemfémek helyezkednek el.
A periódusos rendszer sorait periódusoknak nevezzük, az oszlopokat pedig csoportoknak. Néhány csoportnak a sorszáma mellett saját neve is van, például a 18-as csoportot nemesgázokként, a 17-es csoportot halogénekként is ismerik, de egyes csoportoknál a csoport első tagjából képzett nevet is használják, például széncsoport, nitrogéncsoport. A periódusos rendszer használható az elemek tulajdonságai közti kapcsolatok levezetésére, de akár még fel nem fedezett elemek tulajdonságait is meg lehet jósolni a segítségével. A kémia oktatásában ma általánosan elterjedt a periódusos rendszer használata, a kémiai sajátosságok különböző formáinak az osztályozásához, rendszerezéséhez és összehasonlításához hasznos segédeszköz. A táblázatot széleskörűen használják a kémiában, fizikában, biológiában és az iparban.
Az orosz kémikus, Dmitrij Mengyelejev tette közzé az első szélesebb körben elismert periódusos rendszert 1869-ben. Felismerte, hogy az akkor ismert elemek tulajdonságai a rendszámuk alapján periodikusan váltakoznak. Mengyelejev emellett megjósolta a táblázat akkor még üres helyeire kerülő elemek néhány tulajdonságát. Előrejelzései a kérdéses elemek felfedezése után többnyire beigazolódtak. Mengyelejev periódusos rendszerét azóta új elemek felfedezésével és a kémiai viselkedést leíró újabb modellekkel bővítették és finomították.
Az összes elemet az 1-es rendszámtól kezdve (hidrogén) a 118-asig (oganesszon) bezáróan felfedezték vagy mesterségesen előállították már és a periódusos rendszer első hét periódusa teljessé vált a nihonium, moszkovium, tennesszin és oganesszon felfedezésével, melyet az IUPAC 2015 december 30-án igazolt, hivatalos nevüket pedig 2016 november 28-án kapták meg.[1][2] Az első 94 elem mindegyike megtalálható a természetben, bár néhányuk csak nyomnyi mennyiségben és hamarabb állították elő őket laboratóriumban, minthogy a természetben felfedezték volna őket.[* 1] A 95-118-as rendszámú elemeket csak laboratóriumokban, agy nukleáris reaktorokban állították elő.[3] Ennél nagyobb rendszámú elemek szintézisére folyamatosan történnek próbálkozások. Számos természetben előforduló elem szintetikus radioizotópját is előállították már laboratóriumokban.
Áttekintés
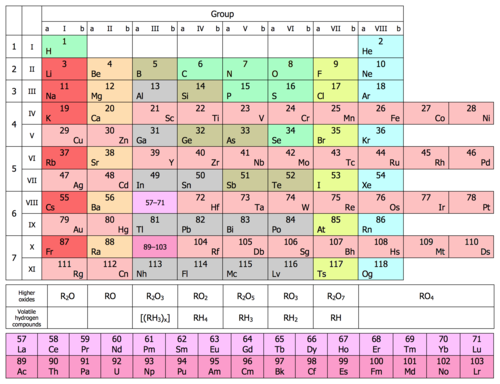
[szerkesztés]| A kémiai elemek periódusos rendszere | |||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Csoport | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | |||||||||||||||||||||
| Alkálifémek | Alkáliföldfémek | Átmenetifémek | Átmenetifémek | Átmenetifémek | Átmenetifémek | Átmenetifémek | Átmenetifémek | Átmenetifémek | Átmenetifémek | Átmenetifémek | Átmenetifémek | Földfémek | Széncsoport | Nitrogéncsoport | Kalkogének | Halogének | Nemesgázok | ||||||||||||||||||||||
| Periódus |
Hidrogén 1 H |
Hélium 2 He | |||||||||||||||||||||||||||||||||||||
| 2 | Lítium 3 Li |
Berillium 4 Be |
Bór 5 B |
Szén 6 C |
Nitrogén 7 N |
Oxigén 8 O |
Fluor 9 F |
Neon 10 Ne | |||||||||||||||||||||||||||||||
| 3 | Nátrium 11 Na |
Magnézium 12 Mg |
Alumínium 13 Al |
Szilícium 14 Si |
Foszfor 15 P |
Kén 16 S |
Klór 17 Cl |
Argon 18 Ar | |||||||||||||||||||||||||||||||
| 4 | Kálium 19 K |
Kalcium 20 Ca |
Szkandium 21 Sc |
Titán 22 Ti |
Vanádium 23 V |
Króm 24 Cr |
Mangán 25 Mn |
Vas 26 Fe |
Kobalt 27 Co |
Nikkel 28 Ni |
Réz 29 Cu |
Cink 30 Zn |
Gallium 31 Ga |
Germánium 32 Ge |
Arzén 33 As |
Szelén 34 Se |
Bróm 35 Br |
Kripton 36 Kr | |||||||||||||||||||||
| 5 | Rubídium 37 Rb |
Stroncium 38 Sr |
Ittrium 39 Y |
Cirkónium 40 Zr |
Nióbium 41 Nb |
Molibdén 42 Mo |
Technécium 43 Tc |
Ruténium 44 Ru |
Ródium 45 Rh |
Palládium 46 Pd |
Ezüst 47 Ag |
Kadmium 48 Cd |
Indium 49 In |
Ón 50 Sn |
Antimon 51 Sb |
Tellúr 52 Te |
Jód 53 I |
Xenon 54 Xe | |||||||||||||||||||||
| 6 | Cézium 55 Cs |
Bárium 56 Ba |
Lantán 57 La |
* | Hafnium 72 Hf |
Tantál 73 Ta |
Volfrám 74 W |
Rénium 75 Re |
Ozmium 76 Os |
Irídium 77 Ir |
Platina 78 Pt |
Arany 79 Au |
Higany 80 Hg |
Tallium 81 Tl |
Ólom 82 Pb |
Bizmut 83 Bi |
Polónium 84 Po |
Asztácium 85 At |
Radon 86 Rn | ||||||||||||||||||||
| 7 | Francium 87 Fr |
Rádium 88 Ra |
Aktínium 89 Ac |
** | Raderfordium 104 Rf |
Dubnium 105 Db |
Sziborgium 106 Sg |
Bohrium 107 Bh |
Hasszium 108 Hs |
Meitnérium 109 Mt |
Darmstadtium 110 Ds |
Röntgénium 111 Rg |
Kopernícium 112 Cn |
Nihónium 113 Nh |
Fleróvium 114 Fl |
Moszkóvium 115 Mc |
Livermórium 116 Lv |
Tenesszium 117 Ts |
Oganeszon 118 Og | ||||||||||||||||||||
| * | Cérium 58 Ce |
Prazeodímium 59 Pr |
Neodímium 60 Nd |
Prométium 61 Pm |
Szamárium 62 Sm |
Európium 63 Eu |
Gadolínium 64 Gd |
Terbium 65 Tb |
Diszprózium 66 Dy |
Holmium 67 Ho |
Erbium 68 Er |
Túlium 69 Tm |
Itterbium 70 Yb |
Lutécium 71 Lu |
|||||||||||||||||||||||||
| ** | Tórium 90 Th |
Protaktínium 91 Pa |
Urán 92 U |
Neptúnium 93 Np |
Plutónium 94 Pu |
Amerícium 95 Am |
Kűrium 96 Cm |
Berkélium 97 Bk |
Kalifornium 98 Cf |
Einsteinium 99 Es |
Fermium 100 Fm |
Mendelévium 101 Md |
Nobélium 102 No |
Laurencium 103 Lr |
|||||||||||||||||||||||||
| Jelmagyarázat | |||||||||||||||||||||||||||||||||||||||
| szilárd | folyékony | gáz | ismeretlen halmazállapotú | ||||||||||||||||||||||||||||||||||||
| természetes elem | radioaktív elem | mesterségesen előállított elem | |||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||
A periódusos rendszer mindegyik eleme rendelkezik egy egyedi rendszámmal (Z), amely megmutatja az elem atommagjában található protonok számát. A legtöbb elemnek különböző neutronszámú atomjai fordulnak elő, ezeket izotópoknak nevezzük. Például a szénnek a természetben három izotópja fordul elő: mindegyikük hat protonnal és legtöbbjük hat neutronnal is rendelkezik, de az atomok kb. 1%-ának hét és egy ennél is sokkal kisebb hányadának nyolc neutronja van. Az izotópokat a periódusos rendszer nem különíti el egymástól, hanem együtt, egy elemként ábrázolja őket. A stabil izotóppal egyáltalán nem rendelkező elemek atomtömegének a legstabilabb izotóp atomtömegét veszik és ezt zárójelben tüntetik fel.[4]
A hagyományos periódusos rendszerben az elemek növekvő rendszám szerint vannak rendezve, és új periódus kezdődik mindig, amikor egy új elektronhéj kezd el kiépülni. A csoportokat az atom elektronkonfigurációja határozza meg: egy adott alhéjon azonos számú elektronnal rendelkező elemek ugyanabba a csoportba kerülnek (például az oxigén és a szelén ugyanabban a csoportban található, mivel mindkét elem külső p-alhéján négy elektron van). A hasonló kémiai tulajdonságokkal bíró elemek általában ugyanabban a csoportban helyezkednek el a periódusos rendszerben, de az f-mezőben és valamennyire a d-mezőben is a megegyező periódusban lévő elemek is hasonló kémiai tulajdonságokkal rendelkeznek. Ezáltal viszonylag egyszerű egy elem kémiai tulajdonságait megjósolni, ha a szomszédos elemeinek tulajdonságai ismertek.[5]
2016-ban a periódusos rendszer 118 eleme ismert az 1-es rendszámútól (hidrogén) a 118-as rendszámúig (oganesszon). A 113-as, 115-ös, 117-es és 118-as elemeket az IUPAC hivatalosan 2015 decemberében ismerte el. Javasolt neveiket: nihonium (Nh), moszkovium (Mc), tennesszin (Ts) és oganesszon (Og) 2016 júniusában jelentette be az IUPAC, hivatalossá pedig 2016 novemberében váltak.[6][7][8][9]
Az első 94 elem megtalálható a természetben, a maradék 24 elemet az ameríciumtól az oganesszonig eddig csak mesterségesen állították elő. A természetben megtalálható 94 elem közül 11 csak a természetes elemek radioaktív bomlási sorában fordul elő.[3] Sem asztáciumot (Z=85), sem az einsteiniumnál (Z=99) nehezebb elemet nem figyeltek meg még makroszkopikus mennyiségben, a franciumról pedig mindössze egy mikroszkopikus minta (300 000 atom) által kibocsátott fény segítségével készítettek fényképet.[10]
Felépítése
[szerkesztés]Csoportok
[szerkesztés]A csoportok a periódusos rendszer függőleges oszlopai. Egy adott csoport elemeinek jellemzően több hasonló tulajdonságuk van, mint az azonos periódusok, vagy mezők elemeinek. Ezeket a hasonlóságokat az atomszerkezetre vonatkozó modern kvantummechanikai elméletek azzal magyarázzák, hogy az azonos csoportbeli elemek vegyértékelektron-szerkezete megegyezik.[11] Ennek következtében az azonos csoportba tartozó elemek kémiai szempontból hasonlóan viselkednek és tulajdonságaik egyértelmű változást mutatnak az atomtömeg növekedésével.[12] Ugyanakkor a periódusos rendszer egyes részein, például a d-mezőben, vagy az f-mezőben a perióduson belüli hasonlóságok ugyanolyan, vagy még fontosabbak lehetnek.[13][14][15]
Nemzetközi elnevezési egyezmény alapján a csoportokat balról jobbra (az alkálifémektől kezdve a nemesgázokig) 1-18-ig terjedő számokkal jelölik.[16] Korábban a csoportokat római számokkal jelölték és I-től VIII-ig számozták őket. A római számok után egy A-betűt írtak, ha az elem az s- vagy p-mezőbe tartozott (ezek az ún. főcsoportok) és B-betűt, ha a d-mezőbe (mellékcsoportok). Ezen kívül még a 8-as, 9-es és 10-es csoportot egy háromszoros méretű csoportnak tekintették VIIIb csoport néven. Az új IUPAC-nevezéktan 1998-ban lépett életbe és azóta helytelenítik a régi elnevezések használatát,[17] bár Magyarországon a régi rendszer használata még mindig elterjedt.
Egyes csoportoknak hétköznapi nevük is van, például a 18-as csoportot nemesgázokként, a 17-es csoportot halogénekként is ismerik, de egyes csoportoknál a csoport első tagjából képzett nevet is használják, például széncsoport, nitrogéncsoport, oxigéncsoport. A 3-10-es csoportok elemei kevesebb hasonlóságot, vagy függőleges tendenciát mutatnak, ezért nincs is köznapi nevük, hanem egyszerűen a sorszámukat, vagy a csoport első eleméből képzett nevet használják rájuk.[16]
Az azonos csoportban lévő elemek atomsugara, ionizációs energiája és elektronegativitása jellegzetes változásokat mutat. A csoporton belül lefelé haladva az atomsugár növekszik, mivel a több betöltött elektronhéj miatt a vegyértékelektronok egyre nagyobb méretű héjra épülnek be. Az ionizációs energia a csoportokon belül csökken, mert az atommagtól távolabb lévő külső elektronokra kisebb magvonzás hat, ezért könnyebben eltávolíthatók. Ugyanezen okból csökken az elektronegativitás is.[18] E szabályszerűség alól kivétel a 11. csoport, ahol az elektronegativitás a csoportban lefelé haladva nő.[19]
Periódusok
[szerkesztés]A periódusok a periódusos rendszer vízszintes sorai. Noha az azonos csoportok tagjai általában több hasonlósággal bírnak, mint az azonos periódusok tagjai, de a periódusos rendszer egyes részein a vízszintes trendek a fontosabbak. Ilyen az f-mező, ahol a lantanoidák és az aktinoidák hasonló tulajdonságú elemek két vízszintes sorozatát alkotják.[20]
Az azonos periódusban lévő elemek atomsugara, ionizációs energiája, elektronaffinitása és elektronegativitása többé-kevésbé egyenletesen változik. A periódusban jobbra haladva az atomsugár csökken, mivel a növekvő protonszám miatt az atommag egyre erősebb vonzó hatást gyakorol az elektronokra.[21] Az atomsugár csökkenése miatt az ionizációs energia ugyanakkor balról jobbra haladva növekszik a periódusokon belül. Ennek oka az, hogy minél erősebben vonzza az atommag az elektronokat, azokat annál nehezebb eltávolítani az atomról. Az elektronegativitás is ugyanúgy a növekvő magvonzás miatt növekszik.[18] Az elektronaffinitás szintén növekedést mutat a perióduson belül: a periódus bal oldalán elhelyezkedő fémek jellemzően alacsonyabb elektronaffinitással bírnak, miint a periódus jobb oldalán található nemfémek (a nemesgázok kivételével).[22]
Mezők
[szerkesztés]
A periódusos rendszer elemeit mezőkbe lehet sorolni az alapján, hogy az elem "utolsó" elektronja melyik alhéjra épül be, így beszélhetünk s-, p-, d- és f-mezőkről.[23][* 2] Az s-mező magába foglalja az első két csoportot (az alkálifémeket és alkáliföldfémeket), valamint a hidrogént és a héliumot. A p-mezőbe az utolsó hat csoport elemei tartoznak (13-18-as csoportok, vagy III-VIII. főcsoportok) és más elemek mellett tartalmazza az összes félmfémet és nemfémet. A d-mező a 3-12 (vagy IIIb-IIb) csoportokat foglalja magába és tartalmazza az összes átmenetifémet. Az f-mező, melyet helytakarékossági okokból gyakran külön ábrázolnak a periódusos rendszer többi részétől, nem tartalmaz számozott csoportokat és a lantanoidákból és az aktinoidákból áll.[24]
Fémek, félfémek, nemfémek
[szerkesztés]
Közös fizikai és kémiai tulajdonságaik alapján az elemeket három nagyobb csoportra lehet osztani: fémekre, félfémekre és nemfémekre. A fémek jellemzően fénylő, jó elektromos- és hővezető, jól nyújtható és kalapálható, a higany kivételével szilárd anyagok, melyek egymással ötvözeteket, nemfémekkel pedig sószerű ionos vegyületeket képeznek. A nemfémek többsége színes, vagy színtelen, a hőt rosszul vezető szigetelő gáz, amelyek egymással kovalens vegyületeket alkotnak. A fémek elektronleadással könnyedén képeznek kationokat, míg a nemfémek hajlamosak inkább elektronfelvétellel anionná alakulni. A fémek és nemfémek közt helyezkednek el a félfémek, melyek tulajdonságai átmenetet képeznek a két csoport közt, vagy keverékei azoknak.[25]
A fémeket és nemfémeket fel lehet osztani további alcsoportokra, ami a fémes jelleg nemfémes jellegbe való átmenetét mutatja a periódusban balról jobbra haladva. A fémeken belül külön csoportot alkotnak a nagy reakciókészségű alkálifémek, a kevésbé reaktív alkáliföldfémek, lantanoidákg és aktinoidák, az átmenetifémek és végül a fizikailag és kémiailag is gyenge másodfajú fémek. A nemfémeket egyszerűen többatomos nemfémekre, kétatomos nemfémekre és nemesgázokra osztják. A többatomos nemfémek, melyek a félfémekhez legközelebb helyezkednek el mutatnak még némi fémes karaktert, míg a kétatomos nemfémek és az egyatomos és szinte teljesen inert nemesgázok már egyáltalán nem. Egyéb speciális csoportosítások is, például a tűzálló fémek, vagy a nemesfémek (mindkét csoport az átmenetifémek egy alcsoportja) is ismertek.[26][27]
Az elemek közös tulajdonságaik alapján való kategorizálása nem tökéletes. Minden kategóriában tulajdonságok széles spektruma jelenik meg és könnyen lehet ezek határain átfedéseket találni.[28] Például a berilliumot az alkáliföldfémek közé sorolják, de amfoter tulajdonsága és a kovalens vegyületek alkotására való hajlama mind olyan tulajdonságok, melyek inkább a másodfajú fémekre jellemzőek. Az elemek ily módon való kategorizálása legalább 1869-ig nyúlik vissza, amikor Hinrichs leírta,[29] hogy a periódusos rendszerben egyszerű határvonalakkal el lehet különíteni a hasonló tulajdonságú elemeket, például a fémeket és nemfémeket, vagy a gáz halmazállapotú elemeket. Az elemek más alapelvek szerinti besorolása is lehetséges, például geokémiai szempontok alapján a Goldschmidt-féle rendszer, vagy a Szádeczky-Kardoss-féle geokémiai rendszer szerint, vagy esetleg kristályszerkezetük szerint.
Periodikusan változó tulajdonságok
[szerkesztés]Elektronszerkezet
[szerkesztés]
A semleges atomok egy kis méretű, de nagy tömegű, pozitív töltésű, protonokból és neutronokból felépülő atommagból és az ezt körülvevő jóval ritkább, negatív töltésű elektronburokból állnak. Az atommag körül elhelyezkedő elektronokat négy kvantumszám segítségével jellemezhetjük, amelyek meghatározzák az elektron energiáját, térbeli elhelyezkedését és egyéb sajátságokat is. A főkvantumszám (n) megadja az elektron általános energiaszintjét. A szám növekedése az elektron és a mag távolságát is jelzi, ezért azt mondjuk, hogy a különböző főkvantumszámhoz tartozó elektronok különböző elektronhéjon vannak. Az n = 1, 2, 3... értékekhez tartoznak a K, L, M... héjak. A mellékvantumszám (l) a pálya impulzusmomentumát, illetve az elektron töltéseloszlásának az alakját adja meg. Egy elektron l kvantumszámainak értékei a főkvantumszámtól függnek: összesen n értéke lehet az n-1 tartományban, azaz l lehet 0, 1, 2, 3.... A mellékvantumszámok alhéjakat határoznak meg, így az l = 0, 1, 2, 3... értékekhez tartozó elektronokat s, p, d, f... elektronoknak is nevezzük. A mágneses kvantumszám (m) a pálya térbeli irányultságát adja meg, értéke 2l + 1 lehet (0, ±1, ±2...), így az s-elektronoknak csak egyféle beállása lehetséges, a p-elektronoknak viszont már három és így tovább. A negyedik kvantumszámot spinkvantumszámnak nevezik, értéke - ½ és + ½ lehet. Az atomokon belül valamennyi elektron leírható ezzel a négy kvantumszámmal és a Pauli-elv értelmében egy atomban nincs két olyan elektron, melynek mind a négy kvantumszáma megegyezne.[30]

Ezek alapján belátható, hogy közvetlen és egyszerű kapcsolat van az atomok elektronszerkezete és a periódusos rendszer formája között. A periódusos rendszer első eleme, a hidrogén egyetlen elektront tartalmaz, elektronkonfigurációja 1s1. Az ezt követő elem, a hélium két elektronnal rendelkezik, elektronszerkezete 1s2, és mivel n=1, l=0, m=0 és ms=±½, így több elektron nem is fér erre a héjra, így a hélium lezárja az első periódust. A továbbiakban is ugyanezen elvek alapján töltődnek fel az elektronok: mindig új periódus kezdődik, ha az elem leglazábban kötött elektronjának főkvantumszáma nő. Általánosan elmondható, hogy az alhéjak az n+l növekvő értékének sorrendjében töltődnek fel és abban az esetben ha két elektron n+l értéke megegyezik,a akkor előbb a kisebb n értékű az erősebben kötött. Így a második periódusban a 2p-alhéj kiépülése miatt már nyolc elektron van, de a 3d-alhéj csak a negyedik periódusban kezd el kiépülni (n+l = 5 a 3d-alhéjnál és 4 a 4s alhéjnál), a 4f-alhéj pedig csak a hatodik periódusban. A periódusos rendszer elrendezéséből adódóan az azonos oszlopban (csoportban) lévő elemek legkülső héján, vagyis a vegyértékhéján lévő elektronok száma megegyezik.[31][32]
Minthogy az elemek tulajdonságait legnagyobbrészt az elektronszerkezete határozza meg, az elemek tulajdonságai visszatérő mintázatot, vagyis periodicitást mutatnak, melyek némelyikét (atomsugár, ionizációs energia és elektronaffinitás) a lentebbi diagramok szemléltetik. A tulajdonságok e periodicitása vezetett az első periódusos rendszerek megalkotásához.[31][32]
Atomsugár
[szerkesztés]
Az atomsugár kiszámíthatóan és jól magyarázható módon változik a periódusos rendszerben. Az elemek atomsugara a periódusokban a rendszám növekedésével az alkálifémektől kezdve a nemesgázokig általánosan csökken, a csoportokon belül pedig nő. A periódusokon belüli csökkenés oka az, hogy a növekvő protonszám miatt az atommag egyre erősebb vonzó hatást gyakorol az elektronokra,[33] a csoportokon belüli növekedést pedig az okozza, hogy a vegyértékelektronok egyre nagyobb méretű héjra épülnek be. Az atomok sugara drasztikusan nő a periódusok végén lévő nemesgázok és a következő periódus elején lévő alkálifémek között.
A 4f-alhéj elektronjai, melyek a cériumtól (58-as rendszámú elem) az itterbiumig (70-es rendszámú elem) töltődnek fel, képtelenek a növekvő magtöltést hatékonyan árnyékolni. A lantanidákat közvetlenül követő elemek atomsugara lényegesen kisebb a várhatónál, és majdnem megegyezik a felettük lévő elemek atomsugarával.[34] Ennélfogva a hafniumnak gyakorlatilag megegyezik az atomsugara (és a kémiai tulajdonságai) a cirkóniuméval, hasonlóan a tantál atomsugara is közel azonos a nióbiuméval és így tovább. Ezt a jelenséget lantanoida kontrakciónak nevezik. A lantanoida kontrakció hatása a platináig figyelhető meg, ez után az inert pár effektusként ismert relativisztikus hatás elfedi azt.[35] Egy hasonló jelenség, a d-mező kontrakció figyelhető meg a d-mező és p-mező elemei közt, de ennek a hatása kevésbé hangsúlyos.[34]
Ionizációs energia
[szerkesztés]
Az első ionizációs energia a semleges atomról egy elektron eltávolításához szükséges energia, a második ionizációs energia egy második elektron eltávolításához szükséges energia és így tovább. Egy adott atomnál az egymást követő ionizációs energiák értéke mindig nagyobb az előzőnél, például a magnézium első ionizációs energiája 738 kJ/mol, a második pedig 1450 kJ/mol. Ez abból következik, hogy a második elektront már egy pozitív töltésű ionról kell leszakítani és ez mindig nagyobb energiát igényel, mint ha semleges atomról kellene eltávolítani. Nagy ugrás történik az egymást követő ionizációs energiák értékében, ha az elektront nemesgáz-szerkezetű ionról kell eltávolítani. Ismét a magnézium példáján szemléltetve: az első két ionizációs energia megfelel a két 3s elektron eltávolításához szükséges energiának, így a harmadik ionizációs energia jelentősen nagyobb, 7730 kJ/mol, mivel a harmadik elektront a nagyon stabil neonhoz hasonló elektronszerkezetű Mg2+-ionról kell leszakítani.[35]
Az ionizációs energia változására periodicitás jellemző. A periódusokon belül a rendszám növekedésével növekvő magvonzás egyre nehezebbé teszi az elektronok leszakítását, ezért a periódusokon belül az ionizációs energia tendenciaszerűen nő. A csoportokon belül a rendszám növekedésével az ionizációs energia viszont csökken, mivel a külső elektronok egyre távolabbi héjakon helyezkednek el, ahol egyre kisabb magtöltés hat rájuk és ezért egyre könnyeben leszakíthatók.[35] A periódusokon belül az ionizációs energia növekedése nem teljesen monoton. Például a III. főcsoportbeli bór első ionizációs energiája alacsonyabb az előtte lévő II. főcsoportbeli berillium első ionizációs energiájánál. Ennek oka az, hogy a bór legkülső elektronja az s-alhéjnál valamivel magasabb energiaszintű p-alhéjra kerül, ahonnan így könnyebben leszakítható. Hasonló csökkenés figyelhető meg a VI. főcsoportban, ahol a legkönnyebben leszakítható elektron ellentétes spinnel épül be az egyik p-pályára, ahonnan a másik elektronnal kialakuló elektrosztatikus taszítóerő könnyíti meg a leszakítást.
Elektronegativitás
[szerkesztés]
Az elektronegativitás az egyes atomok elektronvonzó képességét fejezi ki.[36] Az atomok elektronegativitása függ a rendszámtól és a vegyértékelektronok magtól való távolságától. Minél nagyobb egy elem elektronegativitása, annál jobban vonzza az elektronokat. Az elektronegativitás fogalmának bevezetését először Linus Pauling javasolta 1932-ben.[37] Az elektronegativitás a periódusos rendszeren belül általánosságban balról jobbra és lentről felfelé növekszik. Így a fluor a legnagyobb[* 4] és a cézium a legkisebb elektronegativitású, legalábbis azon elemek közül, melyekről pontos adatok elérhetők.[19]
Ezen általános szabály alól van néhány kivétel. A gallium és germánium elektronegativitása például nagyobb, mint a fölöttük elhelyezkedő alumínium és szilícium elektronegativitása a d-mező kontrakció miatt. A negyedik periódus közvetlenül az átmenetifémek utáni elemeinek szokatlanul kicsi az atomsugara, mivel a 3d-elektronok nem árnyékolják hatékonyan az atommag növekvő töltését és a kisebb atomméretek összefüggésben állnak a nagyobb elektronegativitással.[19]
Elektronaffinitás
[szerkesztés]
Egy atom elektronaffinitása azt az energiamennyiséget jelenti, ami akkor szabadul fel, ha a semleges atom egy elektron felvételével negatív töltésű ionná alakul. Általánosságban a nemfémek pozitívabb elektronaffinitással bírnak, mint a fémek. Az elemek közül a klórnak a legnagyobb és a higanynak a legkisebb az elektronaffinitása. Az elektronaffinitás a periódusokon belül általánosan növekszik, értéke minden periódusban a halogéneknél a legnagyobb, ugyanis ezeknél az elemeknél egy elektron felvételével stabilis nemesgázszerkezet alakul ki, és ez nagy energiafelszabadulással jár.[40]
A csoportokon belül lefelé haladva csökkenő elektronaffinitás lenne várható. A plusz elektron az atommagtól egyre távolabbi elektronhéjra lépne be, így a rá ható magvonzás is egyre kisebb lenne és ezért kevesebb energia szabadulna fel a hozzáadásakor. Ezzel szemben az elemek közel egyharmada rendellenesen viselkedik abban az értelemben, hogy a nehezebb elemek nagyobb elektronaffinitással bírnak, mint a náluk könnyebb csoporttársaik. Ezért nagyrészt a d- és f-elektronok gyenge árnyékoló hatása a felelős. A csoportok közül egyedül az alkálifémeknél figyelhető meg az egész csoportra kiterjedő egyenletes csökkenés.[41]
Fémes jelleg
[szerkesztés]Minél alacsonyabb az ionizációs energia, elektronegativitás és elektronaffinitás értéke, annál inkább fémes jellegű az adott elem. Ugyanezen értékek növekedésével a nemfémes jelleg erősödik.[42] A tulajdonságok periodikus változásából következően a fémes karakter a csoportokon belül nő, a periódusokon belül pedig általánosan csökken, néhány szabálytalansággal amit főként a d- és f-elektronok gyenge árnyékolóképessége, valamint relativisztikus hatások okoznak.[43] Így a legfémesebb elemek (mint a cézium és a francium) a periódusos rendszer bal alsó sarkában, a leginkább nemfémes jellegű elemek (oxigén, fluor és klór), pedig a jobb felső részén találhatóak. A függőleges és vízszintes változások kombinációja magyarázatul szolgál az egyes periódusos rendszerben megjelenő, fémek és nemfémek közti lépcsőzetes határvonalra, illetve az ezen vonal mentén található elemek félfémek közé való sorolásának gyakorlatára.[44][45]
Története
[szerkesztés]Első rendszerezési kísérletek
[szerkesztés]
1789-ben Antoine Lavoisier közzétett egy 33 kémiai elemet tartalmazó listát, amelyen az elemeket gázokra, fémekre, nemfémekre és földekre osztotta.[46] A következő évszázadot a vegyészek pontosabb osztályozási rendszer keresésével töltötték. 1829-ben Johann Wolfgang Döbereiner megfigyelte, hogy számos elemet kémiai tulajdonságaik alapján úgynevezett triádokba lehet sorolni. Ilyen triádot alkotott például a lítium, nátrium és kálium, vagy a klór, bróm és jód. Döbereiner észrevette, hogy a triádok középső elemének atomtömege a két másik számtani közepe,[47] ez később a triádok törvényeként vált ismertté.[48] A német kémikus, Leopold Gmelin 1843-ban tíz triádot, három négytagú és egy öttagú csoportot azonosított. Jean-Baptiste Dumas 1857-ben publikálta munkáját, amelyben leírta a fémek különböző csoportjai közti kapcsolatokat. Bár számos vegyész felismerte az elemek kisebb csoportjai közti kapcsolatokat, de még mindig szükség volt egy nagyobb, átfogó rendszerre, mely az összes elemet magába foglalja.[47]
1857-ben a német vegyész August Kekulé megfigyelte, hogy a szénhez vegyületeiben jellemzően négy másik atom kapcsolódik. A metánban például egy szénatom és négy hidrogénatom van.[49] Ez az elgondolás, vagyis, hogy a különböző elemek különböző számú atommal létesítenek kötéseket vegyérték néven vált ismertté.[50]
1862-ben a francia geológus, Alexandre-Emile Béguyer de Chancourtois közzétette a periódusos rendszer egy korai változatát, amelyet tellúr hélixnek vagy csavarnak hívott. Az elemeket növekvő atomtömegük alapján spirálisan rendezte el egy hengeren, és így világosan látszódott, hogy a hasonló tulajdonságú elemek szabályos időközönként helyezkedtek el. Táblázata azonban az elemek mellett néhány iont és vegyületet is tartalmazott és munkájában inkább geológiai, mint kémiai kifejezéseket használt, ezért nem is kapott jelentős figyelmet.[51]
1864-ben Julius Lothar Meyer közzétett egy táblázatot, amelyben 44 elemet vegyértékük szerint rendezett el. A táblázat megmutatta, hogy a hasonló tulajdonságú elemeknek gyakran megegyezett a vegyértéke.[52] Egyidejűleg, William Odling is publikálta táblázatát, amely 57 elemet tartalmazott és atomtömegük alapján rendezte el őket.
With some irregularities and gaps, he noticed what appeared to be a periodicity of atomic weights among the elements and that this accorded with "their usually received groupings".[53] Odling alluded to the idea of a periodic law but did not pursue it.[54] He subsequently proposed (in 1870) a valence-based classification of the elements.[55]

English chemist John Newlands produced a series of papers from 1863 to 1866 noting that when the elements were listed in order of increasing atomic weight, similar physical and chemical properties recurred at intervals of eight; he likened such periodicity to the octaves of music.[56][57] This so termed Law of Octaves, however, was ridiculed by Newlands' contemporaries, and the Chemical Society refused to publish his work.[58] Newlands was nonetheless able to draft a table of the elements and used it to predict the existence of missing elements, such as germanium.[59] The Chemical Society only acknowledged the significance of his discoveries five years after they credited Mendeleev.[60]
In 1867, Gustavus Hinrichs, a Danish born academic chemist based in America, published a spiral periodic system based on atomic spectra and weights, and chemical similarities. His work was regarded as idiosyncratic, ostentatious and labyrinthine and this may have militated against its recognition and acceptance.[61][62]
Mengyelejev táblázata
[szerkesztés]
Russian chemistry professor Dmitri Mendeleev and German chemist Julius Lothar Meyer independently published their periodic tables in 1869 and 1870, respectively.[63] Mendeleev's table was his first published version; that of Meyer was an expanded version of his (Meyer's) table of 1864.[64] They both constructed their tables by listing the elements in rows or columns in order of atomic weight and starting a new row or column when the characteristics of the elements began to repeat.[65]
The recognition and acceptance afforded to Mendeleev's table came from two decisions he made. The first was to leave gaps in the table when it seemed that the corresponding element had not yet been discovered.[66] Mendeleev was not the first chemist to do so, but he was the first to be recognized as using the trends in his periodic table to predict the properties of those missing elements, such as gallium and germanium.[67] The second decision was to occasionally ignore the order suggested by the atomic weights and switch adjacent elements, such as tellurium and iodine, to better classify them into chemical families. Later in 1913, Henry Moseley determined experimental values of the nuclear charge or atomic number of each element, and showed that Mendeleev's ordering actually corresponds to the order of increasing atomic number.[68]
The significance of atomic numbers to the organization of the periodic table was not appreciated until the existence and properties of protons and neutrons became understood. Mendeleev's periodic tables used atomic weight instead of atomic number to organize the elements, information determinable to fair precision in his time. Atomic weight worked well enough in most cases to (as noted) give a presentation that was able to predict the properties of missing elements more accurately than any other method then known. Substitution of atomic numbers, once understood, gave a definitive, integer-based sequence for the elements, and Moseley predicted (in 1913) that the only elements still missing between aluminium (Z=13) and gold (Z=79) were Z = 43, 61, 72 and 75, all of which were later discovered. The sequence of atomic numbers is still used today even as new synthetic elements are being produced and studied.[69]
Második verzió és további fejlődés
[szerkesztés]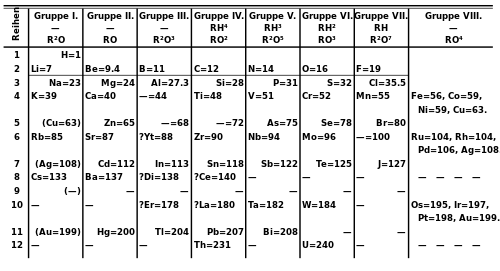
In 1871, Mendeleev published his periodic table in a new form, with groups of similar elements arranged in columns rather than in rows, and those columns numbered I to VIII corresponding with the element's oxidation state. He also gave detailed predictions for the properties of elements he had earlier noted were missing, but should exist.[70] These gaps were subsequently filled as chemists discovered additional naturally occurring elements.[71] It is often stated that the last naturally occurring element to be discovered was francium (referred to by Mendeleev as eka-caesium) in 1939.[72] However, plutonium, produced synthetically in 1940, was identified in trace quantities as a naturally occurring element in 1971.[73]
The popular[74] periodic table layout, also known as the common or standard form (as shown at various other points in this article), is attributable to Horace Groves Deming. In 1923, Deming, an American chemist, published short (Mendeleev style) and medium (18-column) form periodic tables.[75][n 1] Merck and Company prepared a handout form of Deming's 18-column medium table, in 1928, which was widely circulated in American schools. By the 1930s Deming's table was appearing in handbooks and encyclopaedias of chemistry. It was also distributed for many years by the Sargent-Welch Scientific Company.[76][77][78]
With the development of modern quantum mechanical theories of electron configurations within atoms, it became apparent that each period (row) in the table corresponded to the filling of a quantum shell of electrons. Larger atoms have more electron sub-shells, so later tables have required progressively longer periods.[79]

In 1945, Glenn Seaborg, an American scientist, made the suggestion that the actinide elements, like the lanthanides, were filling an f sub-level. Before this time the actinides were thought to be forming a fourth d-block row. Seaborg's colleagues advised him not to publish such a radical suggestion as it would most likely ruin his career. As Seaborg considered he did not then have a career to bring into disrepute, he published anyway. Seaborg's suggestion was found to be correct and he subsequently went on to win the 1951 Nobel Prize in chemistry for his work in synthesizing actinide elements.[80][81][n 2]
Although minute quantities of some transuranic elements occur naturally,[3] they were all first discovered in laboratories. Their production has expanded the periodic table significantly, the first of these being neptunium, synthesized in 1939.[82] Because many of the transuranic elements are highly unstable and decay quickly, they are challenging to detect and characterize when produced. There have been controversies concerning the acceptance of competing discovery claims for some elements, requiring independent review to determine which party has priority, and hence naming rights.[83] In 2010, a joint Russia–US collaboration at Dubna, Moscow Oblast, Russia, claimed to have synthesized six atoms of tennessine (element 117), making it the most recently claimed discovery. It, along with nihonium (element 113), moscovium (element 115), and oganesson (element 118), are the four most recently named elements, whose names all became official on 28 November 2016.[84]
Megjegyzések
[szerkesztés]- ↑ Az elemek, melyeket először mesterségesen állítottak elő és csak utána a fedezték fel a természetben a technécium (43), a prométium (61), az asztácium (85), a neptúnium (93) és a plutónium (94)
- ↑ A helyzetet bonyolítja, hogy a héliumot, bár s-mezőbeli elem a p-mező elemei közt tüntetik fel, a d-mező pedig valójában nem a 12., hanem már a 11. csoportnál betöltődik
- ↑ A nemesgázok, az asztácium, a francium és az ameríciumnál nehezebb elemek nem szerepelnek a diagramon, mert atomsugaraik nem ismertek.
- ↑ Míg a Pauling-skála szerint a fluor elektronegativitása a legnagyobb, más skálák, például az Allen-skála szerint a neon a legelektronegatívabb.
- ↑ An antecedent of Deming's 18-column table may be seen in Adams' 16-column Periodic Table of 1911. Adams omits the rare earths and the "radioactive elements" (i.e. the actinides) from the main body of his table and instead shows them as being "careted in only to save space" (rare earths between Ba and eka-Yt; radioactive elements between eka-Te and eka-I). See: Elliot Q. A. (1911). "A modification of the periodic table". Journal of the American Chemical Society. 33(5): 684–688 (687).
- ↑ A second extra-long periodic table row, to accommodate known and undiscovered elements with an atomic weight greater than bismuth (thorium, protactinium and uranium, for example), had been postulated as far back as 1892. Most investigators, however, considered that these elements were analogues of the third series transition elements, hafnium, tantalum and tungsten. The existence of a second inner transition series, in the form of the actinides, was not accepted until similarities with the electron structures of the lanthanides had been established. See: van Spronsen, J. W. (1969). The periodic system of chemical elements. Amsterdam: Elsevier. p. 315–316, ISBN 0-444-40776-6.
Jegyzetek
[szerkesztés]- ↑ Chemistry: Four elements added to periodic table. BBC News, 2016. január 4.
- ↑ St. Fleur, Nicholas: Four New Names Officially Added to the Periodic Table of Elements. New York Times, 2016. december 1.
- ↑ a b c Emsley, J.. Nature's Building Blocks: An A-Z Guide to the Elements, New, New York, NY: Oxford University Press (2011). ISBN 978-0-19-960563-7
- ↑ Greenwood & Earnshaw, pp. 24–27
- ↑ Gray, p. 6
- ↑ CNN, Ashley Strickland: New elements on the periodic table are named. CNN . (Hozzáférés: 2016. június 11.)
- ↑ Discovery and assignment of elements with atomic numbers 113, 115, 117 and 118. International Union of Pure and Applied Chemistry, 2015. december 30.
- ↑ Hello, Nihonium. Scientists Name 4 New Elements On The Periodic Table. NPR.org . (Hozzáférés: 2016. június 11.)
- ↑ Koppenol, W. H. (2002). „Naming of New Elements (IUPAC Recommendations 2002)” (PDF). Pure and Applied Chemistry 74 (5), 787–791. o. DOI:10.1351/pac200274050787.
- ↑ Silva, Robert J.. Fermium, Mendelevium, Nobelium and Lawrencium, The Chemistry of the Actinide and Transactinide Elements, 3rd, Dordrecht, The Netherlands: Springer Science+Business Media (2006). ISBN 1-4020-3555-1
- ↑ Scerri 2007, p. 24
- ↑ Messler, R. W.. The essence of materials for engineers. Sudbury, MA: Jones & Bartlett Publishers, 32. o. (2010). ISBN 0-7637-7833-8
- ↑ Bagnall, K. W.. Advances in chemistry, Lanthanide/Actinide chemistry, Advances in Chemistry. American Chemical Society, 1–12. o.. DOI: 10.1021/ba-1967-0071 (1967). ISBN 0-8412-0072-6
- ↑ Theoretical inorganic chemistry, 2nd, New York: Nostrand-Rienhold Book Corporation, 103. o. (1969). ISBN 0-7637-7833-8
- ↑ Chemistry in context, 5th, Walton-on-Thames: Nelson Thornes, 40. o. (2000). ISBN 0-17-448276-0
- ↑ a b Leigh, G. J.. Nomenclature of Inorganic Chemistry: Recommendations 1990. Blackwell Science (1990). ISBN 0-632-02494-1
- ↑ (1988) „New Notations in the Periodic Table”. Pure Appl. Chem. 60 (3), 431–436. o, Kiadó: IUPAC. DOI:10.1351/pac198860030431. (Hozzáférés: 2012. március 24.)
- ↑ a b Moore, p. 111
- ↑ a b c Greenwood & Earnshaw, p. 30
- ↑ Stoker, S. H.. General, organic, and biological chemistry. New York: Houghton Mifflin, 68. o. (2007). ISBN 978-0-618-73063-6. OCLC 52445586
- ↑ Mascetta, J.. Chemistry The Easy Way, 4th, New York: Hauppauge, 50. o. (2003). ISBN 978-0-7641-1978-1. OCLC 52047235
- ↑ Chemistry and Chemical Reactivity, Volume 2, 7th, Belmont: Thomson Brooks/Cole, 324. o. (2009). ISBN 978-0-495-38712-1. OCLC 220756597
- ↑ Gray, p. 12
- ↑ Jones, C.. d- and f-block chemistry. New York: J. Wiley & Sons, 2. o. (2002). ISBN 978-0-471-22476-1. OCLC 300468713
- ↑ Chemistry: The molecular nature of matter and change, 4th, New York: McGraw-Hill, 536. o. (2006). ISBN 0-07-111658-3
- ↑ Fatigue and durability of structural materials. Materials Park, Ohio: ASM International, 376. o. (2006). ISBN 0-87170-825-6
- ↑ Technology guide: Principles, applications, trends. Berlin: Springer-Verlag, 8. o. (2009). ISBN 978-3-540-88545-0
- ↑ Jones, B. W.. Pluto: Sentinel of the outer solar system. Cambridge: Cambridge University Press, 169–71. o. (2010). ISBN 978-0-521-19436-5
- ↑ Hinrichs, G. D. (1869). „On the classification and the atomic weights of the so-called chemical elements, with particular reference to Stas's determinations”. Proceedings of the American Association for the Advancement of Science 18 (5), 112–124. o.
- ↑ Greenwood & Earnshaw, p. 29-30
- ↑ a b Myers, R.. The basics of chemistry. Westport, CT: Greenwood Publishing Group, 61–67. o. (2003). ISBN 0-313-31664-3
- ↑ a b Chang, R.. Chemistry, 7, New York: McGraw-Hill, 289–310; 340–42. o. (2002). ISBN 0-07-112072-6
- ↑ Mascetta, J.. Chemistry The Easy Way, 4th, New York: Hauppauge, 50. o. (2003). ISBN 978-0-7641-1978-1. OCLC 52047235
- ↑ a b Modern Inorganic Chemistry, 2nd, McGraw-Hill, 22. o. (1991). ISBN 978-0-07-112651-9
- ↑ a b c Greenwood & Earnshaw, p. 28
- ↑ Electronegativity, A kémiai terminológia kompendiuma – Arany könyv (internetes kiadás). International Union of Pure and Applied Chemistry
- ↑ Pauling, L. (1932). „The Nature of the Chemical Bond. IV. The Energy of Single Bonds and the Relative Electronegativity of Atoms”. Journal of the American Chemical Society 54 (9), 3570–3582. o. DOI:10.1021/ja01348a011.
- ↑ Huheey, Keiter & Keiter, p. 42
- ↑ Concise chemistry of the elements. Chichester: Horwood Publishing, 35‒36. o. (2002). ISBN 1-898563-71-3
- ↑ Forráshivatkozás-hiba: Érvénytelen
<ref>címke; nincs megadva szöveg a(z)changnevű lábjegyzeteknek - ↑ Huheey, Keiter & Keiter, pp. 42, 880–81
- ↑ Chemistry, 2nd, Harcourt Brace Jovanovich, 58. o. (1975). ISBN 0-15-506465-7
- ↑ Huheey, Keiter & Keiter, pp. 880–85
- ↑ Sacks, O.. Uncle Tungsten: Memories of a chemical boyhood. New York: Alfred A. Knopf, 191, 194. o. (2009). ISBN 0-375-70404-3
- ↑ Gray, p. 9
- ↑ Siegfried, R.. From elements to atoms a history of chemical composition. Philadelphia, Pennsylvania: Library of Congress Cataloging-in-Publication Data, 92. o. (2002). ISBN 0-87169-924-9
- ↑ a b Ball, p. 100
- ↑ Horvitz, L.. Eureka!: Scientific Breakthroughs That Changed The World. New York: John Wiley, 43. o. (2002). ISBN 978-0-471-23341-1. OCLC 50766822
- ↑ Aug. Kekulé (1857). „Über die s. g. gepaarten Verbindungen und die Theorie der mehratomigen Radicale”. Annalen der Chemie und Pharmacie 104 (2), 129–150. o. DOI:10.1002/jlac.18571040202.
- ↑ van Spronsen, J. W.. The periodic system of chemical elements. Amsterdam: Elsevier, 19. o. (1969). ISBN 0-444-40776-6
- ↑ Alexandre-Emile Bélguier de Chancourtois (1820-1886) (french nyelven). Annales des Mines history page. (Hozzáférés: 2014. szeptember 18.)
- ↑ Venable, pp. 85–86; 97
- ↑ Odling, W. (2002). „On the proportional numbers of the elements”. Quarterly Journal of Science 1, 642–648 (643). o.
- ↑ Scerri, E.. The periodic table: A very short introduction. Oxford: Oxford University Press (2011). ISBN 978-0-19-958249-5
- ↑ Kaji, M.. Discovery of the periodic law: Mendeleev and other researchers on element classification in the 1860s, The periodic table: Into the 21st Century. Research Studies Press, 91–122 (95). o. (2004). ISBN 0-86380-292-3
- ↑ Newlands, J. A. R. (1864. augusztus 20.). „On Relations Among the Equivalents”. Chemical News 10, 94–95. o.
- ↑ Newlands, J. A. R. (1865. augusztus 18.). „On the Law of Octaves”. Chemical News 12, 83. o.
- ↑ Bryson, B.. A Short History of Nearly Everything. Black Swan, 141–142. o. (2004). ISBN 978-0-552-15174-0
- ↑ Scerri 2007, p. 306
- ↑ (1965) „The Atomic Debates: 'Memorable and Interesting Evenings in the Life of the Chemical Society'”. Isis 56 (1), 5–25. o, Kiadó: The University of Chicago Press. DOI:10.1086/349922.
- ↑ Scerri 2007, pp. 87, 92
- ↑ Kauffman, G. B. (1969. március 1.). „American forerunners of the periodic law”. Journal of Chemical Education 46 (3), 128–135 (132). o. DOI:10.1021/ed046p128.
- ↑ Mendelejew, D. (1869). „Über die Beziehungen der Eigenschaften zu den Atomgewichten der Elemente” (german nyelven). Zeitschrift für Chemie, 405–406. o.
- ↑ Venable, pp. 96–97; 100–102
- ↑ Ball, pp. 100–102
- ↑ Pullman, B.. The Atom in the History of Human Thought, Translated by Axel Reisinger, Oxford University Press, 227. o. (1998). ISBN 0-19-515040-6
- ↑ Ball, p. 105
- ↑ Atkins, P. W.. The Periodic Kingdom. HarperCollins Publishers, Inc., 87. o. (1995). ISBN 0-465-07265-8
- ↑ (2007) „Predictions of alpha decay half lives of heavy and superheavy elements”. Nucl. Phys. A 789, 142–154. o. DOI:10.1016/j.nuclphysa.2007.04.001.
- ↑ Scerri 2007, p. 112
- ↑ Kaji, M. (2002). „D.I. Mendeleev's Concept of Chemical Elements and the Principle of Chemistry”. Bull. Hist. Chem. 27 (1), 4–16. o, Kiadó: Tokyo Institute of Technology. (Hozzáférés: 2012. június 11.)
- ↑ Francium (Atomic Number 87), the Last Discovered Natural Element. The Chemical Educator, 2005. szeptember 25. (Hozzáférés: 2007. március 26.)
- ↑ (1971) „Detection of Plutonium-244 in Nature”. Nature 234 (5325), 132–134. o. DOI:10.1038/234132a0.
- ↑ Gray, p. 12
- ↑ Deming, H. G.. General chemistry: An elementary survey. New York: J. Wiley & Sons, 160, 165. o. (1923)
- ↑ Periodicity:A source book module, version 1.0. New York: Chemsource, Inc., 3. o.
- ↑ Emsley, J. (1985. március 7.). „Mendeleyev's dream table”. New Scientist, 32–36(36). o.
- ↑ Fluck, E. (1988). „New notations in the period table”. Pure & Applied Chemistry 60 (3), 431–436 (432). o. DOI:10.1351/pac198860030431.
- ↑ Ball, p. 111
- ↑ Scerri 2007, pp. 270‒71
- ↑ Chemistry: Principles and reactions, 7th, Belmont, CA: Brooks/Cole Cengage Learning, 173. o.. ISBN 1-111-42710-0
- ↑ Ball, p. 123
- ↑ (2011) „Discovery of the elements with atomic numbers greater than or equal to 113 (IUPAC Technical Report)”. Pure Appl. Chem. 83 (7), 1485. o. DOI:10.1351/PAC-REP-10-05-01.
- ↑ Эксперимент по синтезу 117-го элемента получает продолжение (orosz nyelven). JINR, 2012
Források
[szerkesztés]- Ball, P.. The Ingredients: A Guided Tour of the Elements. Oxford: Oxford University Press (2002). ISBN 0-19-284100-9
- Chang, R.. Chemistry, 7th, New York: McGraw-Hill Higher Education (2002). ISBN 978-0-19-284100-1
- Gray, Theodore. The Elements: A Visual Exploration of Every Known Atom in the Universe. New York: Black Dog & Leventhal Publishers (2009). ISBN 978-1-57912-814-2
- Chemistry of the Elements. Pergamon Press (1984. december 7.). ISBN 0-08-022057-6
- Principles of structure and reactivity, 4th, New York: Harper Collins College Publishers. ISBN 0-06-042995-X
- Moore, J.. Chemistry For Dummies. New York: Wiley Publications, 111. o. (2003). ISBN 978-0-7645-5430-8
- Scerri, Eric. The periodic table: Its story and its significance. Oxford: Oxford University Press (2007). ISBN 0-19-530573-6
- Scerri, Eric. The periodic table: A very short introduction. Oxford: Oxford University Press (2011). ISBN 978-0-19-958249-5
- Venable, F. P.. The Development of the Periodic Law. Easton, Pennsylvania: Chemical Publishing Company (1896)
Fordítás
[szerkesztés]Ez a szócikk részben vagy egészben a periodic table című angol Wikipédia-szócikk ezen változatának fordításán alapul. Az eredeti cikk szerkesztőit annak laptörténete sorolja fel. Ez a jelzés csupán a megfogalmazás eredetét és a szerzői jogokat jelzi, nem szolgál a cikkben szereplő információk forrásmegjelöléseként.


