Sikimisav
| Sikimisav | |||
 |
 3D modellje | ||
| IUPAC-név | (3R,4S,5R)-3,4,5-trihidroxiciklohex-1-én-1-karbonsav | ||
| Kémiai azonosítók | |||
|---|---|---|---|
| CAS-szám | 138-59-0 | ||
| PubChem | 8742 | ||
| ChemSpider | 8412 | ||
| EINECS-szám | 205-334-2 | ||
| KEGG | C00493 | ||
| ChEBI | 16119 | ||
| |||
| |||
| InChIKey | JXOHGGNKMLTUBP-HSUXUTPPSA-N | ||
| ChEMBL | 290345 | ||
| Kémiai és fizikai tulajdonságok | |||
| Kémiai képlet | C7H10O5 | ||
| Moláris tömeg | 174,15 g/mol | ||
| Olvadáspont | 185–187 °C | ||
| Ha másként nem jelöljük, az adatok az anyag standardállapotára (100 kPa) és 25 °C-os hőmérsékletre vonatkoznak. | |||
A sikimisav, általánosabban ismert anionos formájában a sikimát, szerves vegyület, molekulájában ciklohexén, ciklitol és karbonsav funkció található. Fontos biokémiai metabolit növényekben és mikroorganizmusokban. Nevét a japán sikimi (シキミ, azaz japán csillagánizs, tudományos nevén Illicium anisatum) növényről kapta, amelyből először 1885-ben izolálta Johan Fredrik Eykman.[1] Molekulaszerkezetét csaknem 50 évvel később határozták meg.[2]
Az IARC listájára mint 3-as típusú biológiai vegyület került fel, amely a besorolás szerint az emberre nézve nem rákkeltő tulajdonságú, ám azt javasolják, hogy bizonyos magas sikimisav-tartalmú növényeket ne nyersen fogyasszunk, hanem főzés, sütés, pörkölés során hagyjuk, hogy a benne levő sikimisav elbomoljon.[3]
Egyes hidrolizálható tanninokban a sikimisav alkotja a glikozidos részt.
Bioszintézise
[szerkesztés]Foszfoenolpiruvát és eritróz-4-foszfát reakciójából 3-dezoxi-D-arabinoheptulozonát-7-foszfát (DAHP) keletkezik, DAHP szintáz enzim katalizációjával. A DAHP ezután – DHQ szintáz katalizálta reakcióban – 3-dehidrokináttá (DHQ) alakul át. Bár a reakció kofaktorként nikotinamid-adenin-dinukleotidot, azaz NAD-ot igényel, enzimatikus reakciók ezt regenerálják, így nettó felhasználása nem történik.
A DHQ a 3-dehidrokinát dehidratáz enzim segítségével 3-dehidrosikimisavvá dehidratálódik, amely aztán tovább redukálódik a sikimát dehidrogenáz aktivitása során, miközben nikotinamid-adenin-dinukleotid-foszfát, azaz NADPH használódik fel.
Sikimát útvonal
[szerkesztés]Aromás aminosavak bioszintézise
[szerkesztés]A sikimisav útvonal 7 lépéses metabolizmus, amelyet baktériumok, gombák, algák, paraziták és növények alkalmaznak aromás aminosavak (fenil-alanin, tirozin és triptofán) szintetizálásához. Ez az útvonal állatokban nem található meg, ezért számukra a fenilalanin és triptofán esszenciális aminosavak, melyek csak táplálkozással vihetők be (az állatok képesek tirozint szintetizálni fenilalaninból, így az csak a fenilketonuriában szenvedő betegek esetében esszenciális, akik nem tudják hidroxilálni a fenilalanint.)
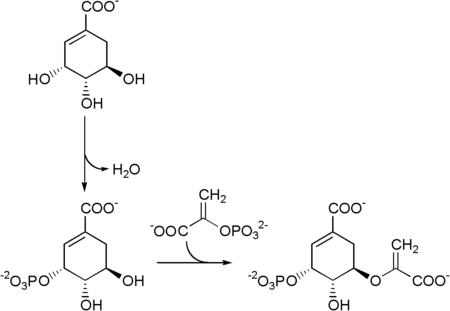
Az útvonal első enzime a sikimát kináz, ez a sikimisav ATP-függő foszforilációját katalizálja, hogy az sikimát-3-foszfáttá alakulhasson.[4] A sikimát-3-foszfátot ezután az 5-enolpiruvilsikimát-3-foszfát (EPSP) szintáz enzim egy foszfoenolpiruváttal kapcsolja, így 5-enolpiruvilsikimát-3-foszfát keletkezik.
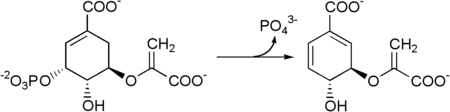
Ezt követően az 5-enolpiruvilsikimát-3-foszfát korizmáttá alakul, amit a korizmát szintáz enzim katalizál.
A következő lépésben a korizmátból – a korizmát mutáz által katalizált Claisen-átrendeződéssel – prefénsav szintetizálódik.[5][6]
A prefenát oxidatív dekarboxilációja során a hidroxilcsoport retenciójával p-hidroxifenilpiruvát keletkezik, amely glutamát, mint nitrogénforrás felhasználásával transzaminálódik, így tirozin és α-ketoglutarát jön létre.
Fenolikumok szintézisének kezdő pontja
[szerkesztés]A fenilalanin és a tirozin a fenolpropanoidok szintézisének perkurzorai. Fenolpropanoidokból képződnek később a flavonoidok, kumarinok, tanninok és ligninek. Az első belépő enzim a fenilalanin-ammónia-liáz (PAL) amely egy L-fenilalanint változtat transz-fahéjsavvá és ammóniává.
Galluszsav bioszintézis
[szerkesztés]A galluszsav 3-dehidrosikimátból keletkezik, melyet a sikimát dehidrigenáz enzim 3,5-didehidrosikimáttá alakít, majd ez utóbbi vegyület spontán galluszsavvá rendeződik át.[7]
Más vegyületek
[szerkesztés]A sikimisav még az alábbi vegyületek prekurzor:
- indol, az indolból származtathatóak aminosavak, aromás aminosavak, egyik fontosabbikuk a triptofán, amelyből alakulnak más, pszichedelikus, hallucinogén vegyületek is, mint a dimetil-triptamin
- sok más alkaloid és aromás anyagcseretermék
Mikrospóraszerű aminosavak
[szerkesztés]Apró, másodlagos metabolitok, amelyeket erősen napsütötte területeken élő szervezetek állítanak elő, általában tengeri életközösségekben.
Felhasználás
[szerkesztés]A gyógyszeriparban a csillagánizsból való kivonatot használják (Illicium verum) amely alapanyaga az oseltamivir (Tamiflu) gyártásának. Bár a sikimisav megjelenik a legtöbb autotróf szervezetben, egy bioszintetikus intermedier így többnyire nagyon alacsony koncentrációban fordul elő. A csillagánizsból kivonható alacsony sikimisav mennyiséggel magyarázzák a 2005-ös oseltamivir hiányt is. Sikimisav kinyerhető az amerikai ámbrafából is amelyből Észak-Amerikában jelentős mennyiség található. De felhasználása arányaiban nem kifizetődő, mivel a belőle származtatható hozam, 1,5%. Például: 4 kg mag volna szükséges 14 doboz Tamiflu előállításához. Összehasonlításképpen, a csillagánizsból kinyert sikimisavból 3-7% hozamot kapunk.[8][9][10] Egy 2010-es Maine Universityn végzett tanulmány szerint a sikimisav kivonható néhány fenyőtípus magjából is.[11]
Aminosikimisav a sikimisav egy alternativája, az oseltamivir gyártásának egy kiinduló anyaga.
Gyógyszerek-növényirtószerek előállítása
[szerkesztés]A sikimát felhasználható (6S)-6-Fluorosikimisav előállítására,[12] amely egy olyan antibiotikum, amely képes gátolni az aromás bioszintetikus útvonalakat.[13]
Glifozát, aktív összetevőként a herbicid szerekben, úgy hat, hogy megzavarja a növények sikimisav metabolizmusát. Specifikusabban, a glifozát gátol egy enzimet, az 5-enolpiruvilsikimát-3-foszfát szintáz-t (EPSPS).
Lásd még
[szerkesztés]- Aminosikimát útvonal, egy újabb, alternatív sikimát útvonal.
Könyvek
[szerkesztés]- The shikimate pathway, E. Haslam, 2 editions - first published in 1974
- Shikimic acid, E. Haslam, 1 edition - first published in 1993
Fordítás
[szerkesztés]Ez a szócikk részben vagy egészben a Shikimic acid című angol Wikipédia-szócikk fordításán alapul. Az eredeti cikk szerkesztőit annak laptörténete sorolja fel. Ez a jelzés csupán a megfogalmazás eredetét és a szerzői jogokat jelzi, nem szolgál a cikkben szereplő információk forrásmegjelöléseként.
Jegyzetek
[szerkesztés]- ↑ The Botanical Relations of Illicium Religiosum, Sieb., Illicium Anisatum, Lour. J. F. Eykman, American Journal of Pharmacy, 1881, volume 53, Number 8 (article)
- ↑ Liquidambar styraciflua: a renewable source of shikimic acid. Liza B. Enrich, Margaret L. Scheuermann, Ashley Mohadjer, Kathryn R. Matthias, Chrystal F. Eller, M. Scott Newman, Michael Fujinaka and Thomas Poon, Tetrahedron Letters, 2008, volume 49, pages 2503–2505, doi:10.1016/j.tetlet.2008.02.140
- ↑ Carcinogenicity of bracken and shikimic acid. I. A. Evans and M. A. Osman, Nature, 26 July 1974, volume 250, pages 348-349, doi:10.1038/250348a0
- ↑ (1999) „The Shikimate Pathway”. Annual Review of Plant Physiology and Plant Molecular Biology 50, 473–503. o. DOI:10.1146/annurev.arplant.50.1.473. PMID 15012217.
- ↑ Helmut Goerisch (1978). „On the mechanism of the chorismate mutase reaction”. Biochemistry 17 (18), 3700. o. DOI:10.1021/bi00611a004.
- ↑ Peter Kast, Yadu B. Tewari, Olaf Wiest, Donald Hilvert, Kendall N. Houk, and Robert N. Goldberg (1997). „Thermodynamics of the Conversion of Chorismate to Prephenate: Experimental Results and Theoretical Predictions”. J. Phys. Chem. B 101 (50), 10976–10982. o. DOI:10.1021/jp972501l.
- ↑ Gallic acid pathway on metacyc.org
- ↑ Bradley, David (2005. december 1.). „Star role for bacteria in controlling flu pandemic?”. Nature Reviews Drug Discovery 4 (12), 945–946. o. DOI:10.1038/nrd1917. PMID 16370070. (Hozzáférés: 2007. március 7.)
- ↑ Marco Krämer, Johannes Bongaertsa, Roel Bovenberga, Susanne Kremera, Ulrike Müllera, Sonja Orfa, Marcel Wubboltsa, Leon Raevena. (2003). „Metabolic engineering for microbial production of shikimic acid”. Metabolic Engineering 5 (4), 277–283. o. DOI:10.1016/j.ymben.2003.09.001. PMID 14642355. (Hozzáférés: 2015. július 12.)
- ↑ Johansson Louise, Lindskog Anna, Silfversparre Gustav, Cimander Christian, Nielsen Kristian Fog, Liden Gunnar (2005). „Shikimic acid production by a modified strain of E. coli (W3110.shik1) under phosphate-limited and carbon-limited conditions”. Biotechnology and Bioengineering 92 (5), 541–552. o. DOI:10.1002/bit.20546. PMID 16240440.
- ↑ Maine pine needles yield valuable Tamiflu material, Boston.com, November 7, 2010
- ↑ Archivált másolat. [2016. március 4-i dátummal az eredetiből archiválva]. (Hozzáférés: 2015. július 12.)
- ↑ Archivált másolat. [2016. április 6-i dátummal az eredetiből archiválva]. (Hozzáférés: 2015. július 12.)