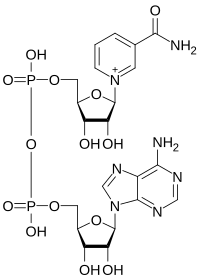
Nikotinamid-adenin-dinukleotid
| Nikotinamid-adenin-dinukleotid | |
| |
| Kémiai azonosítók | |
|---|---|
| CAS-szám | 53-84-9 |
| PubChem | 925 |
| MeSH | Nicotinamide-Adenine+Dinucleotide |
| Kémiai és fizikai tulajdonságok | |
| Kémiai képlet | C21H27N7O14P2 |
| Moláris tömeg | 663,425 g/mol |
| Ha másként nem jelöljük, az adatok az anyag standardállapotára (100 kPa) és 25 °C-os hőmérsékletre vonatkoznak. | |



A nikotinamid-adenin-dinukleotid (NAD+) és a nikotinamid-adenin-dinukleotid-foszfát (NADP+) az élő sejtekben megtalálható két igen fontos biokémiai kofaktor. Alapvető szerepük van az elektronok szállításában a redoxpotenciál-transzfer során.
A NADH a NAD+ redukált alakja, míg a NAD+ a NADH oxidált alakja. Ugyanígy a NADPH a NADP+ redukált megfelelője, a NADP+ pedig a NADPH oxidált megfelelője.
Habár csak egyetlen foszfát-csoportban különböznek, a NADH és a NADPH eltérő biokémiai funkciót töltenek be: A NADH a sejtlégzés részét képező glikolízis és citromsav-ciklus kofaktora, míg a NADPH a nukleinsavak és zsírsavak bioszintéziséhez szükséges.
Szintézis
[szerkesztés]A sejtek a NAD+-ot a B3 vitamin (niacin) egyik származékából, a nikotinamidból szintetizálják. A nikotinamid egy ribóz és egy ADP kapcsolódásával alakul NAD+-dá. A NAD+ adenil-nukleotidjának 2' helyére észteresen kapcsolt foszfáttal alakul ki a NADP+.
NAD+/NADH
[szerkesztés]A sejtek a NAD-ot niacinból szintetizálják és redoxreakciók során elektrontranszportra használják. Ekkor a NAD egy elektronpárt és egy protont felvéve NADH-vá redukálódik, és egy további proton (H+) szabaddá válik.
- MH2 + NAD+ → NADH + H+ + M: + energia; ahol M valamely metabolit.
Két hidrogénatomot (pontosabban egy hidridiont és egy protont) ad le a metabolit. A proton oldatba kerül, míg a hidridion egyik elektronja a NAD töltéshordozó nitrogénjére, a maradék hidrogénatom pedig ezzel a nitrogénnel átellenes szénhez kapcsolódik.
A NADH-ban elraktározott redoxpotenciál vagy ATP-képződésre fordítódik az aerob légzés elektron-transzportja segítségével vagy anabolikus reakciókra fordítódik. Az ATP a sejtek univerzális energiahordozója, és a NADH felhasználása alapvető fontosságú előállításukhoz. Azonban bizonyos körülmények között (például hypoxia) az oxidált NAD+ aerob regenerációja elégtelen a sejt azonnali ATP-szükségletének a fedezésére, ezzel szemben a glikolízis oxigén hiányában is képes a NADH-t NAD+-dá oxidálni (fermentáció).
NADP+/NADPH
[szerkesztés]A NADP anabolikus reakciók – zsírsav- és nukleinsav-szintézis – redukáló ágense. A színtestekben a NADP oxidálószer, szerepe a fotoszintézis bevezető reakcióiban elsődleges. Az itt megtermelt NADPH a Calvin-ciklus bioszintetikus reakcióiban redukáló ágensként jelenik meg.
Élettani hatás
[szerkesztés]Jelenleg a NAD+ koenzimet önmagában semmilyen betegség kezelésére nem használják, de potenciálisan hasznos lehet a neurodegeneratív betegségek, mint például az Alzheimer-kór és a Parkinson-kór kezelésében.[1] Az ilyen célú felhasználással kapcsolatos, egereken végzett kísérletek ígéretesek,[2] bár egy klinikai teszt során a placebó kontrollcsoporthoz képest nem tapasztaltak javulást.[3]
A NAD+ közvetlenül hat a gümőkór kezelésére használt izoniazid nevű hatóanyagra. (Az izoniazid egy gyógyszer előanyag, (angolul: prodrug), amelyet - miután behatolt a tuberkulózist okozó baktériumba - egy peroxidáz aktivál, szabad gyökké alakítva azt.[4] Ez a szabad gyök reakcióba lép az NADH-val, és olyan addíciós vegyületeket hoz létre, amelyek erősen gátolják az enoil-acilt hordozó proteint,[5] illetve a dihidrofolátot redukáló enzimeket.[6]
Mivel számos oxidoreduktáz vegyület használ NAD+-t és NADH-t szubsztrátumként, az a tény, hogy az NAD+-alapú inhibálószerek egy adott enzimre hatnak, meglepő.[7] Mivel az NAD+ enzim a purin metabolizmusában játszik szerepet, ezek a vegyületek hasznosak lehetnek rákellenes, vírusölő, és immunoszuppresszív hatóanyagok előállításában.[7][8] Egyéb gyógyszerek nem enzimgátlók, hanem az NAD+ metabolizmusában érintett enzimeket aktiválják. A szirtuinok különösen érdekes célpontjai ezeknek a hatóanyagoknak, mivel NAD-függő deacetilázok aktiválása növeli az élettartamot.[9] Egyes vegyületek, mint például a rezveratrol, növelik ezeknek az enzimeknek a hatását, így fontos szerepet tölthetnek be az élettartam meghosszabbításában úgy a gerinceseknél,[10] mint a gerinctelen állatoknál.[11][12]
A NAD+ ígéretesnek tűnik új antibiotikumok kifejlesztésében is.[13][14] Így például, a nikotinamidot nikotinsavvá átalakító nikotinamidáz enzim fontos gyógyszerek alapanyaga lehet, mivel az embernél hiányzik, de jelen van az élesztőben és baktériumokban.[15]
Kereskedelmi forgalomban is elérhető
[szerkesztés]ENADA[16]
Jegyzetek
[szerkesztés]- ↑ Belenky P, Bogan KL, Brenner C (2007). „NAD+ metabolism in health and disease” (PDF). Trends Biochem. Sci. 32 (1), 12–9. o. [2009. július 4-i dátummal az eredetiből archiválva]. DOI:10.1016/j.tibs.2006.11.006. PMID 17161604. (Hozzáférés: 2007. december 23.)
- ↑ Kaneko S, Wang J, Kaneko M, et al. (2006). „Protecting axonal degeneration by increasing nicotinamide adenine dinucleotide levels in experimental autoimmune encephalomyelitis models”. J. Neurosci. 26 (38), 9794–804. o. DOI:10.1523/JNEUROSCI.2116-06.2006. PMID 16988050.
- ↑ Swerdlow RH (1998). „Is NADH effective in the treatment of Parkinson's disease?”. Drugs Aging 13 (4), 263–8. o. DOI:10.2165/00002512-199813040-00002. PMID 9805207.
- ↑ Timmins GS, Deretic V (2006). „Mechanisms of action of isoniazid”. Mol. Microbiol. 62 (5), 1220–7. o. DOI:10.1111/j.1365-2958.2006.05467.x. PMID 17074073.
- ↑ Rawat R, Whitty A, Tonge PJ (2003). „The isoniazid-NAD adduct is a slow, tight-binding inhibitor of InhA, the Mycobacterium tuberculosis enoyl reductase: Adduct affinity and drug resistance”. Proc. Natl. Acad. Sci. U.S.A. 100 (24), 13881–6. o. DOI:10.1073/pnas.2235848100. PMID 14623976. PMC 283515.
- ↑ Argyrou A, Vetting MW, Aladegbami B, Blanchard JS (2006). „Mycobacterium tuberculosis dihydrofolate reductase is a target for isoniazid”. Nat. Struct. Mol. Biol. 13 (5), 408–13. o. DOI:10.1038/nsmb1089. PMID 16648861.
- ↑ a b Pankiewicz KW, Patterson SE, Black PL, et al. (2004). „Cofactor mimics as selective inhibitors of NAD-dependent inosine monophosphate dehydrogenase (IMPDH)—the major therapeutic target”. Curr. Med. Chem. 11 (7), 887–900. o. DOI:10.2174/0929867043455648. PMID 15083807.
- ↑ Franchetti P, Grifantini M (1999). „Nucleoside and non-nucleoside IMP dehydrogenase inhibitors as antitumor and antiviral agents”. Curr. Med. Chem. 6 (7), 599–614. o. PMID 10390603.
- ↑ Kim EJ, Um SJ (2008). „SIRT1: roles in aging and cancer”. BMB Rep 41 (11), 751–6. o. DOI:10.5483/BMBRep.2008.41.11.751. PMID 19017485.
- ↑ Valenzano DR, Terzibasi E, Genade T, Cattaneo A, Domenici L, Cellerino A (2006). „Resveratrol prolongs lifespan and retards the onset of age-related markers in a short-lived vertebrate”. Curr. Biol. 16 (3), 296–300. o. DOI:10.1016/j.cub.2005.12.038. PMID 16461283.
- ↑ Howitz KT, Bitterman KJ, Cohen HY, et al. (2003). „Small molecule activators of sirtuins extend Saccharomyces cerevisiae lifespan”. Nature 425 (6954), 191–6. o. DOI:10.1038/nature01960. PMID 12939617.
- ↑ Wood JG, Rogina B, Lavu S, et al. (2004). „Sirtuin activators mimic caloric restriction and delay ageing in metazoans”. Nature 430 (7000), 686–9. o. DOI:10.1038/nature02789. PMID 15254550.
- ↑ Rizzi M, Schindelin H (2002). „Structural biology of enzymes involved in NAD and molybdenum cofactor biosynthesis”. Curr. Opin. Struct. Biol. 12 (6), 709–20. o. DOI:10.1016/S0959-440X(02)00385-8. PMID 12504674.
- ↑ Begley TP, Kinsland C, Mehl RA, Osterman A, Dorrestein P (2001). „The biosynthesis of nicotinamide adenine dinucleotides in bacteria”. Vitam. Horm. 61, 103–19. o. DOI:10.1016/S0083-6729(01)61003-3. PMID 11153263.
- ↑ Rongvaux A, Andris F, Van Gool F, Leo O (2003). „Reconstructing eukaryotic NAD metabolism”. BioEssays 25 (7), 683–90. o. DOI:10.1002/bies.10297. PMID 12815723.
- ↑ ENADA Stabilizált NADH 5 mg tabletta (Étrend-kiegészítő készítmény édesítőszerrel). www.hazipatika.com. (Hozzáférés: 2018. június 14.)
