Maltóz
| Maltóz | |||
 α-maltóz | |||
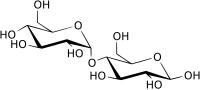 β-maltóz | |||
| Más nevek | α-
d-glükopiranozil-(1→4)-
d-glükóz | ||
| Kémiai azonosítók | |||
|---|---|---|---|
| CAS-szám | 69-79-4 | ||
| PubChem | 6255 | ||
| |||
| Kémiai és fizikai tulajdonságok | |||
| Kémiai képlet | C12H22O11 | ||
| Moláris tömeg | 342,296 g/mol | ||
| Megjelenés | fehér por vagy kristályok | ||
| Sűrűség | 1,54 g/cm³[1] | ||
| Olvadáspont | 160–165 °C (vízmentes) 102–103 °C (monohidrát) | ||
| Oldhatóság (vízben) | 1,080 g/ml (20 °C)[1] | ||
| Ha másként nem jelöljük, az adatok az anyag standardállapotára (100 kPa) és 25 °C-os hőmérsékletre vonatkoznak. | |||
A maltóz (más néven maltobióz vagy malátacukor) két glükózrészből álló diszacharid, benne a két glükózmolekula α(1→4) glikozidos kötéssel kapcsolódik egymáshoz. A kötést az egyik glükózegység 4-es és a másik glükózegység glikozidos hidroxilcsoportja alkotja. Egy harmadik glükózrész kapcsolódásával maltotrióz jön létre; további lánchosszabbodással dextrinek (maltodextrin) és végül keményítő jön létre. A természetben szabad állapotban olyan növényi részekben található meg, ahol a keményítő hidrolízise folyik,[2] például burgonyacsíra, gabonafélék csírája, levelek.
A maltóz hidrolízissel két glükózmolekulára bomlik. Az élő szervezetekben ezt a maltáz enzim végzi. Laboratóriumi körülmények között erős savval hevítve szintén hidrolízis megy végbe.
A gabonák – például árpa – csíráztatása során létrejövő maltóz fontos lépés a sörfőzés folyamatában.
A malátagyártás során az árpában az amiláz enzim koncentrációját maximalizálják. A fermentáció során a maltózt élesztőgombák etanollá és szén-dioxiddá metabolizálják.
Fehér színű, kristályos vegyület. Édes ízű. Redukáló diszacharid, mutarotál. Vízben nagyon jól oldódik.
Felfedezése
[szerkesztés]A maltózt az ír származású Cornelius O'Sullivan fedezte fel 1872-ben.[3] Nevét a maláta angol neve után (malt) kapta az „-óz” képzővel, mellyel a cukrok és más szénhidrátok nevét formáljuk.[4]
Tulajdonságok
[szerkesztés]- A maltóz – szabad aldehidcsoportja révén – redukálja a Fehling-reagenst, így az aldehidcsoport oxidációja miatt Fehling-próbája pozitív.
- A maltóz vizes oldatban – anomer szénatomja miatt – mutarotál, vagyis α és β izomerjei egymásba alakulhatnak. Oldatában egyensúly áll be az α és β forma között.
- Édes ízű.
- Lu és Sharkey 2006-ban arról számolt be, hogy a kloroplasztiszból éjszaka kikerülő fő szénvegyület a maltóz.[5]
Egyebek
[szerkesztés]A maltóz gyártása általában keményítő hidrolízisével történik. A keményítőt α(1→4) és α(1→6) kapcsolódású glükózegységek alkotják. A jelölés azt jelenti, hogy az 1-es számú szénatom a másik glükózmolekula 4-es vagy 6-os számú szénatomjához kapcsolódik glikozidos kötéssel. Az 1→4 kapcsolódású keményítő részt amilóznak nevezzük, ez egy egyenes polimer. Az 1→4 és 1→6 kapcsolódású rész az amilopektin, mely elágazó láncú polimer, az elágazási pontok az 1→6 kötésű egységek.
A hidrolízis ezen fajtáját az amiláz nevű enzim katalizálja.[6] Két csoportra osztjuk őket: α-amilázok és β-amilázok.
A β-amilázok megtalálhatóak növényekben, édes burgonyában, szójababban, árpában, búzában és a baktériumokban is. Ezek az amilázok β-maltózokat és β-limit dextrineket termelnek, mivel az enzim nem tudja hidrolizálni az elágazó α(1→6) kötéseket.[7]
Az emberben a maltózt a maltáz enzim bontja le, így a két glükózmolekula a glükóz bomlása során termel energiát a szervezetnek.
Az élelmiszeriparban édesítőszerként és adalékanyagként használják.[2]
Hivatkozások
[szerkesztés]- ↑ a b MSDS for maltose monohydrate. [2006. szeptember 12-i dátummal az eredetiből archiválva]. (Hozzáférés: 2008. január 10.)
- ↑ a b Peter M. Collins. Dictionary of Carbohydrates, 2nd edition, Boca Raton: Chapman & Hall/CRC, 693. o. (2006). ISBN 978-0-8493-3829-8
- ↑ [1]
- ↑ Oxford dictionaries: http://oxforddictionaries.com Archiválva 2013. december 4-i dátummal a Wayback Machine-ben
- ↑ The importance of maltose in transitory starch breakdown. (Hozzáférés: 2014. január 12.)
- ↑ Biochemistry. Regiland Garrett, Charles M. Grisham.
- ↑ Starch: Chemistry and Technology. James N. BeMiller, Roy L. Whistler.
