Zárt nukleinsav
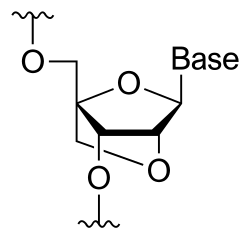
A zárt nukleinsav (LNS), más néven áthidalt nukleinsav (BNS)[1] vagy hozzáférhetetlen RNS módosult RNS, ahol a ribóz egy 2'-oxigént és 4'-szént összekapcsoló híddal módosult. Ez a ribózt 3'-endo (északi) konformációba zárja, mely gyakori az A-formájú duplexekben. Ez a szerkezet az enzimatikus bomlással szemben növeli a stabilitását.[2][3][4][5] Ez növeli a bázispárosodás specificitását és affinitását monomerként és oligonukleotid részeként is.[6] E nukleotidok egy oligonukleotidban keverhetők DNS- vagy RNS-nuleotidokkal.
Szintézis
[szerkesztés]Obika et al. állítottak elő LNS-t először 1997-ben,[7] ezt tőle függetlenül követte Wengel csoportja 1998-ban.[8] Ez azután lett lehetséges, hogy Zamecnick és Stephenson az oligonukleotidok génexpresszió-szabályzó képességét mutatták ki 1978-ban.[9] A lineáris és a konvergens módszerről kimutatták, hogy nagy mennyiségben és hatékonyan tud előállítani LNS-t. A lineáris szintézist először Obika et al. mutatták be.[7] E módszerben bármely könnyen elérhető ribonukleozid használható kiindulási anyagnak. A konvergens módszer cukor köztitermék szintézisét igényli, mely glikozildonorként működik, mely a nukleobázisokhoz való kapcsolódáshoz kell. Gyakran d-glükózt használnak a cukor előállításához, mely módosult Vorbrügen-reakcióban reagál a nukleobázisokkal, lehetővé téve a sztereoszelektív kapcsolódást.[10]
A különböző részek hozzáadása továbbra is lehetséges a fontos fizikokémiai tulajdonságok, például az eredeti LNS-re jellemző nagy affinitás és specificitás megőrzésével.[8] Ilyen oligomerek kémiailag állíthatók elő, és forgalmazzák.
Beágyazódás DNS-be/RNS-be
[szerkesztés]Az LNS bekerülhet DNS-be vagy RNS-be egyes DNS- és RNS-polimerázok jellemzőit felhasználva. A Phusion-DNS-polimeráz, egy Pfu DNS-polimerázon alapuló mesterséges enzim könnyen helyez DNS-be LNS-t.[11]
Jellemzők
[szerkesztés]Az LNS a biológiai nukleinsavaknál biostabilabb. Az LNS-módosított oligonukleotidok az RNS-sel, ssDNS-sel és dsDNS-sel való hibridizációban jobb termodinamikájúak.[11]
Alkalmazásai
[szerkesztés]LNSzimek
[szerkesztés]A dezoxiribozimek módosíthatók LNS-tartalmúvá, LNSzimeket (LNS-módosított DNSzimek) adva. Ezek a DNSzimekhez hasonlóa általában adott RNS-célszekvenciákat célzó, a nukleotidok közti foszfodiészter-kötést bontó endonukleázok.[12] Hatékonyabban bontják a foszfodiészter-kötést módosítatlan társaiknál.[13] A szubsztrátfelismerő karok módosítása LNS-monomerekkel a Coxsackie vírus A21-et (CAV-21) felismerő, annak a humán rinovírus 5'-nem transzlált régiójához (5' UTR) hasonló, a módosítatlan DNSzimek által fel nem ismert RNS-célszekvenciáját bontó DNSzimet ad.[14]
Terápia
[szerkesztés]Az LNS-alapú oligonukleotidok terápiás használata a biotechnológia új területe.[15] Számos LNS-oligonukleotidot vizsgáltak farmakokinetikai és toxicitási szempontból. Az LNS-toxicitás alapvetően független az oligonukleotid-szekvenciától, és a transzlálható terápiás alkalmazások bizonyultak biztonságosabbnak.[8]
Az LNS-t vizsgálták továbbá rák és fertőző betegségek kezelésében is. Egy antiszenz zártnukleinsav-foszforotioát, az SPC2996 a limfocitás leukémiasejtek (CLL) apoptózisát gátló Bcl-2 onkoprotein mRNS-ét célozza. Az I. és II. fázisú klinikai kísérletek a CLL-ek dózisfüggő csökkenését mutatták ki a vizsgált népesség körülbelül 30%-ában, és további kutatásokat javasoltak a vegyület működéséről.[16]
15 nukleotidos foszforotioát-szekvenciájú LNS-t használ a Miravirsen, a hepatitis C kísérleti kezelési módszere, mely és specifikusan a májsejtekben kódolt MiR-122 miRNS-hez kötődik.[17][18]
Észlelés és diagnózis
[szerkesztés]Az LNS-t használó allélspecifikus PCR lehetővé teszi rövidebb primerek használatát specificitáscsökkenés nélkül.[19]
LNS-t használ a fluoreszcencia-in situ hibridizáció (FISH).[20] A FISH grakori technika számos sejt örökítőanyagának megtekintésére, de ezt az alacsony teszthibridizációs hatékonyság korlátozza. Az LNS-tartalmú tesztek növelték a DNS és az RNS hibridizációs hatékonyságát. Az LNS-tartalmú FISH nagyobb hatékonysága lehetővé teszi humán kromoszómák, néhány nem humán sejt és mikrocsoportok FISH-elemzését.[20]
Az LNS-genotipizálás képes volt apolipoprotein B mutációját észlelni.[20]
A hibés párosodások megkülönböztetésének nagy affinitása miatt az LNS-t diagnosztikai eszközökben is alkalmazzák. Immobilizált LNS-tesztek használhatók multiplex SNP-genotipizálási assayben.[15]
Génszerkesztés
[szerkesztés]Az LNS-módosított ssODN-ek (szintetikus egyszálú DNS-oligonukleotidok) hagyományos ssODN-ként használhatók egybázisú génszerkesztéshez. Az LNS használata a módosítás helyén vagy ahhoz közel lehetővé teszi a DNS-javítás elkerülését a nagyobb hőstabilitás miatt.[21]
Jegyzetek
[szerkesztés]- ↑ (2002. augusztus 1.) „Implications of High-Affinity Hybridization by Locked Nucleic Acid Oligomers for Inhibition of Human Telomerase †” (angol nyelven). Biochemistry 41 (31), 9973–9981. o. DOI:10.1021/bi025907j. ISSN 0006-2960. PMID 12146961.
- ↑ Kurreck, J. (2002. május 1.). „Design of antisense oligonucleotides stabilized by locked nucleic acids”. Nucleic Acids Research 30 (9), 1911–1918. o. DOI:10.1093/nar/30.9.1911. PMID 11972327. PMC 113840.
- ↑ Frieden, M. (2003. november 1.). „Expanding the design horizon of antisense oligonucleotides with alpha-L-LNA” (angol nyelven). Nucleic Acids Research 31 (21), 6365–6372. o. DOI:10.1093/nar/gkg820. ISSN 1362-4962. PMID 14576324. PMC 275462.
- ↑ (2003. október 1.) „Nuclease Stability of LNA Oligonucleotides and LNA-DNA Chimeras” (angol nyelven). Nucleosides, Nucleotides and Nucleic Acids 22 (5–8), 1041–1043. o. DOI:10.1081/NCN-120022731. ISSN 1525-7770. PMID 14565339.
- ↑ (2001. november 1.) „2'-O, 4'-C-Ethylene-bridged nucleic acids (ENA) with nuclease-resistance and high affinity for RNA” (angol nyelven). Nucleic Acids Symposium Series 1 (1), 241–242. o. DOI:10.1093/nass/1.1.241. ISSN 0261-3166. PMID 12836354.
- ↑ Medicinal Chemistry of Nucleic Acids. John Wiley & Sons, Inc., 335–337. o. (2011). ISBN 978-0470596685
- ↑ a b (1997. december 15.) „Synthesis of 2′-O,4′-C-methyleneuridine and -cytidine. Novel bicyclic nucleosides having a fixed C3, -endo sugar puckering” (angol nyelven). Tetrahedron Letters 38 (50), 8735–8738. o. DOI:10.1016/S0040-4039(97)10322-7. ISSN 0040-4039.
- ↑ a b c Orum, Henrik (2008. március 31.). „Locked Nucleic Acid Holds Promise in the Treatment of Cancer” (angol nyelven). Current Pharmaceutical Design 14 (11), 1138–1142. o. DOI:10.2174/138161208784246234. PMID 18473860. (Hozzáférés: 2020. október 6.)
- ↑ (1978. január 1.) „Inhibition of Rous sarcoma virus replication and cell transformation by a specific oligodeoxynucleotide.” (angol nyelven). Proceedings of the National Academy of Sciences 75 (1), 280–284. o. DOI:10.1073/pnas.75.1.280. ISSN 0027-8424. PMID 75545. PMC 411230.
- ↑ (2001. december 1.) „A Simplified and Efficient Route to 2'-O, 4'-C-Methylene-Linked Bicyclic Ribonucleosides (Locked Nucleic Acid)”. The Journal of Organic Chemistry 66 (25), 8504–8512. o. DOI:10.1021/jo010732p. ISSN 0022-3263. PMID 11735531.
- ↑ a b (2007. március 26.) „Enzymatic Incorporation of LNA Nucleotides into DNA Strands” (angol nyelven). ChemBioChem 8 (5), 490–492. o. DOI:10.1002/cbic.200600501. PMID 17315250.
- ↑ (1994. december 1.) „A DNA enzyme that cleaves RNA”. Chemistry & Biology 1 (4), 223–229. o. DOI:10.1016/1074-5521(94)90014-0. ISSN 1074-5521. PMID 9383394.
- ↑ (2002. november 1.) „LNAzymes: Incorporation of LNA-Type Monomers into DNAzymes Markedly Increases RNA Cleavage” (angol nyelven). Journal of the American Chemical Society 124 (46), 13682–13683. o. DOI:10.1021/ja0276220. ISSN 0002-7863. PMID 12431091.
- ↑ (2004. május 1.) „Gaining Target Access for Deoxyribozymes” (angol nyelven). Journal of Molecular Biology 339 (2), 355–363. o. DOI:10.1016/j.jmb.2004.03.064. PMID 15136038.
- ↑ a b M. Petersen, J. Wengel (2003. február 1.). „LNA: a versatile tool for therapeutics and genomics”. Trends in Biotechnology 21 (2), 74–81. o. DOI:10.1016/S0167-7799(02)00038-0. PMID 12573856.
- ↑ (2011. április 1.) „The novel antisense Bcl-2 inhibitor SPC2996 causes rapid leukemic cell clearance and immune activation in chronic lymphocytic leukemia” (angol nyelven). Leukemia 25 (4), 638–647. o. DOI:10.1038/leu.2010.322. ISSN 1476-5551. PMID 21358717.
- ↑ Gebert, Luca F. R. (2014. január 1.). „Miravirsen (SPC3649) can inhibit the biogenesis of miR-122”. Nucleic Acids Research 42 (1), 609–621. o. DOI:10.1093/nar/gkt852. ISSN 0305-1048. PMID 24068553. PMC 3874169.
- ↑ Bonneau, E. (2019. június 24.). „How close are miRNAs from clinical practice? A perspective on the diagnostic and therapeutic market”. EJIFCC 30 (2), 114–127. o. ISSN 1650-3414. PMID 31263388. PMC 6599191.
- ↑ Bonetta L (2005). „Prime time for real-time PCR”. Nat. Methods 2 (4), 305–312. o. DOI:10.1038/nmeth0405-305.
- ↑ a b c Kubota, Kengo (2006. augusztus 1.). „Improved in situ hybridization efficiency with locked-nucleic-acid-incorporated DNA probes”. Applied and Environmental Microbiology 72 (8), 5311–5317. o. DOI:10.1128/AEM.03039-05. ISSN 0099-2240. PMID 16885281. PMC 1538721.
- ↑ van Ravesteyn, TW (2016. április 12.). „LNA modification of single-stranded DNA oligonucleotides allows subtle gene modification in mismatch-repair-proficient cells.”. Proceedings of the National Academy of Sciences of the United States of America 113 (15), 4122–7. o. DOI:10.1073/pnas.1513315113. PMID 26951689. PMC 4839440.
Fordítás
[szerkesztés]Ez a szócikk részben vagy egészben a Locked nucleic acid című angol Wikipédia-szócikk ezen változatának fordításán alapul. Az eredeti cikk szerkesztőit annak laptörténete sorolja fel. Ez a jelzés csupán a megfogalmazás eredetét és a szerzői jogokat jelzi, nem szolgál a cikkben szereplő információk forrásmegjelöléseként.
