Gombák
| Gombák | ||||||
|---|---|---|---|---|---|---|
| Evolúciós időszak: 1000–0 Ma | ||||||

| ||||||
| Rendszertani besorolás | ||||||
| ||||||
| Alországok és törzsek | ||||||
| Hivatkozások | ||||||
A Wikimédia Commons tartalmaz Gombák témájú médiaállományokat és Gombák témájú kategóriát. |
A gombák (Fungi) eukarióta sejtekből álló, egy- vagy többsejtű, általában telepes felépítésű, fotoszintetizáló pigmenteket nem tartalmazó, kitintartalmú sejtfallal rendelkező élőlények, melyek az élővilág egy önálló országát alkotják, mert a gombák a növényekkel ellentétben de az állatokhoz hasonlóan heterotrófok, azaz szénszükségletüket szerves anyagokból, energiaszükségletüket pedig kémiai anyagokból fedezik. A gombák többnyire a szárazföldi körülményekhez alkalmazkodtak. Táplálkozásuk szerint vagy szaprofiták (azaz korhadékokat, az elpusztult élőlények maradványait fogyasztják), vagy mikorrhizásak (gyökérkolonizálóak, azaz a gyökerükön keresztül szimbiózisban élnek egy gazdanövénnyel), vagy pedig az élő gazdaszervezetet lebontandó szerves anyagként hasznosító paraziták. Szaporodásuk rendszerint a széllel szállítódó spórákkal történik. Jelenleg[mikor?] kb. 148 000 fajukat ismerjük, de becslések szerint akár 2,2-3,8 millió eddig ismeretlen gombafaj is létezhet.[1]
A gombák kutatásával a mikológia foglalkozik.
A gombák világszerte, minden környezeti körülmények között megtalálhatóak. A szerves anyagok lebontása révén igen fontos szerepet játszanak az ökoszisztémákban és szén, valamint más elemek körforgásában.
Az emberek ősidők óta fogyasztják a gombákat, a mezőgazdaság elterjedése után pedig a tészták kelesztésénél, a sör és bor erjesztésénél is felhasználják őket. A 20. században az orvostudományt forradalmasító antibiotikumokat is először gombákból nyerték. A modern vegyipar és élelmiszeripar széleskörűen alkalmazza a gombák által termelt vegyületeket, enzimeket.
Sok gombafaj okozhat fertőző megbetegedéseket, mikózisokat. Ezen kívül a gombák mérgező vegyületeikkel is károsíthatják az állati (emberi) szervezetet vagy közvetlen fogyasztás, vagy a gabonafélék mikotoxinokkal való szennyezése, a tárolt élelmiszerek penészedése révén. Egyes fajok pszichoaktív anyagokat termelnek. A faanyagok, ruhaanyagok, élelmiszerek lebontásával jelentős gazdasági károkat okozhatnak.
Jellemzőik
[szerkesztés]

A biokémiai és molekuláris genetikai vizsgálatok térhódítása előtt a taxonómusok a növények országához (Plantae) sorolták a gombákat, alapvetően a hasonló, mozdulatlan életmódjuk és morfológiájuk miatt. A gombák a növényekhez hasonlóan főleg a talajban nőnek és termőtestjeik is hasonlíthatnak egyes növényekhez. Az új vizsgálati módszerek azonban olyan alapvető különbségeket tártak fel közöttük, hogy ma a gombákat különálló, az állatokéval és növényekével megegyező jelentőségű országba sorolják be, amely a többiektől mintegy egymilliárd évvel ezelőtt válhatott el.[2][3] Bizonyos jellemzőik az állatokkal vagy a növényekkel rokonítják őket, viszont vannak egyedi, csak rájuk jellemző tulajdonságaik is:
Rokon tulajdonságok:
- A többi eukariótához hasonlóan és a prokariótáktól eltérően sejtjeik membránnal határolt sejtmagokkal rendelkeznek, bennük kromoszómákkal, amelyeken a kódoló génszakaszok (exonok) nem kódoló intronokkal váltakoznak. Sejtszervecskéik (mint a mitokondriumok), szterolt tartalmazó membránjaik és 80S típusú riboszómáik is az eukariótákkal rokonítják őket.[4] Az állatokhoz hasonlóan olyan jellegzetes szénhidrátokat és tartalékanyagokat szintetizálnak, mint pl. a cukoralkoholok (mannitol), trehalóz, glikogén)[5]).
- Az állatokhoz hasonlóan nincsenek kloroplasztiszaik, és táplálékukat heterotróf módon szerzik be, vagyis szerves anyagok lebontásával.[6]
- A növényekkel rokonítja őket, hogy sejtjeiket sejtfal veszi körül[7] és vakuólumokat tartalmaznak.[8] Mind ivaros, mind ivartalan módon szaporodhatnak, és az alacsonyabb rendű növényekhez hasonlóan spórákat is képeznek. Akárcsak a mohák és egyes algák, a gombák egy részének életciklusában a haploid fázis dominál.[9]
- Az euglénákkal, és egyes baktériumokkal közös vonás az L-lizin aminosav szintézise (α-aminoadipát út).[10][11]
- Egyes növényekhez és állatokhoz hasonlóan mintegy 70 gombafaj lumineszkál.[12]

Egyedi jellemzőik:
- A legtöbb gomba egy sejt vastagságú, fonálszerű struktúrákat, ún. hifákat alkot, melyeket keresztfalak (szeptumok) tagolnak egyedi sejtekre. Ezek egy vagy több sejtmagot tartalmazhatnak. A hasonló szerkezetű algáktól eltérően a hifák nem teljesen soksejtűek, mert a szeptumok pórusain át sejtszervecskék, sőt akár sejtmagok is átvándorolhatnak egyik szakaszból a másikba. Szintén eltérés az algákhoz képest, hogy a hifa nem egész hosszában, a sejtek osztódásával, hanem csak a csúcsán növekszik. A csúcs növekedését az ún. csúcsi test (a szakirodalomban elterjedt német kifejezéssel Spitzenkörper), egy – fehérjéket, lipideket, egyéb szerves molekulákat tartalmazó – vezikulumaggregátum biztosítja.[13] Léteznek egysejtű, hifát nem alkotó gombák (élesztőgombák), amelyek bimbózással vagy hasadással szaporodnak; valamint olyanok is, amelyeknek a környezeti hatásoktól függően egyaránt van egysejtű és hifás alakja.[14]
- A gombák sejtfala glükánokból és kitinből áll. Bár a glükánok a növényekben, a kitin pedig a rovarok páncéljában is előfordul,[15][16] egyedül a gombáknál található meg mindkettő. A valódi gombák sejtfala nem tartalmaz cellulózt, de egyes, hagyományosan a gombákhoz sorolt, azóta áthelyezett fajok (mint pl. a petespórás gombák) cellulózos sejtfalat építenek.[17]
- A gombáknak nincsenek specializálódott szöveteik, mint pl. a növényeknél a víz és a tápanyagok szállítását végző xilém és floém. Álszöveteik lehetnek (amely növekedése nem speciális sejtek, hanem minden hifa hosszabbodása által történik), és egyes gombák, mint pl. a gyűrűs tuskógomba a gyökerek funkcióit ellátó micéliumzsinórokat, rizomorfokat fejlesztenek. Biokémiai szempontból a többi eukariótához hasonlóan a gombák is állítanak elő terpéneket (mint a mevalonsav),[18] de azokat a terpéneket, amelyeket a növények a kloroplasztiszaikban termelnek, értelemszerűen nem tartalmazzák.[19] A gombák és növények által is előállított anyagok szintézisében részt vevő enzimek egy része szerkezetében jelentősen különbözik, ami arra utal, hogy a két csoportbon külön, konvergens evolúció által jöttek létre.[18][20]
Elterjedésük
[szerkesztés]
A gombák az egész világon megtalálhatóak. Nagyon különböző életkörülményekhez alkalmazkodtak, elviselik a sivatagok szárazságát, a magas sókoncentrációt,[21] a radioaktív sugárzást,[22] vagy a mélytengeri környezetet.[23] Egyes fajaik túlélik az űrbeli erős ultraibolya, valamint kozmikus sugárzásokat.[24] Többségük a szárazföldön él, de vannak részlegesen vagy teljesen vízi gombák is, mint pl. a Batrachochytrium dendrobatidis és B. salamandrivorans paraziták, amelyek világszerte hatalmas pusztítást végeznek a kétéltűek között. Ezek a fajok életciklusuk egy részét mozgékony zoospóra formájában töltik, így találják meg a vízben gazdaszervezeteiket.[25] Más vízi gombafajok az óceánfenék forró vizű forrásainál élnek.[26]
2020-ig a taxonómusok mintegy 148 ezer gombafajt írtak le,[27] de tényleges számuk jóval nagyobb, egyes becslések szerint 2,2-3,8 millió közötti lehet, vagyis kevesebb mint 10%-ukat ismerjük.[28] A 2010-es években évente 1000–2500 új fajt fedeztek fel, 2019-ben pl. 1882-t. A fajok elkülönítését hagyományosan morfológiai tulajdonságaik (pl. a spórák, termőtestek mérete, alakja) alapján végezték.[29] Később biokémiai tulajdonságaikat (mint egyes szerves anyagok bontása vagy reakciójuk vegyi anyagokra) is figyelembe vették, újabban pedig a taxonómia főleg a molekuláris biológiai módszereken (DNS-szekvenálás, filogenetikai analízis) alapszik.[30]
A gombák kutatásának története
[szerkesztés]
A gombákat a biológia egyik ága, a mikológia (a görög mükész (μύκης - gomba) és logosz (λόγος - diskurzus, ok, ige) kifejezésekből) tanulmányozza, beleértve morfológiájukat, genetikájukat, biokémiájukat, rendszerezésüket, gyakorlati felhasználásukat (a gombáknak nagy szerepe van az élelmiszeriparban, a gyógyszeriparban, sőt egyes vallásokban vagy szubkultúrákban is) és veszélyeiket (sok gomba mérgező, mások pedig az emberek, állatok, növények parazitáiként betegségeket okozhatnak).
Az emberek már a történelem előtti időkben is felhasználták a gombákat. Az Alpokban talált 5300 éves, Ötzinek elnevezett múmia holmijai között kétféle taplót is találtak, amelyeket tűzgyújtásra (a bükkfataplót) és esetleg fájdalomcsillapításra (a nyírfataplót) használhatott.[31] A mezőgazdasági népek az ősidőktől fogva használták a gombákat - bár nem tudtak róla - amikor kelesztett kenyeret vagy sört, bort készítettek. Egyes régi feljegyzések olyan növénybetegségeket írnak le, amiket feltehetően patogén gombák okoztak.[32]
A mikológia, mint tudományág viszonylag újkeletű, csak a mikroszkóp 17. századi feltalálása után indult fejlődésnek. Bár Giambattista della Porta már 1588-ban megfigyelte a gombaspórákat, a mikológia születésének Pier Antonio Micheli Nova plantarum genera művének 1729-es kiadását tekintik.[33] Micheli megfigyelte, hogy a spórákból megfelelő körülmények között ugyanolyan gombafaj nő ki, mint amelyikről az származik.[34] Carl von Linné rendszertanának 1753-as megjelenése után a gombákat a holland Christiaan Hendrik Persoon (1761–1836) osztályozta; alapos munkája miatt őt tartják a modern mikológia egyik megteremtőjének. Ezt követően a svéd Elias Magnus Fries (1794–1878) dolgozta át a taxonómiát, bevezetve az elkülönítő jegyek közé a spórák színét és mikroszkópos jellemzőit.
A 20. és 21. században a biokémia, a genetika, a molekuláris biológia fejlődése nyitott újabb távlatokat a hagyományosan a morfológiára alapozott gombarendszertan és -evolúció terén.[35]
Felépítésük
[szerkesztés]Mikroszkopikus jellemzők
[szerkesztés]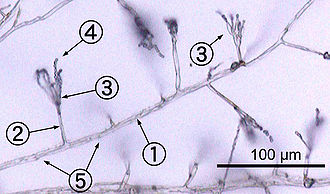
A gombák többsége hifákat, 2-10 µm vastag, hengeres keresztmetszetű, szálszerű struktúrákat alkot, amelyek hossza több centiméteres is lehet. A hifák a csúcsuknál növekednek. Új hifák vagy a meglevőből ágaznak el oldalirányban, de a hifacsúcs villás kettéágazása is előfordulhat.[36] Ha a csúcs egy másik hifába ütközik, akkor fuzionálhatnak (ún. anasztomózis). Mindennek eredményeképpen hifák hálózatos szövedéke, micélium jön létre.[14] A sok sejtmagvú hifák lehetnek összeolvadt citoplazmájúak (cönocitikusak, ilyenkor gyakorlatilag egyetlen sokmagvú sejtet alkotnak), de gyakoribb, hogy keresztfalakkal (szeptumokkal) szakaszokra oszlanak. A szakaszok egy vagy több sejtmagot tartalmazhatnak.[37] A szeptumokon egyszerű (tömlősgombák) vagy bonyolultabb, ún. dolipórus (bazídiumos gombák) biztosítja az átjárást a szakaszok között. A pórusokon citoplazma, sejtorganellumok, sőt sejtmagok is áthatolnak.[38]
Egyes fajok specializált hifákat fejlesztettek ki, amellyel az élő gazdaszervezetből tudják felvenni a tápanyagokat. Ilyen a növényparazita gombák hausztóriuma, vagy a mikorrhizás gombák arbuszkulái, amelyek behatolnak a gazdanövény sejtjeibe is.[39]
A gombák az állatokhoz hasonlóan elvben opisztokont szervezetek (vagyis mozgásképes sejtjeik egyetlen hátsó ostorral hajtják meg magukat), de a rajzóspórás gombák kivételével valamennyien elvesztették hátsó ostorukat.[40]
Makroszkopikus jellemzők
[szerkesztés]
A jól fejlett micélium szabad szemmel is látható, például a romlott ételen és nedves falakon megjelenő penészé. A laboratóriumi táptalajon növesztett gombakolóniák alakja vagy színe diagnosztikus jelentőségű lehet.[41] Egyes gombakolóniák meglepő méretet és kort érhetnek el, mint például az az észak-amerikai sötétpikkelyes tuskógomba-telep, amely több mint 900 hektárra terjed ki és korát 1900 és 8650 év közöttire becslik.[42]
A tömlősgombák és a bazídiumos gombák viszonylag nagy spóratermő termőtestet fejlesztenek, amelynek alakja és színe igen változatos: a köznyelvben ezeket nevezik gombának.
Élettan
[szerkesztés]
A vékony, hosszú hifák igen hatékonyak a szilárd közegben való előrehaladásban, vagy az élő szövetbe való behatolásban.[43] Szükség esetén igen nagy nyomóerőt képesek kifejteni: sok növénypatogén, köztük a járványos rizsbarnulás kórokozója, a Magnaporthe grisea úgynevezett apresszóriumot növeszt, amely a növényi sejtek kiszúrására specializálódott.[44] Az apresszórium növényi epidermiszre gyakorolt nyomása elérheti akár a 8 megapascalt (1,200 psi) is.[44] A Paecilomyces lilacinus hasonló szerkezetével a fonalférgek petéibe hatol be.[45] Az apresszóriumok a sejten belüli ozmotikus nyomás (turgor) növelésével fejtik ki hatásukat.[46]
A gombák alapvetően heterotróf szervezetek, vagyis a működésükhöz szükséges energiát a más élőlények által készített szerves anyagok bontásával szerzik meg. Evolúciójuk során megtanulták számos szerves anyag felhasználását növekedésükhöz (akár az etanolt vagy ecetsavat is), de szervetlen anyagok (nitrát vagy ammónia) is energiaforrásul szolgálhatnak.[47][48] Kuriózumként néhány faj melaninjával képes felfogni az ionizáló sugárzás (pl. gamma-sugárzás) energiáját, de a folyamat hatékonysága igen alacsony és biofizikai/biokémiai háttere sem ismert teljesen.[22]
Táplálkozásuk kilotróf, vagyis a sejtmembránjukon át szívják fel azokat a tápanyagokat, amelyeket az általuk a környezetbe szekretált szénhidrát-, fehérje- és lipidbontó enzimekkel hidrolizáltak.[49][50][51] A hifás gombák döntő többsége a hifák végének nyúlásával növekszik,[52] azonban egyes endoszimbionta/parazita fajnál a hifa interkaláris (csúcs alatti) megnyúlása is megfigyelhető.[53] Nagyobb termőtestek fejlődésekor a hifák vastagodhatnak is.[54]
Szaporodás
[szerkesztés]
A gombák életciklusa a növényekéhez hasonlóan egy sporobiont (ivartalan spórákat képző) és egy gametobiont (ivarsejteket képző) szakaszra oszlik, de az egyes szakaszok jelentősége, hossza széles határok között változik. Az ivaros termőtestet teleomorfának, a spórákat termő ivartalan termőtestet anamorfának nevezik; ezek mérete, alakja, környezeti igénye jelentősen különbözhet egy fajon belül is. A gombák a környezettől függően válthatnak át ivaros szaporodásról ivartalanra, vagy fordítva. Számos esetben (hagyományosan őket nevezték "tökéletlen gombáknak", fungi imperfecti-nek, de ez a taxonómiai kategória ma már túlhaladott) csak a faj ivartalan formája ismert.
Ivartalan szaporodás
[szerkesztés]Az ivartalan szaporodás vegetatív spórák (konídiumok) vagy a micélium töredezése által történhet. Az utóbbi esetben a micélium darabokra válik szét és valamennyiből különálló micélium fejlődik ki. Az ivartalan szaporodás során az anyaszervezet genetikai klónjai jönnek létre, ami előnyös lehet, ha az jól alkalmazkodott környezetéhez és gyors terjedést tesz lehetővé.[55]
Ivaros szaporodás
[szerkesztés]
Az endomikorrhizás gombák kivételével a gombák minden rendszertani csoportjában megfigyelhető az ivaros szaporodás (és vannak genetikai bizonyítékok az endomikorrhizások esetében is),[56] de menete sok szempontból különbözik a növények és állatok szaporodásától. A gombák csoportjai között is jelentős eltérések lehetnek a reprodukciós stratégiákat illetően.[57][58] A spóra- és gamétatermő struktúrák (pl. aszkuszok, bazídiumok) alakja, működése igen fontos elkülönítő bélyeg a gombák rendszertanában. A hagyományos nemek mellett ún. párosodási típusaik is vannak: a homotallikus gombák bármilyen párosodási típussal, a heterotallikusak csak másfélékkel képesek fuzionálni. A nemektől eltérően párosodási típusból kettőnél több is lehet.[59] Feltehetően a homotallizmus volt a szaporodás ősibb formája, a párosodási típusok az önmegtermékenyítés elkerülésére fejlődtek ki.[60] Ha azonban az egyik párosodási típus kihal vagy izolálódik, a faj elvesztheti a szexuális szaporodás lehetőségét, lehetséges hogy ez történt egyes "tökéletlen gombákkal".
A legtöbb gomba életciklusában elkülöníthető egy haploid és diploid stádium. A tömlősgombák és bazídiumos gombák esetében egy sajátos átmeneti állapot figyelhető meg. A gaméták egyesülése után a sejtmagok nem olvadnak össze, hanem az életciklus nagy részében különállóak maradnak, kétsejtmagvas (dikariotikus) hifákat fejlesztve. A sejtmagvak csak a spóratermő struktúrákban egyesülnek.[61]
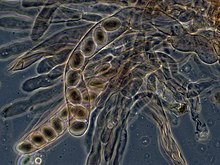
A tömlősgombáknál a termőréteg (himenium) dikariotikus hifáinak válaszfalai (szeptumai) sajátságos kinövést, kampót fejlesztenek, ezek választják szét a sejtosztódos során a szintén osztódó sejtmagokat. A sejtmagok a spóratermő tömlő (aszkusz) kialakulása után fuzionálnak, majd rögtön ezután meiózissal kialakulnak a haploid aszkospórák. A spórák szétszóródnak és haploid micéliummá fejlődnek.[62]
A bazídiumos gombák ivaros szaporodása hasonlóképpen zajlik. Az egymással kompatibilis haploid hifák egymással fuzionálva dikariotikus micéliumot fejlesztenek. A tömlősgombákhoz hasonlóan a szeptumnál egy dudor, az ún. "csat" végzi a sejtmagok szortírozását, hogy mindkét leánysejtbe két-két különböző sejtmag jusson.[63] Ennél a csoportnál bazídiumok a spóraképző szervek, amelyekben a sejtmagok fúziója és a meiózis után bazidiosórák jönnek létre.[64]
A járomspórás gombák esetében két ellentétes ivarjellegű hifa bunkószerűen egymás fele növő progametangiumot képez, melyekről lefűződnek a gametangiumok (ivarszervek). A gametangiumok összeolvadnak (plazmogámia), létrehozva a vastag falú, áttelelő zigospórát (zigóta). Itt történik a sejtmagok összeolvadása (kariogámia), melyet közvetlenül a meiózis követ. Ekkor a zigospóra kicsírázik, sporangiumot hozva létre és ebből szabadulnak ki a spórák.
Néhány gombafaj, mint a Penicillium és a Aspergillus nemek tagjai meiózis nélkül, paraszexuális úton is cserélhetnek genetikai információt, hifáik összekapcsolódásával.[65] Ezzel a módszerrel fajok közti hibridek is létrejöhetnek.[66]
A spórák szétszórása
[szerkesztés]
A spórák általában a széllel terjednek.[67][68] Számos fajban kialakultak olyan struktúrák, amelyek segítik a spórák szétszórását. Ezek nagy erővel repíthetik szét a spórákat vagy elősegíthetik, hogy a szél nagyobb távolságra repítse őket (pl. hidrofób, átnedvesedést meggátoló külső réteggel).[69]
Egyes tömlősgomba-fajok az ozmotikus nyomást növelő anyagokat halmoznak fel a sejtjeikben, amelyek segítségével robbanásszerűen tudják szétszórni spóráikat.[70] Az ún. ballisztispórák alatt egy cukrokban gazdag folyadékcsepp (Buller-csepp) gyűlik, ennek felületi feszültségének, illetve annak megszüntetésével a spóra nagy erővel, akár 10 ezer G-s gyorsulással lövell ki;[71] és 0,01–0,02 cm-re repülve kiszabadul a termőtest lemezeiből vagy pórusaiból.[72] Megint más módszert használnak a pöfetegek, vagy a tüskés termőrétegű gerebenek; utóbbiaknál a spórák lefelé lógnak a tüske- vagy fogszerű kiemelkedéseken, így könnyen leesnek.[73] A pohárgombák spórái az esőcseppek mechanikus erejét kihasználva fröccsennek szét a pohárszerű termőtestekből.[74] A rovarok általi terjesztésre is van példa; a szömörcsögök kellemetlen szagukkal vonzzák magukhoz a legyeket, spóráik pedig azok lábára tapadnak.[75]
Evolúció
[szerkesztés]
Az állatoktól és növényektől eltérően a gombák csak ritkán fosszilizálódnak, mert termőtesteik többnyire puhák és hamar lebomlanak, hifáik pedig mikroszkopikus méretűek, és nehéz megkülönböztetni őket a többi mikroorganizmus fosszíliáitól; ez többnyire csak akkor sikerül ha hasonlítanak a ma is élő fajokra.[76] A gombákra utaló mikrofosszíliák általában állatok vagy növények kövületeiből kerülnek elő és vékonyrétegű preparátumokból tanulmányozhatók optikai vagy transzmissziós elektronmikroszkóp segítségével.[77]
A legkorábbi gombaszerű élőlények maradványai 2,4 milliárd éves üledékes kőzetekből kerültek elő; ezek már soksejtű, fonalszerű struktúrákat alkottak és képesek voltak egymással anasztomózissal összekapcsolódni.[78] Más, a rokon taxonómiai csoportok evolúcióján alapuló becslések szerint a gombák 760-1060 millió évesek lehetnek.[79] A paleozoikum (542-251 millió évvel ezelőtt) során a gombák vízben éltek, leginkább a mai rajzóspórás gombákra hasonlítottak, spóráik pedig ostorral mozogtak a vizes közegben.[80] Amikor áttértek a szárazföldi életmódra, számos táplálékszerző stratégiáit fejlesztettek ki, a szerves anyagok lebontásától a parazitizmuson keresztül a szimbiózisig (mint a növények gyökeréhez kapcsolódó mikorrhiza vagy a zuzmók létrejötte).[81] Az újabb genetikai vizsgálatok szerint a zuzmók (gomba-alga szimbiózis) több alkalommal, egymástól függetlenül kialakultak az evolúció során.[82]
A korai gombafosszíliák ritkák és nem is mindig azonosíthatók biztosan. A legősibb szárazföldi gombaszerű kövület a kanadai sarkvidéken talált Ourasphaira giraldae, amely akár egymilliárd évvel ezelőtt kiléphetett a szárazföldre, jóval a növények előtt.[83][84][85] Dél-Kínában ediacarai jellegű, 625 millió éves üledékes kőzetben gombaszerű mikrofosszíliákat találtak.[86] Ordovíciumi (460 millió éves) kőzetekből a mai Glomerales rendbeli fajokra hasonlító megkövült hifákat és spórákat tártak fel; ebben a korban a szárazföldi növények még csak mohaszerű szervezetekkel képviseltették magukat.[87] A szilur és korai devon korszak legmagasabb lénye a 8 méter magas és 1 méter vastag, fatörzsszerű Prototaxites volt, amely valószínűleg a gombákhoz vagy a zuzmókhoz tartozott. A korai devon (416–359 millió éve) után a gombafosszíliák már viszonlyag gyakoribbak és jobban azonosíthatókká válnak, többnyire a járomspórás és rajzóspórás gombák közül kerülnek ki.[88][89][90] Nagyjából ekkoriban, 400 millió éve alakultak ki a tömlősgombák és és a bazídiumos gombák.[91] A karbon végére (318-299 millió éve) valamennyi mai gombaosztály létrejött.[92]
A zuzmók már a legkorábbi szárazföldi ökoszisztémákban jelentős szerepet játszottak. A legrégibb zuzmófosszília 415 millió éves, ez nagyjából megfelel a tömlős- és bazídiumos gombák korának.[93] A legkorábbi kövület, amely bazídiumos gombának feleltethető meg, a felső karbonból származik.[94] Borostyánba zárt maradványai alapján a gombák legkésőbb a késő kréta (90 millió éve) óta fejlesztenek kalapos termőtestet.[95][96]
Közvetlenül a 250 millió éve történt perm-triász közti kihalási esemény után a növényi jellegű fosszíliák szinte 100%-át spórák teszik ki, vagyis a gombák (és talán az algák is, mert spóráik között nehéz különbséget tenni) abban az időben nagyon elszaporodhattak;[97] bár a jelenség nem figyelhető meg egyformán az egész világon.[98][99] Hasonlóképpen, 65 millió évvel ezelőtti, a dinoszauruszokat kiirtó krétavégi kihalás után szintén rendkívüli módon megnőtt a spórakövületek száma, mintha a növények helyét ideiglenesen (és részben) a gombák vették volna át, amelyek bőséges táplálékot találtak az elpusztult növények és állatok maradványain.[100]
Rendszerezés
[szerkesztés]Bár a gombákat hagyományosan a botanikakönyvek taglalják, valójában az állatokhoz állnak közelebb, ketten alkotják az Opisthokonta rendszertani csoportot, amelyet az ivarsejtek hátul elhelyezedő, magányos ostora jellemez.[101] A gombák rendszertana az új molekuláris genetikai információk fényében folyamatos változáson megy keresztül és az utóbbi évtizedekben teljesen felforgatták a hagyományos, morfológián alapuló taxonómiát.[102] A gyakori változások mellett tovább bonyolítja a taxonómiát, hogy sok faj esetében az anamorf (ivartalan) és teleomorf (ivaros) formát más-más néven írták le. Az alapelv, hogy ilyen esetekben a telemorf nevet tartják meg, de gyakran előfordul, hogy az anamorf alak neve már elfogadottá vált pl. az élelmiszer- vagy gyógyszeriparban és az ottani szakemberek vonakodnak elfogadni a névcserét.
A gombák országának 2007-es osztályozása több tucat taxonómus és egyéb szakértő országokon átívelő együttműködésének eredményeképpen jött létre.[30] Eszerint hét elfogadott törzs létezik, amelyek közül kettő, a tömlősgombák és bazídiumos gombák (amelyek együttesen alkotják a Dikarya alországot) képviseli a fajok többségét. Ide tartozik a legtöbb ismert gomba, amelyek között van élelemként fogyasztott vagy általuk készítjük a kenyeret, a bort és a sört; de ide tartoznak a legismertebb parazita kórokozók vagy az élelem, faanyag romlását okozó penészek, farontó gombák is. Az alábbi ábra megmutatja a magasabb szintű gombataxonok rokonsági viszonyait:[103][104][105]
| Zoosporia |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Basidiomycota |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ascomycota |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
A gombák törzsei
[szerkesztés]
A molekuláris genetikai analízis kimutatta, hogy a Microsporidia csoport, amelybe állatok és protiszták egysejtű parazitái tartoznak, a valódi gombákhoz áll közel.[106] A csoport törzsi szintre való emelése elfogadottá vált,[30] a kisspórások a Rozellida kláddal együtt a Rozellomyceta csoportot alkotják. A valódi gombák legközelebbi rokonai az Aphelida, együtt a Phytophagea csoportot alkotják.[107][108][109]
A rajzóspórás gombák (Chytridiomycota) világszerte elterjedt organizmusok. Közeli rokonaikkal, a Neocallimastigomycota és Blastocladiomycota kládokkal együtt azon gombák csoportját alkotják, amelyek képesek a mozgásra: zoospórájuk a vízben ostorral hajtja magát előre. Emiatt egy időben a protisták közé sorolták őket. A genetikai vizsgálatok alapján úgy vélik, hogy igen korán elválhattak a többi gombától, és hogy nagyobb kládjaik parafiletikus vagy akár polifiletikus eredetűek.[110]
A talajpenészek (Blastocladiomycota) korábban a rajzóspórás gombák egyik rendje voltak. Az újabb molekuláris biológiai és ultrastrukturális adatok alapján azonban inkább a Zygomycota, Glomeromycota és Dikarya (tömlős- és bazídiumos gombák) csoportokkal rokonítják őket. A talajpenészek szerves anyagok lebontásából élnek vagy paraziták (növényeken, férgeken, ízeltlábúakon egyaránt élősködhetnek).
A kis Neocallimastigomycota csoportot is korábban a rajzóspórás gombákhoz sorolták, de újabban törzsi rangra emelkedtek. Tagjai anaerob szervezetek, amelyek többnyire növényevő emlősök emésztőrendszerében élnek, de előfordulhatnak más, cellulózban gazdag szárazföldi vagy vízi élőhelyen is (pl. hulladékfeldolgozó telepeken).[111] Mitokondriumuk nincs, helyette mitokondriális eredetű, ún. hidrogenoszómákkal rendelkeznek. A rajzóspórás gombákhoz hasonlóan zoospóráik mozgásképesek.[30]


Az endomikorrhiza-gombák (Glomeromycota) törzsének sajátossága, hogy tagjai arbuszkuláris (sejten belüli) mikorrhizát képeznek a növények gyökereivel. Hifáik behatolnak a gyökérsejtekbe és a kapcsolat minkét fél számára előnyös szimbiózist eredményez (a növény vízhez és ásványi anyagokhoz, a gomba szerves anyagokhoz jut). Az ismert fajok mindegyike vegetatívan szaporodik.[56] A szimbiotikus kapcsolat igen ősi, legalább 400 millió éve kialakult már.[112] A csoportot eredetileg a járomspórás gombákhoz sorolták, de 2001-ben azt a törzset szétbontották: egy részük a törzsi rangra emelt Glomeromycotákhoz került, a többiek (Mucoromycotina, Kickxellomycotina, Zoopagomycotina, Entomophthoromycotina) bizonytalan helyzetűek.[30] A járomspórás gombák jól ismert képviselője az indáspenész (Rhizopus stolonifer) vagy a Pilobolus (trágyagomba) nemzetség, amelyek több méterre képesek repíteni spóráikat; de ilyenek az ember megbetegedéseit is okozó Mucor, Rhizomucor és Rhizopus nemzetségek is.[113]
A tömlősgombák (Ascomycota) a valódi gombák fajokban leggazdagabb csoportja.[29] Jellegzetességük, hogy spóráik ún. tömlőben (aszkuszban) fejlődnek. Hozzájuk tartoznak a kucsmagombák, a csészegombák, a szarvasgombák, valamint az egysejtű élesztőgombák (köztük a sörélesztő Saccharomyces és a parazita Candida), ezen kívül olyan mikroszkopikus, micéliumot fejlesztő gombák, amelyek egyaránt követhetik a szaprobionta, parazita vagy szimbióta (zuzmók) életmódot. Ezen fonalas tömlősgombák ismert képviselői az Aspergillus és a Penicillium penészek vagy a Fusarium és Claviceps növénypatogén paraziták. Sok tömlősgombának csak anamorf (ivartalanul szaporodó) alakja ismert, bár néhány esetben DNS-analízissel sikerült megtalálni telemorf formájukat is.[114] A Neurospora crassa faj a genetika fontos modellszervezete.[115]
A bazídiumos gombák (Basidiomycota) közös jellemzője, hogy spóráikat bunkós nyeleken, bazídiumokon fejlesztik. A köznyelvi értelemben vett, kalapos termőtestet növesztő gombák döntő többsége ide tartozik. Rajtuk kívül bazídiumos gombák még az olyan növénypatogének is, mint a gabonarozsda vagy a kukoricaüszög.[116] A Malassezia és a Cryptococcus nemzetségek tagjai opportunista fertőzések kórokozói lehetnek.[117][118]
Gombaszerű organizmusok
[szerkesztés]
Korábban hasonló morfológiájuk és életmódjuk miatt a gombákhoz sorolták a nyálkagombákat és a petespórás gombákat is. DNS-szekvenciájuk alapján ezeknek a csoportoknak a besorolása alapvető változásokon ment keresztül. A polifiletikusnak bizonyuló nyálkagombák - köztük a valódi nyálkagombák (Myxomycota), az élősdi nyálkagombák (Plasmodiophoromycota), sejtes nyálkagombák (Acrasiomycota), Dictyosteliomycota és Hyphochytridiomycota - az állati amőbákhoz (Amoebozoa); a petespórás gombák (Oomycota) pedig a növényi Chromista csoporthoz (együtt pl. a sárgamoszatokkal és kovamoszatokkal) kerültek át, csakúgy mint a régen a nyálkagombákhoz besorolt labirintusgombák (Labyrinthulomycetes). Ennek ellenére, sok esetben még ma is a mikológiai tankönyvek és szakfolyóiratok tárgyalják őket.[119]
Míg a valódi gombák sejtfala kitint tartalmaz, a petespórás gombáké cellulózt; a hyphochitrid gombák pedig kitint és cellulózt is. A nyálkagombáknak asszimilatív életfázisukban nincs sejtfaluk, táplálékukat pedig fagocitózissal szerzik, szemben azt a sejten kívül megemésztő és abszorbeáló valódi gombákkal, petespórás gombákkal, labirintusgombákkal és hyphochitridákkal.
Az Eccrinales és Amoebidiales csoportokat korábban a járomspórás gombákhoz osztályozták, most azonban a bizonytalan helyzetű Mesomycetozoea klád részei az Opistokontha csoporton (ez egyesíti az állatokat és a valódi gombákat is) belül. Szintén az opistokonthákhoz sorolták a korábban labrintusgombának gondolt Corallochytrium egysejtűt, amely nem sokkal az állatok és a gombák szétválása után ágazott el. A régen az élesztőkhöz tartozó Blastocystis nemzetség ma a heterokontákhoz tartozik.
Az egykor a rajzóspórás gombákhoz osztályozott, kitines sejtfallal nem rendelkező Rozella nemzetség ma a bizonytalan Rozellida klád része, még nem dőlt el hogy valódi gomba-e vagy azok testvérkládja.[120]
A megtévesztő nevű sugárgombákat (Actinomycetales) régen gombáknak gondolták, de valójában baktériumok.[121][122] A régi (több mint száz éves) rendszertanok egy része magukat a baktériumokat is „hasadógomba” (Schizomycetes) név alatt a gombákhoz sorolta.
Ökológiai szerepük
[szerkesztés]
Bár nem mindig feltűnőek, a gombák a Föld valamennyi ökoszisztémájában alapvető szerepet játszanak. A baktériumokkal együtt a legfontosabb lebontó, szaprotróf szervezetek közé tartoznak, így lehetővé teszik a szén (és más elemek) biogeokémiai körforgását.[123] A növények által termelt szerves anyagokat szervetlenekké bontják le és így lehetővé teszik azok újrafelhasználását.[124][125] Ezenkívül táplálékul is szolgálnak a növény- és gombaevő állatoknak.
Szimbiózis
[szerkesztés]Számos gomba szimbiotikus kapcsolatot létesít más fajokkal, amelyek lehetnek algák, baktériumok, magasabbrendű növények, sőt rovarok is.[126][127][128] A kapcsolat lehet mutualisztikus, vagyis kölcsönösen előnyös, de egyes esetekben a gazdaszervezet látszólag nem húz előnyt a kapcsolatból.[129][130][131]
Növényekkel
[szerkesztés]A legismertebb és leggyakoribb gomba-növény szimbiotikus kapcsolat a mikorrhiza, amikor a gombamicélium összekapcsolódik a növények hajszálgyökereivel. A növényfajok több mint 90%-a létesít mikorrhizát a gombákkal; sokuk (mint pl. egyes orchideák) túlélése függ ennek sikerétől.[132]
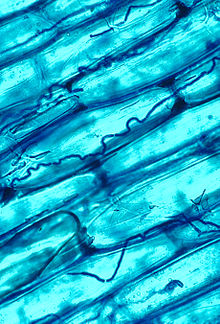
A mikorrhiza nagyon régen megjelent, legkorábbi bizonyítékai 400 millió évesek.[112] Általa a növények jelentősen megnövelhetik a szervetlen anyagok felvételét, mint pl. a létfontosságú, de alacsony koncdentrációjú nitrátokét és foszfátokét.[124][133] A gombapartner szerves anyagokhoz (cukrokhoz) jut a kapcsolat révén. Mivel a micélium egyszerre több növény gyökérzetéhez is kapcsolódhat, lehetővé válik a szerves anyagok egyik növényből a másikba való átjutása, ún. mikorrhizás hálózatot hozva létre; a fotoszintézisre képtelen növények így is juthatnak tápanyagokhoz.[134][135][136] A kapcsolat odáig fajulhat, hogy a növény kihasználja a gombapartnert és szervesanyag-szükségletének egy részét vagy egészét tőle szerzi be, vagyis gyakorlatilag parazita.[137] Egyes gombafajok hifái nem csak a gyökér, de a szár és a levelek szöveteibe is behatolnak (ún. endofiták).[138] Az endofitikus kolonizáció is lehet kölcsönösen előnyös; a fűfélék endofitái védelmet nyújtanak a növényevő állatokkal szemben, cserébe táplálékot kapnak a gazdanövénytől.[139]
Algákkal és cianobaktériumokkal
[szerkesztés]
A zuzmók nem önálló élőlények, hanem gombák és fotoszintetizáló algák (vagy cianobaktériumok) szimbiotikus telepei. Mindkét részről számos faj vehet részt a kapcsolatban; a gombák esetében többnyire (kb. 90%-ban) tömlősgombák, kisebbrészt pedig bazídiumos gombák.[140] A zuzmók minden kontinensen, minden ökoszisztémában jelen vannak, általában pionír szervezetek, amelyek a kezdeti talajképződésben, a szukcesszióban játszanak alapvető szerepet.[141] Különösen gyakoriak a sarkvidéki, alpesi és félsivatagi környezetben.[142] Általában olyan felületeket kolonizálnak, ahol a növények nehezen telepszenek meg: sziklákat, fakérget, kagylókat stb.[143] A fotoszintetizáló alga (ún. photobiont) cukrokat és egyéb szénhidrátokat ad a gombának, amely cserébe vizet és ásványi anyagokat szolgáltat. A kapcsolat olyan szoros, hogy szinte egyetlen élőlényként funkcionálnak és a zuzmó külsőre is egészen más, mint az eredeti partnerek külön-külön.[144] A gombák mintegy 27%-a - kb. 19 400 faj - alkothat zuzmókat.[145] A zuzmók általános jellemzői közé tartozik a fotoszintetikus táplálékszerzés, a lassú növekedés, viszonylag kis méret, hosszú élettartam, vegetatív szaporodás, a kiszáradás tűrése.[146]
Rovarokkal
[szerkesztés]Számos rovarfaj ápol mutualisztikus kapcsolatot a gombákkal. Egyes hangyák és termeszek elsődlegesen az általuk termesztett gombákkal táplálkoznak, sőt ezt az életmódot folytatják az ormányosbogarak közé tartozó ambróziabogarak is, amelyek a fakéreg alá fúrt járatokban termesztik a gombákat.[147] Vannak olyan darazsak (pl. az óriás-fenyődarázs és rokonai), amelyek petéiket farontó gombák spóráival együtt helyezik a fenyők kérge alá és a kikelő lárva remek táplálékot talál a gomba által átszőtt, meggyengített faanyagban.[148] Legalább egy olyan méhfaj is ismert, melynek lárvája a fészekben termesztett gombán él; ennek spóráit a méhek átviszik az új fészekbe.[149] Élesztőgombák (pl. Candida) kolonizálják a fátyolkák, bogarak, csótányok bélrendszerét; lehetséges, de nem bizonyított, hogy ebből a gazdaállat is profitál.[150] A farágó bogarak számára igen fontos, hogy az elhalt fában gombák is jelen legyenek, mert a faanyag tápértéke önmagában igen alacsony.[151][152][152][153][153][154]
Paraziták és kórokozók
[szerkesztés]
A gombák növények, állatok (beleértve az embert is) és más gombák parazitái lehetnek. Komoly mezőgazdasági és erdészeti károkat okozhatnak az olyan fajok, mint a Magnaporthe oryzae (járványos rizsbarnulás),[155] az Ophiostoma ulmi és az Ophiostoma novo-ulmi (szilfavész),[156] a Cryphonectria parasitica (gesztenyepenész),[157] vagy az olyan nemzetségek tagjai, mint a Fusarium, Ustilago, Alternaria vagy Cochliobolus.[130] Vannak húsevő gombák (pl. Paecilomyces lilacinus) amelyek erre specializált struktúráikkal (érintésre összehúzódó hurkokkal, ragadós fonalakkal vagy bénító toxinokkal) fonálférgeket fognak el.[158] Sok növénypatogén (ilyen a rizsbarnulás kórokozója is) a parazita életmódról a gazda pusztulásakor szaprotróf életmódra vált át és lebontja az elpusztított növény szöveteit.[159] Hasonlóan működnek a más gombákon élősködő fajok (mint az Asterotremella albida): előbb paraziták, majd a gazdagomba elpusztult termőtestét használják tápláléknak.[160]
Egyes gombafajok súlyos, kezelés nélkül akár halálos megbetegedést képesek okozni az embereknél. Ilyen betegség az aspergillózis, a kandidiázis, a kokcidioidomikózis, a parakokcidioidomikózis, a kriptokokkózis, a hisztoplazmózis vagy a micetómák. Az immunhiányos betegek különösen érzékenyek az élesztőgombák (Aspergillus, Candida, Cryptoccocus fajok),[131][161][162] vagy a Histoplasma[163] és Pneumocystis támadására.[164] Más gombák a bőrön, körmön, hajon telepednek meg és okoznak lokális tüneteket.[165] A gombaspórák erős allergének lehetnek.[166]
A gombák parazitái többnyire szintén gombák (mint az aranypenész) vagy gombaszerű organizmusok (pl. a petespórásokhoz tartozó Pythium nemzetség), de ismertek gombákat fertőző vírusok (mikovírusok) is.[167][168][169]
Gombatoxinok
[szerkesztés]
Számos gomba termel bioaktív anyagokat, amelyek mérgezőek is lehetnek az állatok vagy a növények számára (mikotoxinok). Különleges jelentőségük van a mérgező erdei és mezei gombáknak (közülük is a leghírhedtebb a gyilkos galóca), az élelmiszer megromlását okozó penészek toxinjainak, valamint az anyarozs pékárukat is megmérgező, ergotizmust okozó toxikus alkaloidái.[170] Az Aspergillus penészek gabonán és dióféléken növő egyes tagjai rákkeltő aflatoxint termelnek. Egyéb gazdasági, egészségügyi szempontból jelentős, penészgombák, fuzáriumok által termelt méreg még az okratoxin, a patulin, a trichotecén vagy a fumonizin.[171]
A mikotoxinok általában másodlagos metabolitok, amelyeket a gombák arra a célra termelnek, hogy visszaszorítsák a környezetükben található többi gomba vagy baktérium növekedését (ezeket a gyógyászatban is felhasználják), vagy megakadályozzák az állatok általi elfogyasztásukat.[172][173]
Jelentőségük
[szerkesztés]
A közvetlen fogyasztáson túl a gombákat évezredek óta használják az élelmiszerek tartósítására vagy erjesztésére. A vadon termő gombák összegyűjtésén kívül ma már termesztik és nemesítik is őket. Az általuk termelt számos antimikrobiális, bioaktív vagy gyógyhatású vegyület miatt jelentőségük a tradicionális és a modern orvoslásban is óriási. A genetikailag módosított élesztőgombákat - könnyű tenyészthetőségük miatt - a biotechnológiai iparban is rutinszerűen használják.
Gyógyászat
[szerkesztés]
A gombák által előállított gyógyászati bioaktív vegyületek között különöösen nagy jelentőséggel bírnak az antibiotikumok, közülük is az első, amelyet felfedeztek: a penicillin. Az eredeti, természetes penicillin (a Penicillium chrysogenum terméke) viszonylag szűk spektrumú volt, de azóta kémiai változtatásokkal számos változatot állítottak elő. A modern penicillinek már szemiszintetikusak, vagyis a penészgombából fermentációval nyert alapanyagot utólag különféle módon módosítják.[174] Más, gomba eredetű antibiotikumok még a ciklosporin, amit immunoszupresszánsként is használnak szervátültetéskor; vagy a fuzidinsav, mely MRSA-fertőzés esetén is alkalmazható.[175] A gomba-antibiotikumok segítségével lehetett először sikeresen felvenni a harcot olyan betegségek ellen, mint a tuberkulózis, a szifilisz vagy a lepra. Természetes körülmények között az antibiotikumok kettős szerepet játszanak: nagy koncentrációban segítenek leállítani a versenytársak növekedését (elsősorban olyan fajokban gazdag környezetben, mint a rizoszféra), kis koncentrációban viszont a lokális denzitás érzékelésére használják őket a sejtek.[176] Egyéb, a gyógyászatban használt vegyületek közé tartozik még a gombafertőzések ellen használt grizeofulvin (a Penicillium griseofulvum terméke),[177] az érösszehúzó hatású, anyarozsból izolált ergotamin és a koleszterinszintézist gátló sztatinok (pl. a Penicillium citrinum mevasztatinja vagy az Aspergillus terreus lovasztatinja.[178] A gombák antivirális és rákellenes szereket (poliszaharid-K, lentinan) is előállítanak.[179][180]
Egyes gombafajokat népi és hagyományos gyógyászati célokra használtak fel. A kínai tradicionális medicina kedvelt anyagai közé tartozik az Agaricus subrufescens ("mandulagomba"),[180][181] a pecsétviaszgomba[182] vagy a kínai hernyógomba.[183]
Gasztronómia
[szerkesztés]A kenyér és más tésztafélék kelesztésénél használt élesztő az egysejtű sörélesztő (Saccharomyces cerevisiae) és más élesztőgombák tömege.[184] Élesztőgombákkal erjesztik a sört, a bort, illetve a tömény italokhoz a cefrét.[185] A japán konyhában a kódzsu (Aspergillus oryzae penészgomba) segítségével erjesztik a szakét, a miszót, a szójaszószt,[186] míg a jávai konyha a tempeh (erjesztett szója) készítésénél használja fel a Rhizopus oligosporus-t.[187] Manapság már főleg olyan nemesített gombatörzsek vannak forgalomban, amelyek hatékonyabban fermentálnak és nem termelnek mikotoxinokat.[188] Az angol gyártmányú húspótló quorn a Fusarium venenatum-ból készül.[189]

Egyes sajtok érlelésénél is bizonyos gombákra van szükség, hogy megkapják a rájuk jellemző ízvilágot és textúrát. Ilyen például a rokfort, amelyet a Penicillium roqueforti tesz sajátossá.[190] Ezek a penészek nem mérgezőek, azonban a sajtok nem megfelelő tárolása során mikotoxinokat termelő fajok is megtelepedhetnek rajtuk.[191]
A közvetett felhasználás mellett a gombák ősidők óta közvetlenül is táplálékul szolgálnak az embernek. Sokáig csak összegyűjtötték a vadon növő gombákat, de több évszázada termesztik is őket. Ma Magyarországon a leggyakrabban fogyasztott és legnagyobb mennyiségben termesztett gomba a boltokban "csiperke" néven árult kétspórás csiperke, illetve a "laskagomba" (késői laskagomba). Felhasználásuk sokrétű: rántva, sütve, mártásban, levesekben, salátákban egyaránt fogyasztják. Újabban az ázsiai termesztett gombák népszerűsége is növekszik, ilyen pl. a siitake.
A termesztett gombák szinte kivétel nélkül a szaptrotróf fajok közül kerülnek ki, a mikorrhizás gombák ipari termesztése jóval bonyolultabb, ezért itt a fogyasztás többnyire a vadon termett gombákra korlátozódik. Utóbbiakhoz tartoznak az őzlábgombák, rókagombák, vargányák, kucsmagombák, stb. A szarvasgombák szintén mikorrhizás fajok, de nagy értékük miatt jelentős erőfeszítések történtek a termesztésükre.
Mérgező gombák
[szerkesztés]
A gombák egy jelentős hányada az ember számára mérgező vegyületeket termel, amelyek változatos kórtüneteket okozhatnak az enyhe gyomorproblémáktól, az allergiás reakción és hallucinációkon keresztül egészen a halálos szervkárosodásig. Közülük is leghírhedtebb és a legtöbb halálesetért a gyilkos galóca felelős.[192] Rokonságához olyan mérgező fajok tartoznak, mint a hegyeskalapú galóca, a párducgalóca, vagy a fehér galóca. Van olyan faj, amelynek méreganyaga magas hőmérsékleten lebomlik és csak nyersen mérgező (mint a redős papsapkagomba).[193] A sárgászöld pereszkét ehetőnek vélték, míg ki nem derült, hogy fogyasztása izomsorvadáshoz vezethet.[194] A légyölő galóca szintén mérgező, hallucinogén hatásai miatt mégis sokáig fogyasztották (pl. a természeti népek sámánjai).[195]
A mérgező gombafajok felismerése gyakorlatot kíván, ezért az erdőben szedett gombákat fogyasztás előtt mindenképpen ajánlott szakértőnek megmutatni.
Növényvédelem
[szerkesztés]
Számos gomba elpusztít, elnyom vagy élősködik olyan baktérium-, rovar- vagy egyéb gombafajokon, amelyek károsíthatják a kultúrnövényeket; ezeket a biológiai növényvédelemben alkalmazhatják.[196][197] Ilyen a rovarokat elpusztító Beauveria bassiana, Metarhizium, Hirsutella, Paecilomyces fajok vagy a Lecanicillium lecanii.[198][199] Egyes fajok (mint az Epichloë coenophiala) fűfélékkel állnak szimbiózisban és olyan alkaloidákat termelnek, amelyek megmérgezik vagy elriasztják a növényevő rovarokat, fonalférgeket vagy a nagyobb állatokat (beleértve ebbe a szarvasmarhát és juhot is).[200] Újabban próbálnak kinemesíteni olyan változatokat, amelyek mérge csak a rovarokra és a férgekre hat.[201][202]
Ipari felhasználás
[szerkesztés]Gombákkal termeltetnek olyan, a vegyipar által felhasznált anyagokat, mint a citromsav, tejsav, almasav, glükonsav,[203] valamint olyan, ipari méretekben használt enzimeket, mint a mosóporokba kevert lipáz,[204] az etanolkészítésnél alkalmazott celluláz,[205] a papíripar xilanáza,[206] az élelmiszeripar amiláza,[207] invertáza és proteázai.
Egyes fajok (általában azok, amelyek a faanyagokban fehérkorhadást okoznak) képesek lebontani az olyan környezetszennyező ipari hulladékokat, mint a rovarirtók, herbicidek, pentaklórfenol, kreozot, kőszénkátrány.[208] Néhány faj arra is képes, hogy az oldékony uránvegyületeket kicsapja és felhalmozza a sejtjeiben, ami felveti a lehetőségét, hogy a jövőben radioaktívan szennyezett területek megtisztítására is felhasználhatják őket.[209][210][211]
Modellszervezetek
[szerkesztés]Gyors növekedésük és könnyű szaporíthatóságuk miatt a genetikai és sejtbiológiai laboratóriumok gombákat is tanulmányoznak modellszervezetként. Például az egy gén-egy enzim hipotézist Neurospora crassa penészgombával végzett kísérletekkel bizonyították be.[212] De az olyan fajok, mint az Aspergillus nidulans, Saccharomyces cerevisiae, Schizosaccharomyces pombe is gyakran alanyai genetikai vagy biokémiai kísérleteknek, különösen a sejtciklusszabályzás, kromatinszerkezet, génszabályozás tanulmányozása esetén. Az orvostudományi, növényvédelmi, biotechnológiai laboratóriumok az olyan patogéneket, különleges metabolizmusú fajokat kutatják, mint pl. a Candida albicans, a Magnaporthe grisea[213] vagy a Pichia pastoris.[214]
Kapcsolódó cikkek
[szerkesztés]Jegyzetek
[szerkesztés]- ↑ Egymilliárd éves gombákat találtak, az egész élővilág törzsfejlődését át kell értékelni. Index.hu. (Hozzáférés: 2019. november 28.)
- ↑ Bruns T (2006. október 1.). „Evolutionary biology: a kingdom revised”. Nature 443 (7113), 758–61. o. DOI:10.1038/443758a. PMID 17051197.
- ↑ Baldauf SL, Palmer JD (1993. december 1.). „Animals and fungi are each other's closest relatives: congruent evidence from multiple proteins”. Proceedings of the National Academy of Sciences of the United States of America 90 (24), 11558–62. o. DOI:10.1073/pnas.90.24.11558. PMID 8265589. PMC 48023.
- ↑ Deacon, p. 4.
- ↑ Deacon, pp. 128–129.
- ↑ Alexopoulos et al., pp. 28–33.
- ↑ Alexopoulos et al., pp. 31–32.
- ↑ Shoji JY, Arioka M, Kitamoto K (2006). „Possible involvement of pleiomorphic vacuolar networks in nutrient recycling in filamentous fungi”. Autophagy 2 (3), 226–7. o. DOI:10.4161/auto.2695. PMID 16874107.
- ↑ Deacon, p. 58.
- ↑ Zabriskie TM, Jackson MD (2000. február 1.). „Lysine biosynthesis and metabolism in fungi”. Natural Product Reports 17 (1), 85–97. o. DOI:10.1039/a801345d. PMID 10714900.
- ↑ Xu H, Andi B, Qian J, West AH, Cook PF (2006). „The alpha-aminoadipate pathway for lysine biosynthesis in fungi”. Cell Biochemistry and Biophysics 46 (1), 43–64. o. DOI:10.1385/CBB:46:1:43. PMID 16943623.
- ↑ Desjardin DE, Perry BA, Lodge DJ, Stevani CV, Nagasawa E (2010). „Luminescent Mycena: new and noteworthy species”. Mycologia 102 (2), 459–77. o. [2018. november 11-i dátummal az eredetiből archiválva]. DOI:10.3852/09-197. PMID 20361513. (Hozzáférés: 2021. április 23.)
- ↑ Alexopoulos et al., pp. 27–28.
- ↑ a b Alexopoulos et al., p. 30.
- ↑ Alexopoulos et al., pp. 32–33.
- ↑ Bowman SM, Free SJ (2006. augusztus 1.). „The structure and synthesis of the fungal cell wall”. BioEssays 28 (8), 799–808. o. DOI:10.1002/bies.20441. PMID 16927300.
- ↑ Alexopoulos et al., p. 33.
- ↑ a b Keller NP, Turner G, Bennett JW (2005. december 1.). „Fungal secondary metabolism - from biochemistry to genomics”. Nature Reviews. Microbiology 3 (12), 937–47. o. DOI:10.1038/nrmicro1286. PMID 16322742.
- ↑ Wu S, Schalk M, Clark A, Miles RB, Coates R, Chappell J (2006. november 1.). „Redirection of cytosolic or plastidic isoprenoid precursors elevates terpene production in plants”. Nature Biotechnology 24 (11), 1441–7. o. DOI:10.1038/nbt1251. PMID 17057703.
- ↑ Tudzynski B (2005. március 1.). „Gibberellin biosynthesis in fungi: genes, enzymes, evolution, and impact on biotechnology”. Applied Microbiology and Biotechnology 66 (6), 597–611. o. DOI:10.1007/s00253-004-1805-1. PMID 15578178.
- ↑ Vaupotic T, Veranic P, Jenoe P, Plemenitas A (2008. június 1.). „Mitochondrial mediation of environmental osmolytes discrimination during osmoadaptation in the extremely halotolerant black yeast Hortaea werneckii”. Fungal Genetics and Biology 45 (6), 994–1007. o. DOI:10.1016/j.fgb.2008.01.006. PMID 18343697.
- ↑ a b Dadachova E, Bryan RA, Huang X, Moadel T, Schweitzer AD, Aisen P, Nosanchuk JD, Casadevall A (2007). „Ionizing radiation changes the electronic properties of melanin and enhances the growth of melanized fungi”. PLOS ONE 2 (5), e457. o. DOI:10.1371/journal.pone.0000457. PMID 17520016. PMC 1866175.
- ↑ Raghukumar C, Raghukumar S (1998). „Barotolerance of fungi isolated from deep-sea sediments of the Indian Ocean”. Aquatic Microbial Ecology 15 (2), 153–163. o. DOI:10.3354/ame015153.
- ↑ Sancho LG, de la Torre R, Horneck G, Ascaso C, de Los Rios A, Pintado A, Wierzchos J, Schuster M (2007. június 1.). „Lichens survive in space: results from the 2005 LICHENS experiment”. Astrobiology 7 (3), 443–54. o. DOI:10.1089/ast.2006.0046. PMID 17630840.
- ↑ Matthew C. Fisher, Trenton W. J. Garner (2020). „Chytrid fungi and global amphibian declines”. Nature Reviews Microbiology 18 (6), 332–343. o. DOI:10.1038/s41579-020-0335-x. PMID 32099078.
- ↑ Lluvia Vargas-Gastélum, Meritxell Riquelme (2020). „The mycobiota of the deep sea: What omics can offer”. Life 10 (11), 292. o. DOI:10.3390/life10110292. PMID 33228036. PMC 7699357.
- ↑ Martin Cheek, Eimear Nic Lughadha , Paul Kirk, et al. (2020). „New scientific discoveries: Plants and fungi”. Plants, People, Planet 2 (5), 371–388. o. DOI:10.1002/ppp3.10148.
- ↑ Hawksworth DL, Lücking R. Fungal Diversity Revisited: 2.2 to 3.8 Million Species, The Fungal Kingdom, 79–95. o.. DOI: 10.1128/microbiolspec.FUNK-0052-2016 (2017. július 1.). ISBN 978-1-55581-957-6
- ↑ a b Kirk et al., p. 489.
- ↑ a b c d e Hibbett DS, Binder M, Bischoff JF, Blackwell M, Cannon PF, Eriksson OE, Huhndorf S, James T, Kirk PM, Lücking R, Thorsten Lumbsch H, Lutzoni F, Matheny PB, McLaughlin DJ, Powell MJ, Redhead S, Schoch CL, Spatafora JW, Stalpers JA, Vilgalys R, Aime MC, Aptroot A, Bauer R, Begerow D, Benny GL, Castlebury LA, Crous PW, Dai YC, Gams W, Geiser DM, Griffith GW, Gueidan C, Hawksworth DL, Hestmark G, Hosaka K, Humber RA, Hyde KD, Ironside JE, Kõljalg U, Kurtzman CP, Larsson KH, Lichtwardt R, Longcore J, Miadlikowska J, Miller A, Moncalvo JM, Mozley-Standridge S, Oberwinkler F, Parmasto E, Reeb V, Rogers JD, Roux C, Ryvarden L, Sampaio JP, Schüssler A, Sugiyama J, Thorn RG, Tibell L, Untereiner WA, Walker C, Wang Z, Weir A, Weiss M, White MM, Winka K, Yao YJ, Zhang N (2007. május 1.). „A higher-level phylogenetic classification of the Fungi”. Mycological Research 111 (Pt 5), 509–47. o. [2009. március 26-i dátummal az eredetiből archiválva]. DOI:10.1016/j.mycres.2007.03.004. PMID 17572334. (Hozzáférés: 2009. november 29.)
- ↑ Peintner U, Pöder R, Pümpel T (1998). „The Iceman's fungi”. Mycological Research 102 (10), 1153–1162. o. DOI:10.1017/S0953756298006546.
- ↑ Ainsworth, p. 1.
- ↑ Alexopoulos et al., pp. 1–2.
- ↑ Ainsworth, p. 18.
- ↑ Hawksworth DL (2006. szeptember 1.). „Pandora's mycological box: molecular sequences vs. morphology in understanding fungal relationships and biodiversity”. Revista Iberoamericana de Micología 23 (3), 127–33. o. DOI:10.1016/S1130-1406(06)70031-6. PMID 17196017.
- ↑ Harris SD (2008). „Branching of fungal hyphae: regulation, mechanisms and comparison with other branching systems”. Mycologia 100 (6), 823–32. o. DOI:10.3852/08-177. PMID 19202837. (Hozzáférés: 2011. július 5.)
- ↑ Deacon, p. 51.
- ↑ Deacon, p. 57.
- ↑ Parniske M (2008. október 1.). „Arbuscular mycorrhiza: the mother of plant root endosymbioses”. Nature Reviews. Microbiology 6 (10), 763–75. o. DOI:10.1038/nrmicro1987. PMID 18794914.
- ↑ Steenkamp ET, Wright J, Baldauf SL (2006. január 1.). „The protistan origins of animals and fungi”. Molecular Biology and Evolution 23 (1), 93–106. o. DOI:10.1093/molbev/msj011. PMID 16151185.
- ↑ Hanson, pp. 127–141.
- ↑ Ferguson BA, Dreisbach TA, Parks CG, Filip GM, Schmitt CL (2003). „Coarse-scale population structure of pathogenic Armillaria species in a mixed-conifer forest in the Blue Mountains of northeast Oregon”. Canadian Journal of Forest Research 33 (4), 612–623. o. DOI:10.1139/x03-065. (Hozzáférés: 2019. július 3.)
- ↑ Peñalva MA, Arst HN (2002. szeptember 1.). „Regulation of gene expression by ambient pH in filamentous fungi and yeasts”. Microbiology and Molecular Biology Reviews 66 (3), 426–46, table of contents. o. DOI:10.1128/MMBR.66.3.426-446.2002. PMID 12208998. PMC 120796.
- ↑ a b Howard RJ, Ferrari MA, Roach DH, Money NP (1991. december 1.). „Penetration of hard substrates by a fungus employing enormous turgor pressures”. Proceedings of the National Academy of Sciences of the United States of America 88 (24), 11281–4. o. DOI:10.1073/pnas.88.24.11281. PMID 1837147. PMC 53118.
- ↑ Money NP. Mechanics of invasive fungal growth and the significance of turgor in plant infection, Molecular Genetics of Host-Specific Toxins in Plant Disease: Proceedings of the 3rd Tottori International Symposium on Host-Specific Toxins, Daisen, Tottori, Japan, August 24–29, 1997. Netherlands: Kluwer Academic Publishers, 261–271. o. (1998). ISBN 978-0-7923-4981-5
- ↑ Wang ZY, Jenkinson JM, Holcombe LJ, Soanes DM, Veneault-Fourrey C, Bhambra GK, Talbot NJ (2005. április 1.). „The molecular biology of appressorium turgor generation by the rice blast fungus Magnaporthe grisea”. Biochemical Society Transactions 33 (Pt 2), 384–8. o. DOI:10.1042/BST0330384. PMID 15787612.
- ↑ Marzluf GA (1981. szeptember 1.). „Regulation of nitrogen metabolism and gene expression in fungi”. Microbiological Reviews 45 (3), 437–61. o. DOI:10.1128/MMBR.45.3.437-461.1981. PMID 6117784. PMC 281519.
- ↑ Hynes MJ (1994). „Regulatory circuits of the amdS gene of Aspergillus nidulans”. Antonie van Leeuwenhoek 65 (3), 179–82. o. DOI:10.1007/BF00871944. PMID 7847883.
- ↑ Pereira JL, Noronha EF, Miller RN, Franco OL (2007. június 1.). „Novel insights in the use of hydrolytic enzymes secreted by fungi with biotechnological potential”. Letters in Applied Microbiology 44 (6), 573–81. o. DOI:10.1111/j.1472-765X.2007.02151.x. PMID 17576216.
- ↑ Schaller M, Borelli C, Korting HC, Hube B (2005. november 1.). „Hydrolytic enzymes as virulence factors of Candida albicans”. Mycoses 48 (6), 365–77. o. DOI:10.1111/j.1439-0507.2005.01165.x. PMID 16262871.
- ↑ Farrar JF (1985. október 1.). „Carbohydrate metabolism in biotrophic plant pathogens”. Microbiological Sciences 2 (10), 314–7. o. PMID 3939987.
- ↑ Fischer R, Zekert N, Takeshita N (2008. május 1.). „Polarized growth in fungi--interplay between the cytoskeleton, positional markers and membrane domains”. Molecular Microbiology 68 (4), 813–26. o. DOI:10.1111/j.1365-2958.2008.06193.x. PMID 18399939.
- ↑ Christensen MJ, Bennett RJ, Ansari HA, Koga H, Johnson RD, Bryan GT, Simpson WR, Koolaard JP, Nickless EM, Voisey CR (2008. február 1.). „Epichloë endophytes grow by intercalary hyphal extension in elongating grass leaves”. Fungal Genetics and Biology 45 (2), 84–93. o. DOI:10.1016/j.fgb.2007.07.013. PMID 17919950.
- ↑ Money NP (2002. október 1.). „Mushroom stem cells”. BioEssays 24 (10), 949–52. o. DOI:10.1002/bies.10160. PMID 12325127.
- ↑ Heitman J (2006. szeptember 1.). „Sexual reproduction and the evolution of microbial pathogens”. Current Biology 16 (17), R711–25. o. DOI:10.1016/j.cub.2006.07.064. PMID 16950098.
- ↑ a b Redecker D, Raab P (2006). „Phylogeny of the glomeromycota (arbuscular mycorrhizal fungi): recent developments and new gene markers”. Mycologia 98 (6), 885–95. o. DOI:10.3852/mycologia.98.6.885. PMID 17486965. (Hozzáférés: 2011. július 5.)
- ↑ Guarro J, Stchigel AM (1999. július 1.). „Developments in fungal taxonomy”. Clinical Microbiology Reviews 12 (3), 454–500. o. DOI:10.1128/CMR.12.3.454. PMID 10398676. PMC 100249.
- ↑ Taylor JW, Jacobson DJ, Kroken S, Kasuga T, Geiser DM, Hibbett DS, Fisher MC (2000. október 1.). „Phylogenetic species recognition and species concepts in fungi”. Fungal Genetics and Biology 31 (1), 21–32. o. DOI:10.1006/fgbi.2000.1228. PMID 11118132.
- ↑ Metzenberg RL, Glass NL (1990. február 1.). „Mating type and mating strategies in Neurospora”. BioEssays 12 (2), 53–9. o. DOI:10.1002/bies.950120202. PMID 2140508.
- ↑ Heitman, Joseph (2015). „Evolution of sexual reproduction: A view from the fungal kingdom supports an evolutionary epoch with sex before sexes”. Fungal Biology Reviews 29 (3-4), 108–117. o. DOI:10.1016/j.fbr.2015.08.002. ISSN 1749-4613.
- ↑ Jennings and Lysek, pp. 107–114.
- ↑ Deacon, p. 31.
- ↑ Alexopoulos et al., pp. 492–493.
- ↑ Jennings and Lysek, p. 142.
- ↑ Jennings and Lysek, pp. 114–115.
- ↑ Furlaneto MC, Pizzirani-Kleiner AA (1992. január 1.). „Intraspecific hybridisation of Trichoderma pseudokoningii by anastomosis and by protoplast fusion”. FEMS Microbiology Letters 69 (2), 191–5. o. DOI:10.1111/j.1574-6968.1992.tb05150.x. PMID 1537549.
- ↑ Spore Dispersal in Fungi. www.botany.hawaii.edu . [2011. november 17-i dátummal az eredetiből archiválva]. (Hozzáférés: 2018. december 28.)
- ↑ Dispersal (angol nyelven). herbarium.usu.edu . [2018. december 28-i dátummal az eredetiből archiválva]. (Hozzáférés: 2018. december 28.)
- ↑ Linder MB, Szilvay GR, Nakari-Setälä T, Penttilä ME (2005. november 1.). „Hydrophobins: the protein-amphiphiles of filamentous fungi”. FEMS Microbiology Reviews 29 (5), 877–96. o. DOI:10.1016/j.femsre.2005.01.004. PMID 16219510.
- ↑ Trail F (2007. november 1.). „Fungal cannons: explosive spore discharge in the Ascomycota”. FEMS Microbiology Letters 276 (1), 12–8. o. DOI:10.1111/j.1574-6968.2007.00900.x. PMID 17784861.
- ↑ Pringle A, Patek SN, Fischer M, Stolze J, Money NP (2005). „The captured launch of a ballistospore”. Mycologia 97 (4), 866–71. o. DOI:10.3852/mycologia.97.4.866. PMID 16457355. (Hozzáférés: 2011. július 5.)
- ↑ Kirk et al., p. 495.
- ↑ Stipitate hydnoid fungi, Hampshire Biodiversity Partnership. [2016. március 4-i dátummal az eredetiből archiválva]. (Hozzáférés: 2019. november 13.)
- ↑ Brodie HJ. The Bird's Nest Fungi. Toronto, Ontario: University of Toronto Press, 80. o. (1975). ISBN 978-0-8020-5307-7
- ↑ Alexopoulos et al., p. 545.
- ↑ Assembling the Tree of Life. Oxford (Oxfordshire), UK: Oxford University Press, 187. o. (2004). ISBN 978-0-19-517234-8
- ↑ Taylor and Taylor, p. 19.
- ↑ Stefan Bengtson, Birger Rasmussen, Magnus Ivarsson, et al. (2017. április 24.). „Fungus-like mycelial fossils in 2.4-billion-year-old vesicular basalt”. Nature Ecology & Evolution 1 (6), 0141. o. DOI:10.1038/s41559-017-0141. PMID 28812648. (Hozzáférés: 2019. július 15.)
- ↑ Lücking R, Huhndorf S, Pfister DH, Plata ER, Lumbsch HT (2009). „Fungi evolved right on track”. Mycologia 101 (6), 810–22. o. DOI:10.3852/09-016. PMID 19927746.
- ↑ James TY, Kauff F, Schoch CL, Matheny PB, Hofstetter V, Cox CJ, Celio G, Gueidan C, Fraker E, Miadlikowska J, Lumbsch HT, Rauhut A, Reeb V, Arnold AE, Amtoft A, Stajich JE, Hosaka K, Sung GH, Johnson D, O'Rourke B, Crockett M, Binder M, Curtis JM, Slot JC, Wang Z, Wilson AW, Schüssler A, Longcore JE, O'Donnell K, Mozley-Standridge S, Porter D, Letcher PM, Powell MJ, Taylor JW, White MM, Griffith GW, Davies DR, Humber RA, Morton JB, Sugiyama J, Rossman AY, Rogers JD, Pfister DH, Hewitt D, Hansen K, Hambleton S, Shoemaker RA, Kohlmeyer J, Volkmann-Kohlmeyer B, Spotts RA, Serdani M, Crous PW, Hughes KW, Matsuura K, Langer E, Langer G, Untereiner WA, Lücking R, Büdel B, Geiser DM, Aptroot A, Diederich P, Schmitt I, Schultz M, Yahr R, Hibbett DS, Lutzoni F, McLaughlin DJ, Spatafora JW, Vilgalys R (2006. október 1.). „Reconstructing the early evolution of Fungi using a six-gene phylogeny”. Nature 443 (7113), 818–22. o. DOI:10.1038/nature05110. PMID 17051209.
- ↑ Taylor and Taylor, pp. 84–94 and 106–107.
- ↑ Schoch CL, Sung GH, López-Giráldez F, Townsend JP, Miadlikowska J, Hofstetter V, Robbertse B, Matheny PB, Kauff F, Wang Z, Gueidan C, Andrie RM, Trippe K, Ciufetti LM, Wynns A, Fraker E, Hodkinson BP, Bonito G, Groenewald JZ, Arzanlou M, de Hoog GS, Crous PW, Hewitt D, Pfister DH, Peterson K, Gryzenhout M, Wingfield MJ, Aptroot A, Suh SO, Blackwell M, Hillis DM, Griffith GW, Castlebury LA, Rossman AY, Lumbsch HT, Lücking R, Büdel B, Rauhut A, Diederich P, Ertz D, Geiser DM, Hosaka K, Inderbitzin P, Kohlmeyer J, Volkmann-Kohlmeyer B, Mostert L, O'Donnell K, Sipman H, Rogers JD, Shoemaker RA, Sugiyama J, Summerbell RC, Untereiner W, Johnston PR, Stenroos S, Zuccaro A, Dyer PS, Crittenden PD, Cole MS, Hansen K, Trappe JM, Yahr R, Lutzoni F, Spatafora JW (2009. április 1.). „The Ascomycota tree of life: a phylum-wide phylogeny clarifies the origin and evolution of fundamental reproductive and ecological traits”. Systematic Biology 58 (2), 224–39. o. DOI:10.1093/sysbio/syp020. PMID 20525580.
- ↑ Zimmer, Carl. „How Did Life Arrive on Land? A Billion-Year-Old Fungus May Hold Clues - A cache of microscopic fossils from the Arctic hints that fungi reached land long before plants.”, The New York Times, 2019. május 22.. [2019. május 23-i dátummal az eredetiből archiválva] (Hozzáférés: 2019. május 23.)
- ↑ Corentin C. Loron, Camille François, Robert H. Rainbird, et al. (2019. május 22.). „Early fungi from the Proterozoic era in Arctic Canada”. Nature 570 (7760), 232–235. o, Kiadó: Springer Science and Business Media LLC. DOI:10.1038/s41586-019-1217-0. ISSN 0028-0836. PMID 31118507.
- ↑ Timmer, John: Billion-year-old fossils may be early fungus. Ars Technica , 2019. május 22. [2019. május 23-i dátummal az eredetiből archiválva]. (Hozzáférés: 2019. május 23.)
- ↑ Tian Gan, Taiyi Luo, Ke Pang, et al. (2021. január 28.). „Cryptic terrestrial fungus-like fossils of the early Ediacaran Period” (angol nyelven). Nature Communications 12 (1), 641. o. DOI:10.1038/s41467-021-20975-1. ISSN 2041-1723.
- ↑ Redecker D, Kodner R, Graham LE (2000. szeptember 1.). „Glomalean fungi from the Ordovician”. Science 289 (5486), 1920–1. o. DOI:10.1126/science.289.5486.1920. PMID 10988069.
- ↑ Brundrett MC (2002). „Coevolution of roots and mycorrhizas of land plants”. New Phytologist 154 (2), 275–304. o. DOI:10.1046/j.1469-8137.2002.00397.x.
- ↑ Taylor TN, Taylor EL (1996). „The distribution and interactions of some Paleozoic fungi”. Review of Palaeobotany and Palynology 95 (1–4), 83–94. o. DOI:10.1016/S0034-6667(96)00029-2.
- ↑ Dotzler N, Walker C, Krings M, Hass H, Kerp H, Taylor TN, Agerer R (2009). „Acaulosporoid glomeromycotan spores with a germination shield from the 400-million-year-old Rhynie chert”. Mycological Progress 8 (1), 9–18. o. DOI:10.1007/s11557-008-0573-1.
- ↑ Taylor JW, Berbee ML (2006). „Dating divergences in the Fungal Tree of Life: review and new analyses”. Mycologia 98 (6), 838–49. o. [2016. április 12-i dátummal az eredetiből archiválva]. DOI:10.3852/mycologia.98.6.838. PMID 17486961. (Hozzáférés: 2021. április 23.)
- ↑ Blackwell M, Vilgalys R, James TY, Taylor JW: Fungi. Eumycota: mushrooms, sac fungi, yeast, molds, rusts, smuts, etc.. Tree of Life Web Project, 2009. [2009. április 13-i dátummal az eredetiből archiválva]. (Hozzáférés: 2009. április 25.)
- ↑ Taylor TN, Hass H, Kerp H, Krings M, Hanlin RT (2005). „Perithecial ascomycetes from the 400 million year old Rhynie chert: an example of ancestral polymorphism”. Mycologia 97 (1), 269–85. o. DOI:10.3852/mycologia.97.1.269. PMID 16389979. (Hozzáférés: 2011. július 5.)
- ↑ Dennis RL (1970). „A Middle Pennsylvanian basidiomycete mycelium with clamp connections”. Mycologia 62 (3), 578–584. o. DOI:10.2307/3757529. JSTOR 3757529. (Hozzáférés: 2011. július 5.)
- ↑ Hibbett DS, Grimaldi D, Donoghue MJ (1995). „Cretaceous mushrooms in amber”. Nature 377 (6549), 487. o. DOI:10.1038/377487a0.
- ↑ Hibbett DS, Grimaldi D, Donoghue MJ (1997). „Fossil mushrooms from Miocene and Cretaceous ambers and the evolution of homobasidiomycetes”. American Journal of Botany 84 (7), 981–991. o. DOI:10.2307/2446289. JSTOR 2446289. PMID 21708653.
- ↑ Eshet Y, Rampino MR, Visscher H (1995). „Fungal event and palynological record of ecological crisis and recovery across the Permian-Triassic boundary”. Geology 23 (1), 967–970. o. DOI:<0967:FEAPRO>2.3.CO;2 10.1130/0091-7613(1995)023<0967:FEAPRO>2.3.CO;2.
- ↑ López-Gómez J, Taylor EL (2005). „Permian-Triassic transition in Spain: a multidisciplinary approach”. Palaeogeography, Palaeoclimatology, Palaeoecology 229 (1–2), 1–2. o. DOI:10.1016/j.palaeo.2005.06.028.
- ↑ Looy CV, Twitchett RJ, Dilcher DL, Van Konijnenburg-Van Cittert JH, Visscher H (2001. július 1.). „Life in the end-Permian dead zone”. Proceedings of the National Academy of Sciences of the United States of America 98 (14), 7879–83. o. DOI:10.1073/pnas.131218098. PMID 11427710. PMC 35436. „See image 2”
- ↑ Arturo Casadevall, Joseph Heitman (2012. augusztus 16.). „Fungi and the Rise of Mammals”. PLOS Pathogens 8 (8), e1002808. o. DOI:10.1371/journal.ppat.1002808. PMID 22916007. PMC 3420938.
- ↑ Shalchian-Tabrizi K, Minge MA, Espelund M, Orr R, Ruden T, Jakobsen KS, Cavalier-Smith T (2008). „Multigene phylogeny of choanozoa and the origin of animals”. PLOS ONE 3 (5), e2098. o. DOI:10.1371/journal.pone.0002098. PMID 18461162. PMC 2346548.
- ↑ Palaeos Fungi: Fungi Archiválva 2012. június 20-i dátummal a Wayback Machine-ben. archive
- ↑ Silar P. Protistes Eucaryotes: Origine, Evolution et Biologie des Microbes Eucaryotes. HAL, 462. o. (2016). ISBN 978-2-9555841-0-1
- ↑ Esser K. The Mycota VII A: Systematics and Evolution (2nd ed.). Springer, 461. o. (2014). ISBN 978-3-642-55317-2
- ↑ Leho Tedersoo, Santiago Sanchez-Ramırez, Urmas Koljalg, et al. (2018. február 22.). „High-level classification of the Fungi and a tool for evolutionary ecological analyses”. Fungal Diversity 90 (1), 135–159. o. DOI:10.1007/s13225-018-0401-0.
- ↑ Liu YJ, Hodson MC, Hall BD (2006). „Loss of the flagellum happened only once in the fungal lineage: phylogenetic structure of kingdom Fungi inferred from RNA polymerase II subunit genes”. BMC Evolutionary Biology 6, 74. o. DOI:10.1186/1471-2148-6-74. PMID 17010206. PMC 1599754.
- ↑ (2018. január 14.) „High-level classification of the Fungi and a tool for evolutionary ecological analyses” (angol nyelven). Fungal Diversity 90 (1), 135–159. o. DOI:10.1007/s13225-018-0401-0. ISSN 1560-2745.
- ↑ (2018. augusztus 17.) „The aphelid-like phagotrophic origins of fungi” (angol nyelven). bioRxiv, 233882. o. DOI:10.1101/233882.
- ↑ Galindo, Luis Javier (2022. július 28.). „Phylogenomics Supports the Monophyly of Aphelids and Fungi and Identifies New Molecular Synapomorphies”. Systematic Biology.
- ↑ James TY, Letcher PM, Longcore JE, Mozley-Standridge SE, Porter D, Powell MJ, Griffith GW, Vilgalys R (2006). „A molecular phylogeny of the flagellated fungi (Chytridiomycota) and description of a new phylum (Blastocladiomycota)”. Mycologia 98 (6), 860–71. o. DOI:10.3852/mycologia.98.6.860. PMID 17486963. (Hozzáférés: 2011. július 5.)
- ↑ Lockhart RJ, Van Dyke MI, Beadle IR, Humphreys P, McCarthy AJ (2006. augusztus 1.). „Molecular biological detection of anaerobic gut fungi (Neocallimastigales) from landfill sites”. Applied and Environmental Microbiology 72 (8), 5659–61. o. DOI:10.1128/AEM.01057-06. PMID 16885325. PMC 1538735.
- ↑ a b Remy W, Taylor TN, Hass H, Kerp H (1994. december 1.). „Four hundred-million-year-old vesicular arbuscular mycorrhizae”. Proceedings of the National Academy of Sciences of the United States of America 91 (25), 11841–3. o. DOI:10.1073/pnas.91.25.11841. PMID 11607500. PMC 45331.
- ↑ Alexopoulos et al., p. 145.
- ↑ For an example, see Samuels GJ (2006. február 1.). „Trichoderma: systematics, the sexual state, and ecology”. Phytopathology 96 (2), 195–206. o. DOI:10.1094/PHYTO-96-0195. PMID 18943925.
- ↑ Radford A, Parish JH (1997. június 1.). „The genome and genes of Neurospora crassa”. Fungal Genetics and Biology 21 (3), 258–66. o. DOI:10.1006/fgbi.1997.0979. PMID 9290240.
- ↑ Dario R. Olicón-Hernández, Minerva G. Araiza-Villanueva , Juan P. Pardo, et al. (2019). „New insights of Ustilago maydis as yeast model for genetic and biotechnological research: A review”. Current Microbiology 76 (8), 917–926. o. DOI:10.1007/s00284-019-01629-4. PMID 30689003.
- ↑ Wafa Rhimi, Bart Theelen, Teun Boekhout, et al. (2020). „Malassezia spp. yeasts of emerging concern in fungemia”. Frontiers in Cellular and Infection Microbiology 10. DOI:10.3389/fcimb.2020.00370. PMID 32850475. PMC 7399178.
- ↑ Perfect JR (2006. június 1.). „Cryptococcus neoformans: the yeast that likes it hot”. FEMS Yeast Research 6 (4), 463–8. o. DOI:10.1111/j.1567-1364.2006.00051.x. PMID 16696642.
- ↑ Blackwell M, Spatafora JW. Fungi and their allies, Biodiversity of Fungi: Inventory and Monitoring Methods. Amsterdam: Elsevier Academic Press, 18–20. o. (2004). ISBN 978-0-12-509551-8
- ↑ Miguel A. Naranjo‐Ortiz, Toni Gabaldón (2019). „Fungal evolution: Diversity, taxonomy and phylogeny of the Fungi”. Biological Reviews 94 (6), 2101–2137. o. DOI:10.1111/brv.12550.
- ↑ Maria Julia Amoroso, Claudia Susana Benimeli, Sergio Antonio Cuozzo. Actinobacteria : application in bioremediation and production of industrial enzymes (angol nyelven). CRC Press, Taylor & Francis Group, 33. o. (2013. január 14.). ISBN 9781466578739
- ↑ An introduction to soil biology, Actinobacteria
- ↑ Gadd GM (2007. január 1.). „Geomycology: biogeochemical transformations of rocks, minerals, metals and radionuclides by fungi, bioweathering and bioremediation”. Mycological Research 111 (Pt 1), 3–49. o. DOI:10.1016/j.mycres.2006.12.001. PMID 17307120.
- ↑ a b Lindahl BD, Ihrmark K, Boberg J, Trumbore SE, Högberg P, Stenlid J, Finlay RD (2007). „Spatial separation of litter decomposition and mycorrhizal nitrogen uptake in a boreal forest”. The New Phytologist 173 (3), 611–20. o. DOI:10.1111/j.1469-8137.2006.01936.x. PMID 17244056.
- ↑ Barea JM, Pozo MJ, Azcón R, Azcón-Aguilar C (2005. július 1.). „Microbial co-operation in the rhizosphere”. Journal of Experimental Botany 56 (417), 1761–78. o. DOI:10.1093/jxb/eri197. PMID 15911555.
- ↑ Aanen DK (2006. június 1.). „As you reap, so shall you sow: coupling of harvesting and inoculating stabilizes the mutualism between termites and fungi”. Biology Letters 2 (2), 209–12. o. DOI:10.1098/rsbl.2005.0424. PMID 17148364. PMC 1618886.
- ↑ Nikoh N, Fukatsu T (2000. április 1.). „Interkingdom host jumping underground: phylogenetic analysis of entomoparasitic fungi of the genus cordyceps”. Molecular Biology and Evolution 17 (4), 629–38. o. DOI:10.1093/oxfordjournals.molbev.a026341. PMID 10742053.
- ↑ Perotto S, Bonfante P (1997. december 1.). „Bacterial associations with mycorrhizal fungi: close and distant friends in the rhizosphere”. Trends in Microbiology 5 (12), 496–501. o. DOI:10.1016/S0966-842X(97)01154-2. PMID 9447662.
- ↑ Arnold AE, Mejía LC, Kyllo D, Rojas EI, Maynard Z, Robbins N, Herre EA (2003. december 1.). „Fungal endophytes limit pathogen damage in a tropical tree”. Proceedings of the National Academy of Sciences of the United States of America 100 (26), 15649–54. o. DOI:10.1073/pnas.2533483100. PMID 14671327. PMC 307622.
- ↑ a b Paszkowski U (2006. augusztus 1.). „Mutualism and parasitism: the yin and yang of plant symbioses”. Current Opinion in Plant Biology 9 (4), 364–70. o. DOI:10.1016/j.pbi.2006.05.008. PMID 16713732.
- ↑ a b Hube B (2004. augusztus 1.). „From commensal to pathogen: stage- and tissue-specific gene expression of Candida albicans”. Current Opinion in Microbiology 7 (4), 336–41. o. DOI:10.1016/j.mib.2004.06.003. PMID 15288621.
- ↑ Bonfante P (2003. április 1.). „Plants, mycorrhizal fungi and endobacteria: a dialog among cells and genomes”. The Biological Bulletin 204 (2), 215–20. o. DOI:10.2307/1543562. JSTOR 1543562. PMID 12700157.
- ↑ van der Heijden MG, Streitwolf-Engel R, Riedl R, Siegrist S, Neudecker A, Ineichen K, Boller T, Wiemken A, Sanders IR (2006). „The mycorrhizal contribution to plant productivity, plant nutrition and soil structure in experimental grassland”. The New Phytologist 172 (4), 739–52. o. DOI:10.1111/j.1469-8137.2006.01862.x. PMID 17096799.
- ↑ Heijden, Marcel G. A. van der (2016. április 15.). „Underground networking” (angol nyelven). Science 352 (6283), 290–291. o. DOI:10.1126/science.aaf4694. ISSN 0036-8075. PMID 27081054.
- ↑ Selosse MA, Richard F, He X, Simard SW (2006. november 1.). „Mycorrhizal networks: des liaisons dangereuses?”. Trends in Ecology & Evolution 21 (11), 621–8. o. DOI:10.1016/j.tree.2006.07.003. PMID 16843567.
- ↑ Yong, Ed: Trees Have Their Own Internet (amerikai angol nyelven). The Atlantic , 2016. április 14. [2019. március 28-i dátummal az eredetiből archiválva]. (Hozzáférés: 2019. március 9.)
- ↑ Merckx V, Bidartondo MI, Hynson NA (2009. december 1.). „Myco-heterotrophy: when fungi host plants”. Annals of Botany 104 (7), 1255–61. o. DOI:10.1093/aob/mcp235. PMID 19767309. PMC 2778383.
- ↑ Schulz B, Boyle C (2005. június 1.). „The endophytic continuum”. Mycological Research 109 (Pt 6), 661–86. o. DOI:10.1017/S095375620500273X. PMID 16080390.
- ↑ Clay K, Schardl C (2002. október 1.). „Evolutionary origins and ecological consequences of endophyte symbiosis with grasses”. The American Naturalist 160 Suppl 4 (suppl. 4), S99–S127. o. DOI:10.1086/342161. PMID 18707456.
- ↑ Brodo IM, Sharnoff SD. Lichens of North America. New Haven, Connecticut: Yale University Press (2001). ISBN 978-0-300-08249-4
- ↑ Raven PH, Evert RF, Eichhorn, SE. 14—Fungi, Biology of Plants, 7, W. H. Freeman, 290. o. (2005). ISBN 978-0-7167-1007-3
- ↑ Deacon, p. 267.
- ↑ Purvis W. Lichens. Washington, D.C.: Smithsonian Institution Press in association with the Natural History Museum, London, 49–75. o. (2000). ISBN 978-1-56098-879-3
- ↑ Kirk et al., p. 378.
- ↑ Deacon, pp. 267–276.
- ↑ Douglas AE (1989. november 1.). „Mycetocyte symbiosis in insects”. Biological Reviews of the Cambridge Philosophical Society 64 (4), 409–34. o. DOI:10.1111/j.1469-185X.1989.tb00682.x. PMID 2696562.
- ↑ Deacon, p. 277.
- ↑ Entomologists: Brazilian Stingless Bee Must Cultivate Special Type of Fungus to Survive. Sci-News.com , 2015. október 23. [2015. október 25-i dátummal az eredetiből archiválva]. (Hozzáférés: 2015. október 25.)
- ↑ Nguyen NH, Suh SO, Blackwell M (2007). „Five novel Candida species in insect-associated yeast clades isolated from Neuroptera and other insects”. Mycologia 99 (6), 842–58. o. DOI:10.3852/mycologia.99.6.842. PMID 18333508. (Hozzáférés: 2011. július 5.)
- ↑ Michał Filipiak, January Weiner (2017. március 1.). „Nutritional dynamics during the development of xylophagous beetles related to changes in the stoichiometry of 11 elements”. Physiological Entomology 42 (1), 73–84. o. DOI:10.1111/phen.12168.
- ↑ a b Ulyshen, Michael D.. Saproxylic insects : diversity, ecology and conservation. Springer, Cham, 429–469. o.. DOI: 10.1007/978-3-319-75937-1_13 (2018. január 14.). ISBN 978-3-319-75937-1
- ↑ a b Ulyshen, Michael D.. Saproxylic Insects Diversity, Ecology and Conservation. Springer, Cham, 377–427. o.. DOI: 10.1007/978-3-319-75937-1_12 (2018. január 14.). ISBN 978-3-319-75936-4
- ↑ Michał Filipiak, Łukasz Sobczyk, January Weiner (2016. január 14.). „Fungal Transformation of Tree Stumps into a Suitable Resource for Xylophagous Beetles via Changes in Elemental Ratios”. Insects 7 (2), 13. o. DOI:10.3390/insects7020013. PMC 4931425.
- ↑ Talbot NJ (2003). „On the trail of a cereal killer: Exploring the biology of Magnaporthe grisea”. Annual Review of Microbiology 57, 177–202. o. DOI:10.1146/annurev.micro.57.030502.090957. PMID 14527276.
- ↑ Paoletti M, Buck KW, Brasier CM (2006. január 1.). „Selective acquisition of novel mating type and vegetative incompatibility genes via interspecies gene transfer in the globally invading eukaryote Ophiostoma novo-ulmi”. Molecular Ecology 15 (1), 249–62. o. DOI:10.1111/j.1365-294X.2005.02728.x. PMID 16367844.
- ↑ Gryzenhout M, Wingfield BD, Wingfield MJ (2006. május 1.). „New taxonomic concepts for the important forest pathogen Cryphonectria parasitica and related fungi”. FEMS Microbiology Letters 258 (2), 161–72. o. DOI:10.1111/j.1574-6968.2006.00170.x. PMID 16640568.
- ↑ Yang Y, Yang E, An Z, Liu X (2007. május 1.). „Evolution of nematode-trapping cells of predatory fungi of the Orbiliaceae based on evidence from rRNA-encoding DNA and multiprotein sequences”. Proceedings of the National Academy of Sciences of the United States of America 104 (20), 8379–84. o. DOI:10.1073/pnas.0702770104. PMID 17494736. PMC 1895958.
- ↑ M. Koeck, A.R. Hardham, P.N. Dodds (2011. január 14.). „The role of effectors of biotrophic and hemibiotrophic fungi in infection”. Cellular Microbiology 13 (12), 1849–1857. o. DOI:10.1111/j.1462-5822.2011.01665.x. PMID 21848815. PMC 3218205.
- ↑ Asterotremella gen. nov. albida, an anamorphic tremelloid yeast isolated from the agarics Asterophora lycoperdoides and Asterophora parasitica (angol nyelven). ResearchGate . (Hozzáférés: 2019. április 19.)
- ↑ Nielsen K, Heitman J. Sex and Virulence of Human Pathogenic Fungi, Fungal Genomics, Advances in Genetics, 143–73. o.. DOI: 10.1016/S0065-2660(06)57004-X (2007). ISBN 978-0-12-017657-1
- ↑ Brakhage AA (2005. december 1.). „Systemic fungal infections caused by Aspergillus species: epidemiology, infection process and virulence determinants”. Current Drug Targets 6 (8), 875–86. o. DOI:10.2174/138945005774912717. PMID 16375671.
- ↑ Kauffman CA (2007. január 1.). „Histoplasmosis: a clinical and laboratory update”. Clinical Microbiology Reviews 20 (1), 115–32. o. DOI:10.1128/CMR.00027-06. PMID 17223625. PMC 1797635.
- ↑ Cushion MT, Smulian AG, Slaven BE, Sesterhenn T, Arnold J, Staben C, Porollo A, Adamczak R, Meller J (2007). „Transcriptome of Pneumocystis carinii during fulminate infection: carbohydrate metabolism and the concept of a compatible parasite”. PLOS ONE 2 (5), e423. o. DOI:10.1371/journal.pone.0000423. PMID 17487271. PMC 1855432.
- ↑ Cook GC, Zumla AI. Manson's Tropical Diseases: Expert Consult. Edinburgh, Scotland: Saunders Ltd, 347. o. (2008). ISBN 978-1-4160-4470-3
- ↑ Simon-Nobbe B, Denk U, Pöll V, Rid R, Breitenbach M (2008). „The spectrum of fungal allergy”. International Archives of Allergy and Immunology 145 (1), 58–86. o. DOI:10.1159/000107578. PMID 17709917.
- ↑ Le Floch G, Rey P, Benizri E, Benhamou N, Tirilly Y (2003. január 14.). „Impact of auxin-compounds produced by the antagonistic fungus Pythium oligandrum or the minor pathogen Pythium group F on plant growth.”. Plant Soil 257 (2), 459–470. o. DOI:10.1023/a:1027330024834.
- ↑ Pearson MN, Beever RE, Boine B, Arthur K (2009. január 1.). „Mycoviruses of filamentous fungi and their relevance to plant pathology”. Molecular Plant Pathology 10 (1), 115–28. o. DOI:10.1111/j.1364-3703.2008.00503.x. PMID 19161358. PMC 6640375.
- ↑ Bozarth RF (1972. október 1.). „Mycoviruses: a new dimension in microbiology”. Environmental Health Perspectives 2 (1), 23–39. o. DOI:10.1289/ehp.720223. PMID 4628853. PMC 1474899.
- ↑ Schardl CL, Panaccione DG, Tudzynski P. Ergot alkaloids--biology and molecular biology, The Alkaloids: Chemistry and Biology, 45–86. o.. DOI: 10.1016/S1099-4831(06)63002-2 (2006). ISBN 978-0-12-469563-4
- ↑ Edyta Janik, Marcin Niemcewicz, Michal Ceremuga, Maksymilian Stela, et al. (2020). „Molecular aspects of mycotoxins—a serious problem for human health”. International Journal of Molecular Sciences 21 (21), 8187. o. DOI:10.3390/ijms21218187. PMID 33142955. PMC 7662353.
- ↑ Demain AL, Fang A. The Natural Functions of Secondary Metabolites, History of Modern Biotechnology I, Advances in Biochemical Engineering/Biotechnology, 1–39. o.. DOI: 10.1007/3-540-44964-7_1 (2000). ISBN 978-3-540-67793-2
- ↑ Rohlfs M, Albert M, Keller NP, Kempken F (2007. október 1.). „Secondary chemicals protect mould from fungivory”. Biology Letters 3 (5), 523–5. o. DOI:10.1098/rsbl.2007.0338. PMID 17686752. PMC 2391202.
- ↑ Brakhage AA, Spröte P, Al-Abdallah Q, Gehrke A, Plattner H, Tüncher A. Regulation of Penicillin Biosynthesis in Filamentous Fungi, Molecular Biotechnology of Fungal beta-Lactam Antibiotics and Related Peptide Synthetases, Advances in Biochemical Engineering/Biotechnology, 45–90. o.. DOI: 10.1007/b99257 (2004). ISBN 978-3-540-22032-9
- ↑ Pan A, Lorenzotti S, Zoncada A (2008. január 1.). „Registered and investigational drugs for the treatment of methicillin-resistant Staphylococcus aureus infection”. Recent Patents on Anti-Infective Drug Discovery 3 (1), 10–33. o. DOI:10.2174/157489108783413173. PMID 18221183.
- ↑ Fajardo A, Martínez JL (2008. április 1.). „Antibiotics as signals that trigger specific bacterial responses”. Current Opinion in Microbiology 11 (2), 161–7. o. DOI:10.1016/j.mib.2008.02.006. PMID 18373943.
- ↑ Loo DS (2006). „Systemic antifungal agents: an update of established and new therapies”. Advances in Dermatology 22, 101–24. o. DOI:10.1016/j.yadr.2006.07.001. PMID 17249298.
- ↑ Manzoni M, Rollini M (2002. április 1.). „Biosynthesis and biotechnological production of statins by filamentous fungi and application of these cholesterol-lowering drugs”. Applied Microbiology and Biotechnology 58 (5), 555–64. o. DOI:10.1007/s00253-002-0932-9. PMID 11956737.
- ↑ el-Mekkawy S, Meselhy MR, Nakamura N, Tezuka Y, Hattori M, Kakiuchi N, Shimotohno K, Kawahata T, Otake T (1998. november 1.). „Anti-HIV-1 and anti-HIV-1-protease substances from Ganoderma lucidum”. Phytochemistry 49 (6), 1651–7. o. DOI:10.1016/S0031-9422(98)00254-4. PMID 9862140.
- ↑ a b Hetland G, Johnson E, Lyberg T, Bernardshaw S, Tryggestad AM, Grinde B (2008. október 1.). „Effects of the medicinal mushroom Agaricus blazei Murill on immunity, infection and cancer”. Scandinavian Journal of Immunology 68 (4), 363–70. o. DOI:10.1111/j.1365-3083.2008.02156.x. PMID 18782264.
- ↑ Firenzuoli F, Gori L, Lombardo G (2008. március 1.). „The Medicinal Mushroom Agaricus blazei Murrill: Review of Literature and Pharmaco-Toxicological Problems”. Evidence-Based Complementary and Alternative Medicine 5 (1), 3–15. o. DOI:10.1093/ecam/nem007. PMID 18317543. PMC 2249742.
- ↑ Jiahui Lu, Rongjun He, Peilong Sun, et al. (2020). „Molecular mechanisms of bioactive polysaccharides from Ganoderma lucidum (Lingzhi), a review”. International Journal of Biological Macromolecules 150, 765–774. o. DOI:10.1016/j.ijbiomac.2020.02.035. PMID 32035956.
- ↑ Opeyemi Joshua Olatunji, Jian Tang, Adesola Tola, et al. (2018). „The genus Cordyceps: An extensive review of its traditional uses, phytochemistry and pharmacology”. Fitoterapia 129, 293–316. o. DOI:10.1016/j.fitote.2018.05.010. PMID 29775778.
- ↑ Kulp K. Handbook of Cereal Science and Technology. CRC Press (2000). ISBN 978-0-8247-8294-8
- ↑ Piskur J, Rozpedowska E, Polakova S, Merico A, Compagno C (2006. április 1.). „How did Saccharomyces evolve to become a good brewer?”. Trends in Genetics 22 (4), 183–6. o. DOI:10.1016/j.tig.2006.02.002. PMID 16499989.
- ↑ Abe K, Gomi K, Hasegawa F, Machida M (2006. szeptember 1.). „Impact of Aspergillus oryzae genomics on industrial production of metabolites”. Mycopathologia 162 (3), 143–53. o. DOI:10.1007/s11046-006-0049-2. PMID 16944282.
- ↑ Hachmeister KA, Fung DY (1993). „Tempeh: a mold-modified indigenous fermented food made from soybeans and/or cereal grains”. Critical Reviews in Microbiology 19 (3), 137–88. o. DOI:10.3109/10408419309113527. PMID 8267862.
- ↑ Jørgensen TR (2007. december 1.). „Identification and toxigenic potential of the industrially important fungi, Aspergillus oryzae and Aspergillus sojae”. Journal of Food Protection 70 (12), 2916–34. o. DOI:10.4315/0362-028X-70.12.2916. PMID 18095455.
- ↑ O'Donnell K, Cigelnik E, Casper HH (1998. február 1.). „Molecular phylogenetic, morphological, and mycotoxin data support reidentification of the Quorn mycoprotein fungus as Fusarium venenatum”. Fungal Genetics and Biology 23 (1), 57–67. o. DOI:10.1006/fgbi.1997.1018. PMID 9501477.
- ↑ Kinsella JE, Hwang DH (1976. november 1.). „Enzymes of Penicillium roqueforti involved in the biosynthesis of cheese flavor”. Critical Reviews in Food Science and Nutrition 8 (2), 191–228. o. DOI:10.1080/10408397609527222. PMID 21770.
- ↑ Erdogan A, Gurses M, Sert S (2003. augusztus 1.). „Isolation of moulds capable of producing mycotoxins from blue mouldy Tulum cheeses produced in Turkey”. International Journal of Food Microbiology 85 (1–2), 83–5. o. DOI:10.1016/S0168-1605(02)00485-3. PMID 12810273.
- ↑ Vetter J (1998. január 1.). „Toxins of Amanita phalloides”. Toxicon 36 (1), 13–24. o. DOI:10.1016/S0041-0101(97)00074-3. PMID 9604278.
- ↑ Leathem AM, Dorran TJ (2007. március 1.). „Poisoning due to raw Gyromitra esculenta (false morels) west of the Rockies”. Canadian Journal of Emergency Medicine 9 (2), 127–30. o. DOI:10.1017/s1481803500014937. PMID 17391587.
- ↑ Karlson-Stiber C, Persson H (2003. szeptember 1.). „Cytotoxic fungi--an overview”. Toxicon 42 (4), 339–49. o. DOI:10.1016/S0041-0101(03)00238-1. PMID 14505933.
- ↑ Michelot D, Melendez-Howell LM (2003. február 1.). „Amanita muscaria: chemistry, biology, toxicology, and ethnomycology”. Mycological Research 107 (Pt 2), 131–46. o. DOI:10.1017/S0953756203007305. PMID 12747324.
- ↑ López-Gómez J, Molina-Meyer M (2006. február 1.). „The competitive exclusion principle versus biodiversity through competitive segregation and further adaptation to spatial heterogeneities”. Theoretical Population Biology 69 (1), 94–109. o. DOI:10.1016/j.tpb.2005.08.004. PMID 16223517.
- ↑ Chandler, D., Lawrence A. Lacey. Basic and Applied Research on Entomopathogenic Fungi, Microbial Control of Insect and Mite Pests. Academic Press, 69–89. o.. DOI: 10.1016/B978-0-12-803527-6.00005-6 (2017). ISBN 978-0-12-803527-6
- ↑ Deshpande MV (1999). „Mycopesticide production by fermentation: potential and challenges”. Critical Reviews in Microbiology 25 (3), 229–43. o. DOI:10.1080/10408419991299220. PMID 10524330.
- ↑ Thomas MB, Read AF (2007. május 1.). „Can fungal biopesticides control malaria?”. Nature Reviews. Microbiology 5 (5), 377–83. o. DOI:10.1038/nrmicro1638. PMID 17426726.
- ↑ Bush LP, Wilkinson HH, Schardl CL (1997. május 1.). „Bioprotective Alkaloids of Grass-Fungal Endophyte Symbioses”. Plant Physiology 114 (1), 1–7. o. DOI:10.1104/pp.114.1.1. PMID 12223685. PMC 158272.
- ↑ Bouton JH, Latch GC, Hill NS, Hoveland CS, McCann MA, Watson RH, Parish JA, Hawkins LL, Thompson FN (2002). „Reinfection of Tall Fescue Cultivars with Non-Ergot Alkaloid–Producing Endophytes”. Agronomy Journal 94 (3), 567–574. o. [2018. július 21-i dátummal az eredetiből archiválva]. DOI:10.2134/agronj2002.5670. (Hozzáférés: 2021. április 23.)
- ↑ Parish JA, McCann MA, Watson RH, Hoveland CS, Hawkins LL, Hill NS, Bouton JH (2003. május 1.). „Use of nonergot alkaloid-producing endophytes for alleviating tall fescue toxicosis in sheep”. Journal of Animal Science 81 (5), 1316–22. o. DOI:10.2527/2003.8151316x. PMID 12772860.
- ↑ Schlegel HG. General Microbiology. Cambridge, UK: Cambridge University Press, 360. o. (1993). ISBN 978-0-521-43980-0
- ↑ Joseph B, Ramteke PW, Thomas G (2008). „Cold active microbial lipases: some hot issues and recent developments”. Biotechnology Advances 26 (5), 457–70. o. DOI:10.1016/j.biotechadv.2008.05.003. PMID 18571355.
- ↑ Kumar R, Singh S, Singh OV (2008. május 1.). „Bioconversion of lignocellulosic biomass: biochemical and molecular perspectives”. Journal of Industrial Microbiology & Biotechnology 35 (5), 377–91. o. DOI:10.1007/s10295-008-0327-8. PMID 18338189.
- ↑ Polizeli ML, Rizzatti AC, Monti R, Terenzi HF, Jorge JA, Amorim DS (2005. június 1.). „Xylanases from fungi: properties and industrial applications”. Applied Microbiology and Biotechnology 67 (5), 577–91. o. DOI:10.1007/s00253-005-1904-7. PMID 15944805.
- ↑ Olempska-Beer ZS, Merker RI, Ditto MD, DiNovi MJ (2006. július 1.). „Food-processing enzymes from recombinant microorganisms--a review”. Regulatory Toxicology and Pharmacology 45 (2), 144–158. o. DOI:10.1016/j.yrtph.2006.05.001. PMID 16769167. (Hozzáférés: 2019. július 3.)
- ↑ Christian V, Shrivastava R, Shukla D, Modi HA, Vyas BR (2005. április 1.). „Degradation of xenobiotic compounds by lignin-degrading white-rot fungi: enzymology and mechanisms involved”. Indian Journal of Experimental Biology 43 (4), 301–12. o. PMID 15875713.
- ↑ „Fungi to fight 'toxic war zones'”, BBC News, 2008. május 5.. [2017. szeptember 15-i dátummal az eredetiből archiválva] (Hozzáférés: 2008. május 12.)
- ↑ Fomina M, Charnock JM, Hillier S, Alvarez R, Gadd GM (2007. július 1.). „Fungal transformations of uranium oxides”. Environmental Microbiology 9 (7), 1696–710. o. DOI:10.1111/j.1462-2920.2007.01288.x. PMID 17564604.
- ↑ Fomina M, Charnock JM, Hillier S, Alvarez R, Livens F, Gadd GM (2008. május 1.). „Role of fungi in the biogeochemical fate of depleted uranium”. Current Biology 18 (9), R375–7. o. DOI:10.1016/j.cub.2008.03.011. PMID 18460315.
- ↑ Beadle GW, Tatum EL (1941. november 1.). „Genetic Control of Biochemical Reactions in Neurospora”. Proceedings of the National Academy of Sciences of the United States of America 27 (11), 499–506. o. DOI:10.1073/pnas.27.11.499. PMID 16588492. PMC 1078370.
- ↑ Dean RA, Talbot NJ, Ebbole DJ, Farman ML, Mitchell TK, Orbach MJ, Thon M, Kulkarni R, Xu JR, Pan H, Read ND, Lee YH, Carbone I, Brown D, Oh YY, Donofrio N, Jeong JS, Soanes DM, Djonovic S, Kolomiets E, Rehmeyer C, Li W, Harding M, Kim S, Lebrun MH, Bohnert H, Coughlan S, Butler J, Calvo S, Ma LJ, Nicol R, Purcell S, Nusbaum C, Galagan JE, Birren BW (2005. április 1.). „The genome sequence of the rice blast fungus Magnaporthe grisea”. Nature 434 (7036), 980–6. o. DOI:10.1038/nature03449. PMID 15846337.
- ↑ Daly R, Hearn MT (2005). „Expression of heterologous proteins in Pichia pastoris: a useful experimental tool in protein engineering and production”. Journal of Molecular Recognition 18 (2), 119–38. o. DOI:10.1002/jmr.687. PMID 15565717.
Irodalom
[szerkesztés]- Ainsworth GC. Introduction to the History of Mycology. Cambridge, UK: Cambridge University Press (1976). ISBN 978-0-521-11295-6
- Alexopoulos CJ, Mims CW, Blackwell M. Introductory Mycology. John Wiley and Sons (1996). ISBN 978-0-471-52229-4
- Chandler PJ. A Dipterist's Handbook, 2nd, The Amateur Entomologists' Society, 1–525. o. (2010)
- Deacon J. Fungal Biology. Cambridge, Massachusetts: Blackwell Publishers (2005). ISBN 978-1-4051-3066-0
- Hall IR. Edible and Poisonous Mushrooms of the World. Portland, Oregon: Timber Press (2003). ISBN 978-0-88192-586-9
- Hanson JR. The Chemistry of Fungi. Royal Society Of Chemistry (2008). ISBN 978-0-85404-136-7
- Jennings DH, Lysek G. Fungal Biology: Understanding the Fungal Lifestyle. Guildford, UK: Bios Scientific Publishers Ltd (1996). ISBN 978-1-85996-150-6
- Kirk PM, Cannon PF, Minter DW, Stalpers JA. Dictionary of the Fungi, 10th, Wallingford, UK: CAB International (2008). ISBN 978-0-85199-826-8
- Taylor EL, Taylor TN. The Biology and Evolution of Fossil Plants. Englewood Cliffs, New Jersey: Prentice Hall (1993). ISBN 978-0-13-651589-0
Fordítás
[szerkesztés]- Ez a szócikk részben vagy egészben a Fungus című angol Wikipédia-szócikk ezen változatának fordításán alapul. Az eredeti cikk szerkesztőit annak laptörténete sorolja fel. Ez a jelzés csupán a megfogalmazás eredetét és a szerzői jogokat jelzi, nem szolgál a cikkben szereplő információk forrásmegjelöléseként.


