Citromsav
| Ez a szócikk részben vagy egészben a Pallas nagy lexikonából való, ezért szövege és/vagy tartalma elavult lehet.
Segíts nekünk korszerű szócikké alakításában, majd távolítsd el ezt a sablont! |
| Citromsav | |||
| |||

| |||
| IUPAC-név | 2-hidroxipropán-1,2,3-trikarbonsav | ||
| Más nevek | hidrogén-citrát | ||
| Kémiai azonosítók | |||
|---|---|---|---|
| CAS-szám | 77-92-9 | ||
| ATC kód | A09AB04 | ||
| Gyógyszer szabadnév | citric acid | ||
| Gyógyszerkönyvi név | Acidum citricum anhydricum, Acidum citricum monohydricum | ||
| |||
| Kémiai és fizikai tulajdonságok | |||
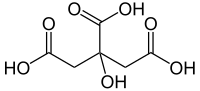
| Kémiai képlet | C6H8O7 | ||
| Moláris tömeg | 192,027 g/mol | ||
| Megjelenés | fehér kristályok | ||
| Sűrűség | 1,665 g/cm³ | ||
| Olvadáspont | 153 °C | ||
| Forráspont | 175 °C-on bomlik | ||
| Oldhatóság (vízben) | 133 g/100 ml (20 °C) | ||
| Savasság (pKa) | pKa1=3,15 pKa2=4,77 pKa3=6,40 | ||
| Veszélyek | |||
| EU osztályozás | Irritatív (Xi)[1] | ||
| NFPA 704 | |||
| R mondatok | R41[1] | ||
| S mondatok | S26, S39[1] | ||
| LD50 | 3000 mg/kg (patkány, szájon át)[1] | ||
| Ha másként nem jelöljük, az adatok az anyag standardállapotára (100 kPa) és 25 °C-os hőmérsékletre vonatkoznak. | |||
Ezt az alifás trikarbonsavat kristályos állapotban Carl Wilhelm Scheele állította először elő 1784-ben, azonban a borkősavtól már 1776-ban Anders Jahan Retzius megkülönböztette. A citromsav szabad állapotban vagy kálium-, illetőleg kalciumsó alakjában számos savanyú gyümölcsben előfordul, többnyire kevés borkősav és almasav társaságában. Szabad citromsav van a ribiszkében, vörösberkenyében, cseresznyében, málnában, szamócában, szederben, tamarindában; különösen a citrom különféle fajtái bővelkednek benne. Kálium és kalcium sóját számos növény levelében, kérgében és gyökerében találták. Ipari mértékben magas szénhidráttartalmú alapanyagokból (pl. kukorica) állítják elő, melyet savtermelő fonalas penészgombafajokkal (pl. Aspergillus niger) fermentálnak bioreaktorokban.
Sói a citrátok. Könnyen átalakul izocitromsavvá, melynek molekulájában a hidroxilcsoport az 1-es szénatomra kapcsolódik. Mind a citromsav, mind az izocitromsav a sejtlégzés folyamatának igen fontos közbenső terméke. Kis mennyiségben a must alkotórésze, innen kerül a borokba. Baktériumok megtámadhatják és teljesen elbonthatják, főleg ecetsavra. A borokban kevés citromsav van; 0-0,5 g/l.[2]

A citromsav (oxi-trikarbalilsav) hárombázisú szerves sav. Képlete: C3H4(OH)(COOH)3 vagy C6H8O7.
Előállítása
[szerkesztés]A citrom 6-7% szabad citromsavat tartalmaz, ezért általában csak citromlé előállítására használják. A citrom levét termelési helyén (Olaszország, Szicília, Spanyolország) nemigen dolgozzák fel, hanem besűrített állapotban bocsátják kereskedésbe; a citromsavat belőle Németországban, Angliában és Franciaországban készítik. A citromlevet előbb tojásfehérjével derítik, azután kalcium-karbonáttal és kalcium-hidroxiddal telítik. A forraláskor a különben hideg vízben oldható kalcium-citrát dús fehér csapadék alakjában leválik. A csapadékot még azon forrón a folyadéktól elválasztják, forró vízzel kimossák és centrifugákban megszikkasztják. Az így kapott kalcium-citrátot azután alkalmas keverőgépekben, amelyek ólommal vannak bevonva, híg kénsavval melegen elbontják. Az oldhatatlan kalcium-szulfátról leszűrt citromsavoldatot eleinte szabad tűzön, utóbb vákuumkészülékekben erősen besűrítik és a kikristályosodó, még szennyezett citromsavat vízből újból átkristályosítva megtisztítják. A citromsavat szintézissel is előállították, úgyhogy szerkezeti képlete biztonsággal ismeretes. A citromsav vízből kristályosítva színtelen, átlátszó rombuszos prizmákból áll, melyek sűrűsége 1,617 g/cm3 és 1 mol kristályvizet tartalmaznak.
Jellemzői
[szerkesztés]Kellemes, citromra emlékeztető illata van. 100 °C alatt kristályvizéből veszít, 100 °C-on teljesen vízmentessé válik. A kristályvizes citromsav 100 °C-on megolvad, a kristályvízmentes 155 °C körül. 100 g vízben 20 °C-on 133 g oldódik; oldata kellemes savanyú ízű és savas kémhatású. Etanolban is igen könnyen oldódik (111 g 100 g etanolban), dietil-éterben kevéssé. Hevítéskor bomlik: 170 °C-ra felhevítve, vízvesztés folytán akonitsav keletkezik; még magasabb hőmérsékleten szén-dioxid távozik, itakonsav, citrakonsav és ezek anhidridjei keletkeznek. Tömény kénsavban hidegen oldva színtelen, de felmelegítéskor az oldat megbarnul. Salétromsav melegen oldja, ilyenkor oxálsav (sóskasav) és ecetsav keletkezik. Vizes oldata könnyen megpenészedik. Reakciói: ólom-acetát-oldattól fehér csapadék (ólom-citrát [Pb3(C6H5O7)2·H2O]) keletkezik, mely ammóniában és alkálifém-citrátokban könnyen feloldódik. A citromsav vizes oldata kalcium-hidroxiddal túltelítve átlátszó marad, mert a képződő kalcium-citrát hideg vízben oldódik, de a folyadékot felforralva fehér csapadék keletkezik, mely hosszabb ideig tartó forralás után kristályossá válik. E csapadék a forró vízben nehezen oldható kalcium-citrát [Ca3(C6H5O7)2·24H2O]. Hirtelen felhevítve megszenesedés közben szúrós szagot terjeszt, amely azonban a borkősav égetett cukorhoz hasonló szagától feltűnően különbözik. A fémek közül az alumíniumot és a vasat is megtámadja.
A citrátok családja
[szerkesztés]A citrátok igen különbözőek lehetnek, például a nátrium-citrát egy citrátsó, míg a trimetil-citrát egy észter. Elsősorban alkálifémekkel (lítium, nátrium, kálium) alkáliföldfémekkel (magnézium, kalcium) alkot vegyületeket, de léteznek például a koffeinnel, valamint egyes esetekben átmenetifémekkel (ammónium-vas-citrát) alkotott vegyületei is. Sőt, léteznek „vegyes” citrátok is (észter és só együtt), pl. nátrium-dimetil-citrát.
Más citrátionok
[szerkesztés]Mivel a citromsav három protont képes leadni, léteznek ún. köztes ionok, amikor csak egyszeres (dihidrogén-citrát (H2C6H5O−7), vagy kétszeres (hidrogén-citrát (HC6H5O2−7) negatív töltésű ion keletkezik. Ezek ugyanazokkal az anyagokkal alkothatnak vegyületet, mint a háromszoros negatív töltésű citrát.
Sói
[szerkesztés]A citromsav hárombázisú sav, így tehát háromféle sója, két savanyú és egy bázisos lehetséges.
Egyes fémek (Cu, Pb) még a hidroxilcsoport (OH) hidrogénjét is helyettesíthetik, de az így keletkező vegyületek nem valódi sók, hanem részben alkoholátok is. Az alkálifémek citrátjai vízben igen könnyen oldódnak és más citrátokkal kettős sókat képeznek. Különösen az ammónium-citrát a kalcium- és vas-foszfátot könnyen oldja, a szuperfoszfátok és a Thomas-salak foszforsav-tartalmának meghatározásakor használják (citrát módszer).
A magnézium-citrát Mg3(C6H5O7)2·14H2O fehér kristályos por, mely vízben igen könnyen oldódik. Vizes oldata nem kellemetlen ízű és mégis olyan hatásos hashajtó szer, mint a keserűsó (magnézium-szulfát). A hashajtó limonádé hatóanyaga.
A vas(III)-citrát (FeC6H5O7·6H2O) vörösbarna amorf lemezkékből áll, vízben oldható. Gyógyszerül használják olyan esetekben, amikor vaskészítmények szedése javallott, akárcsak kettős sóit, így a ferriammónium-citrátot és a ferripirofoszfát-ammóniumcitrátot.
Élelmiszeripari felhasználása
[szerkesztés]Élelmiszerekben elsősorban antioxidánsként (bár önállóan nincs ilyen hatása, elősegíti a többi antioxidáns hatását), savanyúságot szabályozó anyagként, valamint ízesítőszerként alkalmazzák E330 néven. Gyümölcsételek esetén késlelteti a gyümölcsök oxigén hatására történő elszíneződését. Napi maximum beviteli mennyisége nincs korlátozva.[3]
A hiedelemmel ellentétben semmiféle rákkeltő hatása sincs. A szervezetben természetes formában előfordul, ráadásul a DNS-hez közel, nagy koncentrációban található, így ha rákkeltő hatása lenne, szinte az összes sejtünk ráksejtté alakulna. Mi több, ez az egyik legveszélytelenebb élelmiszeripari adalékanyag. Egyszerre akár 100 gramm is elfogyasztható belőle, bár az íze ilyen mennyiségben nem túl kellemes. A félreértés valószínűleg onnan ered, hogy fő eleme és névadója a citromsavciklusnak, amit más néven Krebs-ciklusnak (Hans Adolf Krebs fedezte fel az 1930-as években) is szoktak nevezni. Szerencsétlen módon a rák neve németül Krebs, vagyis egy téves fordítás során Szentgyörgyi–Krebs-ciklus = rák-ciklus. Ebből következtetve a fordító (hibásan) rákkeltő hatást tulajdonított a citromsavnak.[4]
Háztartási felhasználása
[szerkesztés]A citromsav kiválóan alkalmas háztartási készülékek (kávé- és teafőzők, egyéb kisgépek) vízkőmentesítésére. Nem mérgező, könnyen leöblíthető, és élelmiszerboltban vagy gyógyszertárban az előbbiek árának töredékéért beszerezhető. A hasonló célra használt ecetnél is alkalmasabb, mert az utóbbi íze és szaga hosszabb ideig megmarad a kitisztított készülékekben.
A citromsav az egyik sokoldalúan felhasználható természetes sav. Alkalmazható vízlágyítóként, de természetes tisztítószerként is. Koszos foltok, zsíros szennyeződések ellen is hatásosan lehet alkalmazni. Szőnyeg- és kárpittisztításra is alkalmazható otthon vagy az autóban. Gyakori adalékanyaga az élelmiszereknek és üdítőitaloknak, ami nem csak tartósít, de ízesít is. Az otthon készített gyurmák és fürdőgolyók alkotóeleme. A kozmetikumok (sampon, tusfürdő, arctisztító, szappan) is tartalmaznak kisebb-nagyobb mennyiségben citromsavat.[5]
Gyártása
[szerkesztés]A világon évente mintegy 2 millió tonna citromsavat termelnek, ezen belül 1,05 millió tonna származik Kínából. Magyarországon 2014. szeptember 9-én tették le a Szolnokon épülő citromsavgyár alapjait, azonban az építések máig nem kezdődtek el. Ebben a gyárban 60 ezer tonna terméket kívánnak előállítani. A Kazincbarcikán tervezett gyárban 100 ezer tonna citromsav előállítását tervezik. Az üzemek elkészülte esetén a világtermelés 8%-a származik majd Magyarországról.[6]
Kapcsolódó szócikkek
[szerkesztés]Jegyzetek
[szerkesztés]- ↑ a b c d A citromsav vegyülethez tartozó bejegyzés az IFA GESTIS adatbázisából. A hozzáférés dátuma: 2011. 01. 14. (JavaScript szükséges) (angolul)
- ↑ Citromsav - Kertészeti lexikon. https://www.tuja.hu
- ↑ Food-Info.net: E-numbers: E330 Citric acid
- ↑ Food-Info.net: Is citric acid (E330) carcinogenic?
- ↑ Sabján: A sokoldalúan felhasználható citromsav (magyar nyelven). Egészség Könyvtár. (Hozzáférés: 2021. január 6.)
- ↑ Citromsavgyár épül Szolnokon
További információk
[szerkesztés]


