Ólom(II)-klorid
| Ólom(II)-klorid | |||
 Ólom(II)-klorid csapadék | |||
| |||
| IUPAC-név | Ólom(II)-klorid | ||
| Más nevek | Cotunnit Ólom-diklorid | ||
| Kémiai azonosítók | |||
|---|---|---|---|
| CAS-szám | 7758-95-4 | ||
| PubChem | 166945 | ||
| ChemSpider | 22867 | ||
| ChEBI | 88212 | ||
| |||
| InChIKey | HWSZZLVAJGOAAY-UHFFFAOYSA-L | ||
| Kémiai és fizikai tulajdonságok | |||
| Kémiai képlet | PbCl2 | ||
| Moláris tömeg | 278.10 g/mol | ||
| Megjelenés | fehér, szagtalan, szilárd | ||
| Sűrűség | 5.85 g/cm³ | ||
| Olvadáspont | 501 °C | ||
| Forráspont | 950 °C | ||
| Oldhatóság (vízben) | 10.8 g/L (20 °C)[1] | ||
| Oldhatóság | némileg oldódik híg sósavban, ammoniában; oldhatatlan alkoholokban | ||
| Törésmutató (nD) | 2.199[2] | ||
| Kristályszerkezet | |||
| Kristályszerkezet | Ortorombos | ||
| Tércsoport | Pnma, No. 62 | ||
| Termokémia | |||
| Std. képződési entalpia ΔfH |
-359.41 kJ/mol | ||
| Standard moláris entrópia S |
135.98 J K−1 mol−1 | ||
| Veszélyek | |||
| EU osztályozás | |||
| NFPA 704 | |||
| R mondatok | R61, R20/22, R33, R62, R50/53 | ||
| S mondatok | S53, S45, S60, S61 | ||
| Rokon vegyületek | |||
| Azonos kation | Ólom(II)-fluorid Ólom(II)-bromid Ólom(II)-jodid | ||
| Azonos anion | Ólom(IV)-klorid Ón(II)-klorid | ||
| Ha másként nem jelöljük, az adatok az anyag standardállapotára (100 kPa) és 25 °C-os hőmérsékletre vonatkoznak. | |||
Az ólom(II)-klorid vagy ólom-diklorid a kétféle ólom-klorid azon egyike, amelyben az ólom oxidációs száma +2, képlete PbCl2. Szervetlen vegyület, normál körülmények közt fehér színű kristályos por. Hideg vízben rosszul oldódik, forró vízben azonban könnyen feloldható, lehűlés után apró, tű alakú kristályok formájában válik ki az oldatból. Az ólom(II)-klorid az egyik legfontosabb ólomalapú vegyszer. Természetben előforduló ásványának neve cotunnit.
Szerkezete és tulajdonságai
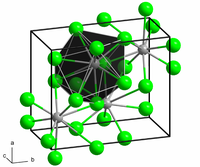
[szerkesztés]A szilárd ólom-klorid kristályrácsában minden egyes ólomionhoz 9 kloridion kapcsolódik – 6 a trigonális prizma minden csúcsán, és 3 a prizma oldalainak középpontjában. A 9 kloridion nem egyenlő távolságra van az ólomtól, 7 db 280–309 pm távolságra van tőle, 2 db pedig 370 pm-re.[3] A PbCl2 fehér, ortorombos tűkristályokat alkot. Sok természetes vízben bőségesen megtalálható, holott az emberi szervezetre nagyon káros hatást gyakorol, így muszáj kiszűrni az ivóvízből.
Gázfázisban az ólom-klorid molekula hajlított szerkezetű, a Cl–Pb–Cl kötésszög 98°-os, a Pb–Cl távolság pedig 2,44 Å.[4] Efféle PbCl2-t bocsátanak ki az olyan belsőégésű motorok, melyek üzemanyagába kopogásgátlóként tetraetil-ólmot és 1,2-diklóretánt adtak. Ma már környezetkárosító hatása miatt nem használnak ólmozott üzemanyagot, helyette ferrocént adnak a benzinhez.
Az ólom(II)-klorid oldhatósága vízben igen alacsony (20 °C-on 1,08 g/100 cm³ víz), tehát gyakorlatilag oldhatatlan. Oldhatósági szorzata (Ksp) 5,89·10−5. Egyike a négy vízben oldhatatlan kloridsónak – a másik három az ezüst-klorid (Ksp = 1,8·10−10), a réz(I)-klorid (Ksp = 1,72·10−7) és a higany(I)-klorid (Ksp = 1,3·10−18).[5][6]
Előfordulása
[szerkesztés]
A természetben a cotunnit nevű ásvány formájában van jelen. Szennyeződésektől függően lehet színtelen, fehér, sárga vagy zöld, sűrűsége pedig 5,3 és 5,8 g/cm³ között változó. Mohs-skálán mért keménysége 1,5-2. Kristályszerkezete ortorombos dipiramisos, az ólomionok koordinációs száma 9. A cotunnit főleg vulkánok közelében fordul elő nagyobb mennyiségben: Vezúv, Olaszország; Taapaca, Chile; Tolbacsik, Oroszország.[7]
Előállítása
[szerkesztés]Az ólom(II)-klorid csapadék formájában leválasztható, ha valamelyik vízoldékony ólomsó (ólom-nitrát, ólom-acetát) oldatába kloridionokat juttatunk (HCl, NaCl, KCl):
Vízben nem oldódó ólomsók közül az alkot sósavval ólom(II)-kloridot, amely savmaradékionja a sósavnál gyengébb savból származik (például bázisos ólom-karbonát, ólom(II)-hidroxid, ólom(II)-szulfid):[8]
Ólom(IV)-oxid és sósav reakciójában az ólom(II)-klorid mellett klórgáz szabadul fel:
Ha ugyanezt ólom(II)-oxiddal végezzük, a reakció mellékterméke csak víz lesz.
Ha fémólomra klórgázt vezetünk, szintén ólom(II)-klorid keletkezik.
Reakciói
[szerkesztés]A vizes ólom(II)-klorid szuszpenzióhoz további kloridionokat adva a csapadék komplex formájában feloldódik. Ekkor a további kloridionok (vagy egyéb ligandumok) felszakítják a polimeres szerkezet vázát adó kloridhidakat, így az anyag fel tud oldódni a vízben.
Olvadt nátrium-nitrithez adva, vízmentes közegben ólom(II)-oxiddá alakul, mellette nátrium-nitrát, nátrium-klorid és nitrogén-monoxid gáz keletkezik.
Ólom(IV)-klorid előállítására is használják. Telített ólom(II)-klorid oldathoz ammónium-kloridot adnak, majd klórgázt vezetnek bele, így [NH4]2[PbCl6] keletkezik. Ezt később hideg, tömény kénsavval reagáltatják, így egy olajszerű folyadék, ólom-tetraklorid válik le.
Az ólom(II)-klorid az ólomtartalmú fémorganikus vegyületek – például a plumbocének – szintézisének fő kiindulási anyaga.[9] Ehhez általános alkilezőszereket – például Grignard-reagenseket vagy lítiumorganikus vegyületeket – használnak.
A reakciók végtermékeként keletkező ólomvegyületek a szilíciumorganikus vegyületekéhez hasonló tulajdonságokat mutatnak, azaz a Pb2+ ionok az alkilezés során diszproporcióra hajlamosak.
Az ólom(II)-kloridból nátrium-hipokloritos kezeléssel ólom-dioxid állítható elő, mely vörösesbarna csapadék formájában válik ki.
Felhasználása
[szerkesztés]- Az olvadt ólom(II)-kloridot kationcserével ólom-titanát (PbTiO3) vagy bárium-ólom-titanát előállításánál használják, amelyet kerámiákban alkalmaznak, mint adalékanyagot.[10]
- Infravörös sugárzást átengedő, díszítésre is használt ún. ólomüvegek készítésénél is használják.[8] Az ólomüveg felülete attól olyan fényes, mert lefújják ólom(II)-kloriddal, majd irányított körülmények közt újra felmelegítik. Ugyanerre a célra ón(II)-klorid is megfelel.[11]
- A sósavat ólomból készült tartályokban szállítják, de mivel az ólom(II)-klorid oldódik sósavban, 6-25% antimonnal ötvözik, hogy ellenállóbb legyen.[12]
- A bázisos ólom-klorid, más néven Pattinson-féle ólomfehér (PbCl2·Pb(OH)2) egy pigment, amelyből fehér festéket készítettek, azonban mérgező voltukból adódóan az ólomtartalmú festékeket már a legtöbb országban betiltották.[13]
- Az ólom(II)-klorid a bizmutércek finomításának egyik köztiterméke. Az érc fő komponense a bizmut, az ólom és a cink. Ezt először nátronlúggal kezelik, hogy a savasabb jellegű fémeket kivonják, például az arzént és a tellúrt. Ezt követi a Parkes-féle ezüstmentesítési folyamat, hogy minden arany- és ezüsttartalmat eltávolítsanak belőle. Az érc most kizárólag bizmutot, ólmot és cinket tartalmaz, ekkor 500 °C-ra hevítik a keveréket és klórgázt vezetnek rá. Először a cink reagál, majd az ólom, és ha ezeket a fémkloridokat is eltávolítják, tiszta bizmut marad vissza,[14] mivel ez reagálna a klórral utoljára.
Mérgezés
[szerkesztés]A többi ólomvegyülethez hasonlóan, az ólom(II)-klorid is erősen mérgező, neurotoxikus hatású. Lenyelése ólommérgezéshez vezet. Az akut mérgezés tünetei a fizikai fájdalom, gyengeség, érzéktelenség, ritkább esetben agyvelőgyulladás. Egyéb közönséges jelei lehetnek még a fejfájás, hányinger, hányás, hasmenés, étvágytalanság és a fémes íz érzése a szájban. Hemolitikus (vörösvérsejt-pusztító) hatása következtében vérszegénység és véres vizelet is felléphet, ezenkívül a vesére gyakorolt káros hatása miatt a vizelet mennyisége is csökkenhet. Krónikus mérgezésre utalhatnak a neuromuszkuláris zavarok, idegbénulás, izomgörcs, rövidtávú memóriavesztés és koncentrációzavar, hányinger, hasi fájdalom, a tájékozódóképesség romlása, zsibbadás, alvászavar, fáradtság, érthetetlen beszéd és vérszegénység, anémia.
Fordítás
[szerkesztés]Ez a szócikk részben vagy egészben a Lead(II) chloride című angol Wikipédia-szócikk ezen változatának fordításán alapul. Az eredeti cikk szerkesztőit annak laptörténete sorolja fel. Ez a jelzés csupán a megfogalmazás eredetét és a szerzői jogokat jelzi, nem szolgál a cikkben szereplő információk forrásmegjelöléseként.
Források
[szerkesztés]- ↑ NIST-data review 1980
- ↑ Pradyot Patnaik. Handbook of Inorganic Chemicals. McGraw-Hill, 2002, ISBN 0-07-049439-8
- ↑ Wells A. F. (1984) Structural Inorganic Chemistry 5th edition Oxford Science Publications ISBN 0-19-855370-6
- ↑ (1977) „Two independent gas electron diffraction investigations of the structure of plumbous chloride”. Journal of Molecular Structure 42, 147. o. DOI:10.1016/0022-2860(77)87038-5.
- ↑ CRC Handbook of Chemistry and Physics, 79th Edition, David R. Lide (Ed), p. 8-108
- ↑ Brown, Lemay, Burnsten. Chemistry The Central Science. "Solubility-Product Constants for Compounds at 25 °C". (ed 6, 1994). p. 1017
- ↑ Cotunnite
- ↑ a b Dictionary of Inorganic and Organometallic Compounds. Lead(II) Chloride. [1]
- ↑ (1994) „Decasubstituted decaphenylmetallocenes”. J. Organomet. Chem. 476, 25. o. DOI:10.1016/0022-328X(94)84136-5.
- ↑ (1998) „Molten salt synthesis of the lead titanate PbTiO3, investigation of the reactivity of various titanium and lead salts with molten alkali-metal nitrites”. Journal of Materials Chemistry 8 (7), 1601. o. DOI:10.1039/a800003d.
- ↑ Stained Glass Terms and Definitions. aurene glass
- ↑ Kirk-Othmer. Encyclopedia of Chemical Technology. (ed 4). p 913
- ↑ Perry & Phillips. Handbook of Inorganic Compounds. (1995). p 213
- ↑ Kirk-Othmer. Encyclopedia of Chemical Technology. (ed 4). p. 241










![{\displaystyle \mathrm {PbCl_{2}+Cl^{-}\rightarrow [PbCl_{3}]^{-}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/4fb4f9e6f4c6bdfe10f05662a16eba95053d4226)
![{\displaystyle \mathrm {PbCl_{2}+2\ Cl^{-}\rightarrow [PbCl_{4}]^{2-}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/bd789be5de4968c50ccb75d0c6a5d251621e690a)

![{\displaystyle \mathrm {PbCl_{2}+2\ NH_{4}Cl+Cl_{2}\rightarrow [NH_{4}]_{2}[PbCl_{6}]} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/cef7afd9fb88d89ffac6063388ffd293096fbf89)
![{\displaystyle \mathrm {[NH_{4}]_{2}[PbCl_{6}]+H_{2}SO_{4}\rightarrow PbCl_{4}+(NH_{4})_{2}SO_{4}+2\ HCl} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/2dc39b03fb3b508edb3524e24e2f8aa02401029d)


