Réz(II)-acetát
| réz(II)-acetát | |||
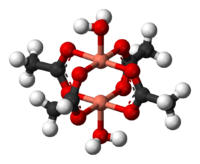 réz(II)-acetát 3D modellje | |||

| |||
| IUPAC-név | Tetra-μ2-acetátodiakvadiréz(II) | ||
| Más nevek | réz(II)-etanoát réz-acetát | ||
| Kémiai azonosítók | |||
|---|---|---|---|
| CAS-szám | 142-71-2 | ||
| PubChem | 8895 | ||
| ChemSpider | 8555 | ||
| |||
| |||
| InChIKey | OPQARKPSCNTWTJ-UHFFFAOYSA-L | ||
| UNII | 39M11XPH03 | ||
| Kémiai és fizikai tulajdonságok | |||
| Kémiai képlet | Cu(CH3COO)2 | ||
| Moláris tömeg | 181,63 g/mol (anhidrát) 199,65 g/mol (hidrát) | ||
| Megjelenés | szilárd, sötétzöld kristályok | ||
| Szag | szagtalan (hidrát) | ||
| Sűrűség | 1,882 g/cm³ (hidrát) | ||
| Olvadáspont | meghatározatlan (135 a kínai Wikipédia szerint)[1] | ||
| Forráspont | 240 °C | ||
| Oldhatóság (vízben) | hidrát: 7,2 g/100 mL (hideg vízben) 20 g/100 mL (meleg vízben) | ||
| Oldhatóság | oldható alkoholban enyhén oldható éterben és glicerinben | ||
| Törésmutató (nD) | 1,545 (hidrát) | ||
| Kristályszerkezet | |||
| Kristályszerkezet | monoklin | ||
| Veszélyek | |||
| NFPA 704 | |||
| R mondatok | 22-36/37/38-50/53 | ||
| S mondatok | 26-60-61 | ||
| Lobbanáspont | nem gyúlékony | ||
| PEL | TWA 1 mg/m³ (Cu)[3] | ||
| LD50 | 710 mg/kg; patkány, szájon át[2] | ||
| Rokon vegyületek | |||
| Rokon vegyületek | ródium(II)-acetát króm(II)-acetát | ||
| Ha másként nem jelöljük, az adatok az anyag standardállapotára (100 kPa) és 25 °C-os hőmérsékletre vonatkoznak. | |||
A réz(II)-acetát a Cu(CH3COO)2 kémiai képlettel rendelkező vegyület. A hidratált változata, amely Cu atomonként tartalmaz egy vízmolekulát, kereskedelmi forgalomban van. Az anhidrát Cu(CH3COO)2 sötétzöld kristály, míg a Cu2(CH3COO)4·(H2O)2 inkább kékeszöld színű. Már az ókor óta használtak réz-acetátokat gombaölőszerként, valamint pigmentekhez. Manapság réz(II)-acetátokat számos szervetlen és szerves vegyületek szintetizálásához alkalmazzák reagensként.[4] Sok más rézvegyülethez hasonlóan a réz-acetát is kékeszöldre festi a lángot. A hoganit ásvány a réz(II)-acetát természetben is előforduló alakja.
Felépítése
[szerkesztés]A réz-acetát hidrát alakja a ródium(II)- és króm(II)-acetát rokonvegyületeihez hasonló felépítéssel rendelkezik.[5] Az acetátcsoportok egy-egy oxigénatomja 1,97 Å (197 pm) hosszú kötéssel kapcsolódik egy Cu atomhoz. A koordinációs szférát két víz ligandum egészíti ki, ahol a Cu−O távolság 2,20 Å (220 pm). A két, 5-ös koordinációs számmal rendelkező rézatom között csupán 2,62 Å (262 pm) van, amely közelíti az elemi rézre jellemző Cu–Cu távolságot.[6] A két réz központ úgy lép kölcsönhatásba egymással, hogy jelentősen csökken a mágneses momentum olyannyira, hogy 90 K körül a Cu2(CH3COO)4·(H2O)2 alapvetően diamágneses az ellentétes spinek kioltása miatt. A Cu2(CH3COO)4·(H2O)2 jelentős volt az antiferromágneses párosítás modern elméleteinek kidolgozásában.[7]

Előállítása
[szerkesztés]A réz(II)-acetátot iparilag réz(II)-hidroxid vagy réz(II)-karbonát ecetsavban való hevítésével állítják elő.
Rokonvegyületei
[szerkesztés]Vízmentes réz(II)-acetát és rézfém keverékét hevítve réz(I)-acetátot kapunk:[8][9]
- Cu + Cu(OAc)2 → 2 CuOAc
A réz(II) vegyülettel ellentétben a réz(I)-acetát színtelen és diamágneses.
Alkalmazása kémiai szintézisben
[szerkesztés]A réz(II)-acetát oxidálószerként alkalmazható néhány szerves szintézisben. Az Eglinton-reakcióban a Cu(CH3COO)2 molekulát terminális alkinek összekapcsolására használják, melynek révén 1,3-diint kapunk:[10][11]
- Cu2(OAc)4 + 2 RC≡CH → 2 CuOAc + RC≡C−C≡CR + 2 HOAc
Alkalmazható akrilnitril hidroaminálásához.[12]
Oxidálószerként alkalmazzák a Barfoed-tesztben is.
Arzén-trioxiddal réz-arzenitet képez, mely erős rovarölő- és gombaölőszer, pigmentként schweinfurti zöldnek vagy párizsi zöldnek is nevezik.
Jegyzetek
[szerkesztés]- ↑ Trimble, R. F. (1976. június 1.). „Copper(II) acetate monohydrate - An erroneous melting point” (angol nyelven). Journal of Chemical Education 53 (6), 397. o. DOI:10.1021/ed053p397. ISSN 0021-9584.
- ↑ Wayback Machine. web.archive.org, 2011. szeptember 28. [2011. szeptember 28-i dátummal az eredetiből archiválva]. (Hozzáférés: 2019. december 19.)
- ↑ CDC: Template Package 4 (amerikai angol nyelven). Centers for Disease Control and Prevention, 2018. március 28. (Hozzáférés: 2019. december 19.)
- ↑ H. Wayne Richardson: Copper Compounds. 2000–06–15. a07_567. o. ISBN 978-3-527-30673-2 Hozzáférés: 2019. december 19. [halott link]
- ↑ Van Niekerk, J. N. (1953. január 1.). „X-Ray Evidence for Metal-to-Metal Bonds in Cupric and Chromous Acetate” (angol nyelven). Nature 171 (4340), 36–37. o. DOI:10.1038/171036a0. ISSN 0028-0836.
- ↑ Janet Catterick – Peter Thornton: Structures and Physical Properties of Polynuclear Carboxylates. 1977. 291–362. o. ISBN 978-0-12-023620-6 arch Hozzáférés: 2019. december 19.
- ↑ Carlin, Richard L: Magnetochemistry. 1986. ISBN 978-3-642-70733-9 Hozzáférés: 2019. december 19.
- ↑ S. J. Kirchner – Quintus Fernando – Dana Darby: Copper(I) Acetate. 2007–01–05. 53–55. o. ISBN 978-0-470-13251-7 Hozzáférés: 2019. december 19. [halott link]
- ↑ Edward J. Parish – Stephen A. Kizito: Copper(I) Acetate. 2001–04–15. rc193. o. ISBN 978-0-471-93623-7 Hozzáférés: 2019. december 19. [halott link]
- ↑ (1974. január 23.) „[18ANNULENE]”. Organic Syntheses 54, 1. o. [2019. december 19-i dátummal az eredetiből archiválva]. DOI:10.15227/orgsyn.054.0001. (Hozzáférés: 2019. december 19.)
- ↑ (1965. január 23.) „DIPHENYLDIACETYLENE”. Organic Syntheses 45, 39. o. [2019. december 19-i dátummal az eredetiből archiválva]. DOI:10.15227/orgsyn.045.0039. (Hozzáférés: 2019. december 19.)
- ↑ „3-(o-Chloroanilino)propionitrile”. Org. Synth. 38, 14. o. DOI:10.15227/orgsyn.038.0014.; Coll. Vol. 4: 146
Fordítás
[szerkesztés]Ez a szócikk részben vagy egészben a Copper(II) acetate című angol Wikipédia-szócikk ezen változatának fordításán alapul. Az eredeti cikk szerkesztőit annak laptörténete sorolja fel. Ez a jelzés csupán a megfogalmazás eredetét és a szerzői jogokat jelzi, nem szolgál a cikkben szereplő információk forrásmegjelöléseként.

