Nitrozobenzol
| Nitrozobenzol | |||
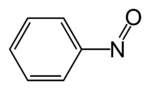 szerkezeti képlet | |||
 pálcikamodell | |||
| IUPAC-név | nitrozobenzol | ||
| Kémiai azonosítók | |||
|---|---|---|---|
| CAS-szám | 586-96-9 | ||
| PubChem | 11473 | ||
| ChemSpider | 10989 | ||
| KEGG | C06876 | ||
| ChEBI | 27986 | ||
| RTECS szám | DA6497525 | ||
| |||
| |||
| InChIKey | NLRKCXQQSUWLCH-UHFFFAOYSA-N | ||
| ChEMBL | 98797 | ||
| Kémiai és fizikai tulajdonságok | |||
| Kémiai képlet | C6H5NO | ||
| Moláris tömeg | 107,11 g/mol | ||
| Megjelenés | színtelen, szilárd | ||
| Olvadáspont | 65–69 °C | ||
| Forráspont | 59 °C | ||
| Oldhatóság (vízben) | kicsi | ||
| Oldhatóság (egyéb oldószerek) | szerves oldószerekben oldódik | ||
| Kristályszerkezet | |||
| Molekulaforma | sp2 N | ||
| Veszélyek | |||
| Főbb veszélyek | mérgező | ||
| R mondatok | R20/21–R25 | ||
| S mondatok | S26–S36/37–S45 | ||
| Ha másként nem jelöljük, az adatok az anyag standardállapotára (100 kPa) és 25 °C-os hőmérsékletre vonatkoznak. | |||
A nitrozobenzol szerves vegyület, képlete C6H5NO. Diamágneses molekula, dimerjével egyensúlyban létezik.
Előállítása
[szerkesztés]Elsőként Adolf von Baeyer állította elő difenilhigany és nitrozil-bromid reakciójával:[1]
- (C6H5)2Hg + BrNO → C6H5NO + C6H5HgBr
A modern szintézis során nitrobenzolt redukálnak fenilhidroxilaminná (C6H5NHOH), amelyet aztán nátrium-dikromáttal (Na2Cr2O7) oxidálnak.[2]
Előállítható anilinből is, peroxo-monokénsavval (Caro-sav) végzett oxidációval.[3] Az így kapott terméket általában vízgőzdesztillációval tisztítják, melynek során zöld anyagként jut át a szedőbe, és színtelen anyaggá dermed.
Jellemző reakciói
[szerkesztés]Diénekkel Diels–Alder-reakcióba lép,[4] anilinekkel kondenzációs reakcióban azobenzol származékokat ad, ezt Mills-reakciónak nevezik.[5] Redukciójával anilin keletkezik.
Legjellemzőbb reakciója, hogy aktív metiléncsoportot tartalmazó vegyületekkel, például malonészterekkel vagy benzil-cianiddal kondenzációs reakcióba lép. Benzilcianidedal (PhCH2CN) például (PhC(CN)=NPh) imin keletkezik, ez az Ehrlich–Sachs-reakció:[6]
- Ph–CH2-CN + Ph–NO → Ph–CH(CN)–N(OH)–Ph (oxiaminálási adduktum) → PhC(CN)=N–Ph
Néha az aktív metiléncsoportot tartalmazó vegyületekkel végzett kondenzáció O-nitrozo-aldol reakcióterméket eredményez:[7]
- R–CH2-CHO + Ph–NO → R–CH(CHO)–O–NHPh (aminoxilálási adduktum)
Hivatkozások
[szerkesztés]- ↑ Baeyer, A. (1874).
- ↑ G. H. Coleman, C. M. McCloskey, F. A. Stuart (1955).
- ↑ H. Caro (1898).
- ↑ H. Yamamoto, N. Momiyama "Rich Chemistry of Nitroso Compounds" Chemical Communications 2005, pp.3514–25.
- ↑ H. D. Anspon (1955). "p-Phenylazobenzoic Acid".
- ↑ H. Feuer.
- ↑ "Asymmetric O− and N− Nitroso Aldol Reaction – an efficient access to a-oxy and a-amino carbonyl compound" (PDF).
Fordítás
[szerkesztés]Ez a szócikk részben vagy egészben a Nitrosobenzene című angol Wikipédia-szócikk fordításán alapul. Az eredeti cikk szerkesztőit annak laptörténete sorolja fel. Ez a jelzés csupán a megfogalmazás eredetét és a szerzői jogokat jelzi, nem szolgál a cikkben szereplő információk forrásmegjelöléseként.
