Hidrogénezés

(1) A reaktánsok adszorbeálódnak a katalizátor felületén, a H2 disszociál.
(2) Az egyik C atomhoz egy H atom kapcsolódik. A másik C atom még mindig a felülethez kötődik.
(3) A második C atom egy H atomhoz kapcsolódik. A molekula elhagyja a felületet.
A hidrogénezés – hidrogénnel történő kezelés – a molekuláris hidrogén (H2), valamint egy másik vegyület vagy elem között – általában katalizátor, például nikkel, palládium vagy platina jelenlétében – végbemenő kémiai reakció. Ezt a reakciót gyakran alkalmazzák szerves vegyületek redukálásra vagy telítésére. A folyamat során jellemzően két hidrogénatom épül be a molekulába, ez utóbbi gyakorta valamilyen alkén. A reakció gyakorlati hasznosításához katalizátorok szükségesek, nem katalitikus hidrogénezés csak nagyon magas hőmérsékleten játszódik le. A hidrogénezés redukálja a szénhidrogének kettős és hármas kötéseit.[1]
A folyamat
[szerkesztés]A hidrogénezési reakcióhoz három anyag szükséges: a telítetlen szubsztrát, a hidrogén (vagy hidrogénforrás), és minden esetben szükséges katalizátor is. A redukciós reakció a szubsztráttól és a katalizátor aktivitásától függően különböző hőmérsékletet és nyomást igényel.
Rokon vagy versengő reakciók
[szerkesztés]A hidrogénezéshez felhasznált katalizátor és reakciókörülmények a cisz-alkének transz-alkénné történő izomerizációjához is vezethetnek. Ennek azért nagy a jelentősége, mert az élelmiszerekben a legtöbb transz-zsírsavat a hidrogénezési eljárások hozzák létre (lásd alább). A kötéshasadással együtt járó hidrogénaddíciós reakciókat hidrogenolízisnek nevezzük. A hasítás bekövetkezhet szén–szén vagy szén–heteroatom (oxigén, nitrogén vagy halogén) kötésnél. A poláris kötések hidrogénezését némely esetben hidrogenolízés is kísérheti.
A hidrogén forrása
[szerkesztés]A hidrogénezéshez az egyik lehetséges hidrogénforrás maga a hidrogéngáz (H2), amely kereskedelmi forgalomban általában gázpalackban kapható. A hidrogénezés folyamata során gyakran 1 atmoszféránál nagyobb H2 nyomást használnak, ezt a gázpalackból nyerik, esetenként gázpumpát is használnak. A gáz halmazállapotú hidrogént iparilag szénhidrogénekből állítják elő a gőzreformálás során.[2] A hidrogén számos esetben donormolekulából – például hangyasav, izopropanol, dihidroantracén – származik, amely a folyamat során dehidrogéneződik (és az előbbi példákból rendre szén-dioxid, aceton és antracén keletkezik). Ez a folyamat a transzferhidrogénezés.
Szubsztrátok
[szerkesztés]Az alkének és alkinek – mind homogén, mind heterogén katalízissel történő – hidrogénezésének fontos sajátsága, hogy a hidrogén addíciója „szin addíció”, melynek során a hidrogén a legkevésbé gátolt irányból lép be a molekulába.[3] Ilyen reakció számos különböző funkciós csoporttal végbemehet.
| Szubsztrát | Termék | Megjegyzés | Hidrogénezési hő (kJ/mol)[4] |
|---|---|---|---|
| R2C=CR'2 (alkén) |
R2CHCHR'2 (alkán) |
jelentős alkalmazása a margarinkészítés | −90 és −130 között |
| RC≡CR' (alkin) |
RCH2CH2R' (alkán) |
részleges hidrogénezéssel cisz-RHC=CHR' keletkezik |
−300 (teljes hidrogénezéskor) |
| RCHO (aldehid) |
RCH2OH (primer alkohol) |
gyakran transzferhidrogénezéssel végzik | −60 és −65 között |
| R2CO (keton) |
R2CHOH (szekunder alkohol) |
gyakran transzferhidrogénezéssel végzik | −60 és −65 között |
| RCO2R' (észter) |
RCH2OH + R'OH (két alkohol) |
zsíralkoholok gyártására gyakran használják | −25 és −105 között |
| RCO2H (karbonsav) |
RCH2OH (primer alkohol) |
zsíralkoholok gyártásához | −25 és −75 között |
| RNO2 (nitro) |
RNH2 (amin) |
fő alkalmazása az anilingyártás[5][6] | −550 |
Katalizátorok
[szerkesztés]Ritka kivételektől eltekintve fémkatalizátorok hiányában a H2 nem reagál a szerves vegyületekkel. A telítetlen szubsztrát kemiszorbeál a katalizátoron, annak felületét nagyrészt beborítva. A heterogén katalizátorokkal a hidrogén felületi hidrideket (M−H) képez, amelyből a hidrogén átvihető a kemiszorbeált szubsztrátra. A platina, palládium, ródium és ruténium rendkívül aktív katalizátorok, amelyek már alacsonyabb hőmérsékleten és kisebb H2 nyomáson működnek. Gazdaságosabb alternatívaként nemesfém helyett más, főként nikkel alapú katalizátorokat is kifejlesztettek (ilyen például a Raney-nikkel és az Urushibara-nikkel), de ezekkel a reakció gyakran lassabban megy végbe vagy magasabb hőmérsékletet igényel: kompromisszumot kell kötni az aktivitás (a reakció sebessége) és a katalizátor, valamint a nagy nyomást igénylő készülék költsége között. Vegyük észre, hogy a Raney-nikkellel katalizált hidrogénezési reakció nagy nyomást igényel.[7][8]
A katalizátorokat általában két nagy osztályba sorolják: homogén katalizátorok és heterogén katalizátorok. A homogén katalizátorok oldódnak a telítetlen szubsztrátot tartalmazó oldószerben. A heterogén katalizátorok szilárd anyagok, amelyeket a szubsztrát oldószerében szuszpendálnak vagy a gáz halmazállapotú szubsztráttal hozznak érintkezésbe.
Homogén katalizátorok
[szerkesztés]Az alábbiakban néhány jól ismert homogén katalizátort sorolunk fel. Ezek olyan koordinációs komplexek, amelyek mind a telítetlen szubsztrátot, mind a H2-t aktiválják. Ezek legjellemzőbben platinacsoportbeli fémek, elsősorban Rh és Ir komplexei.
- A homogén fázisú hidrogénezés katalizátorai és azok prekurzorai
-
A diklórtrisz(trifenilfoszfin)ruténium(II) ruténium alapú prekatalizátor
-
A Crabtree-katalizátor nagy aktivitású, irídiumot tartalmazó katalizátor
-
A Rh2Cl2(cod)2 több homogén fázisú katalizátor prekurzora
-
A (S)-iPr-PHOX jellegzetes, az aszimmetriás hidrogénezési reakciókban használatos kelátképző foszfin ligandum

Homogén katalizátorokat az aszimmetriás szintézisekben is alkalmaznak, a prokirális szubsztrátok hidrogénezésekor. Ezen eljárás egy korai megvalósítása volt az enamid prekurzorok Rh-katalizátorok mellett történő hidrogénezése, mellyel az L-DOPA gyógyszerhatóanyagot nyerték.[9] Az aszimmetriás redukciót úgy érték el, hogy a katalizátort előtte difoszfin ligandumokkal királissá tették.[10] Az S-metolaklór nevű herbicid előállítását is ródium katalizátoros, úgynevezett Josiphos ligandummal (kereskedelmi néven Xyliphos) történő hidrogénezéssel végzik.[11] Elméletileg az aszimmetriás hidrogénezéshez királis heterogén katalizátor is alkalmazható,[12] de ez a lehetőség inkább csak érdekesség, semmint valós technológia.
Heterogén katalizátorok
[szerkesztés]Az ipari hidrogénezési reakcióknál gyakoribbak a heterogén katalizátorok. Az iparban a drága, főként nemesfém hidrogénező katalizátorokat oldatból leválasztott finom por formájában viszik fel a hordozóra, amely olcsó, porózus, többnyire szemcsés anyag, például aktív szén, alumínium-oxid, kalcium-karbonát vagy bárium-szulfát.[13] Például a platina/szén katalizátor úgy készül, hogy a hexakloro-platina(IV)-savat szénen in situ redukálják. Ilyen katalizátor például az 5% ruténiumot tartalmazó aktív szén vagy 1% platina alumínium-oxidon. A közönséges fémből készült katalizátorok – például a Raney-nikkel – jellemzően sokkal olcsóbbak, és hordozó sem szükséges hozzájuk. A laboratóriumban – magas áruk ellenére – még mindig használnak hordozó nélküli (nagy tömegű) nemesfém katalizátorokat – például platinakormot – is.
Mint a homogén katalizátoroknál is, az aktivitást a fém környezetének – a koordinációs szférának – a módosításával érik el. A kristályos heterogén katalizátorok különböző lapjai például különböző aktivitást mutatnak, ami például különböző fémek összekeverésével vagy más elkészítési eljárással módosítható. Hasonló módon a heterogén katalizátorok viselkedését is befolyásolja a hordozó.
Sok esetben – tapasztalati úton kikísérletezve – szelektív „mérgezéssel” módosítanak a katalizátoron. Gondosan megválasztott katalizátorral így elérhető, hogy a hidrogénezés csak bizonyos funkciós csoportokat redukáljon, másokat pedig ne: például hogy csak az alkénfunkció hidrogéneződjön, az aromás gyűrű maradjon érintetlenül, de ilyen az alkinek Lindlar-katalizátorral történő szelektív hidrogénezése is. Ha például palládium katalizátort bárium-szulfátra viszünk, majd azt kinolinnal kezeljük, akkor az így kapott katalizátor az alkineket csak alkénekig redukálja. A Lindlar-katalizátor segítségével fenilacetilénből sztirol állítható elő.[14]
- Példák hidrogénezési reakciókra
-
A karvon kevésbé gátolt alkéncsoportjának szelektív hidrogénezése homogén katalizátorral (Wilkinson-katalizátorral)[15]
-
A fenilacetilén részleges hidrogénezése Lindlar-katalizátorral
-
Imin hidrogénezése a gyakran használt Raney-nikkel heterogén katalizátorral
-
Rezorcin származék részleges hidrogénezése Raney-nikkel katalizátorral
Transzferhidrogénezés
[szerkesztés]
A transzferhidrogénezés során H2 helyett más hidrogéndonor molekulát alkalmaznak. Ilyen – akár a reakció oldószereként is szolgáló – vegyület lehet a hidrazin, a dihidronaftalin, dihidroantracén, izopropanol és hangyasav.[17]
A szerves kémiai szintézisekben a transzferhidrogénezés telítetlen poláris szubsztrátok, például ketonok, aldehidek és iminek aszimmetriás redukciójára használható. A poláris szubsztrátok, például a ketonok és aldehidek hidrogénezése jellemzően transzferhidrogénezéssel, vagy legalábbis homogén katalizátorokkal lehetséges. Ezeket a katalizátorokat könnyű előállítani királis formában, ami a ketonok aszimmetriás hidrogénezésének alapja.
Elektrolitikus hidrogénezés
[szerkesztés]A poláros szubsztrátok, például a nitrilek protikus oldószerben elektrokémiai úton is hidrogénezhetők.[18]
Termodinamika és mechanizmus
[szerkesztés]A szénhidrogének kettős vagy hármas kötésére történő hidrogénaddíció olyan redoxireakció, amely termodinamikailag kedvező lehet. Az alkénekre történő hidrogénaddíció szabadentalpia-változása például −101 kJ·mol−1.[10] A hidrogénezési reakciók többségénél azonban katalizátor hiányában a reakció sebessége elhanyagolhatóan kicsi. A hidrogénezés erősen exoterm folyamat. A növényi olajok (étolaj) és zsírsavak hidrogénezése során például mintegy 25 kcal/mol (105 kJ/mol) energia szabadul fel. Az alkének és alkinek fémkatalizált hidrogénezési reakcióinak mechanizmusát behatóan tanulmányozták.[19] Először is, deutériumizotópos jelöléssel igazolták az addíciós reakció regiokémiáját:
- RCH=CH2 + D2 → RCHDCH2D
Heterogén katalízis
[szerkesztés]A szilárd felületen végbemenő reakciók elfogadott mechanizmusa a Horiuti-Polányi-féle mechanizmus:[20][21]
- A telítetlen kötés megkötődése a felületen, valamint a hidrogén disszociációja és katalizátorra kerülése atomos formában
- Egy hidrogénatom addíciója – ez a lépés reverzibilis
- A második atom addíciója – a hidrogénezés körülményei között ez gyakorlatilag irreverzibilis lépés
A második lépésben keletkező fémintermedier telített vegyület, amelyben a kötés mentén a csoportok egymáshoz képest elfordulhatnak, de a köztitermék el is bomolhat, és ezzel az alkén leválik a katalizátor felületéről. Ennek eredményeként a hidrogénező katalizátor szükségszerűen cisz-transz-izomerizációt okoz, mivel az izomerizáció termodinamikailag kedvező. Részleges hidrogénezéskor ez problémát jelent, de teljes hidrogénezéskor az izomerizáció során keletkező transz-alkén is végül telítődni fog.
Aromás vegyületek esetében az első kötés hidrogénezése a legnehezebb, ennek oka a stabilabb aromás rendszer megbontásához szükséges többletenergia. Ilyenkor ciklohexadién keletkezik, mely azonban nagyon reakcióképes és nem lehet elkülöníteni: ha a reakciókörülmények elég reduktívak ahhoz, hogy az aromás rendszert megszüntessék, akkor a molekula azonnal továbbredukálódik ciklohexénné. Normális körülmények között a ciklohexén is azonnal továbbalakul a teljesen telített ciklohexánná, azonban a katalizátor speciális módosításával el lehet érni, hogy a ciklohexén egy része megmaradjon, ha ez a kívánt termék.
Homogén katalízis
[szerkesztés]Számos homogén hidrogénezési eljárásban[22] a fém mindkét komponenshez kapcsolódik, így köztitermékként alkén-fém(H)2 komplex keletkezik. Az általános reakcióséma feltehetően a következő, vagy ehhez hasonló:
- a hidrogén oxidatív addícióval megkötődve dihidrid komplexet képez (a H2 oxidatív addíciója előtt dihidrogén komplex keletkezik):
- LnM + H2 → LnMH2
- az alkén megkötése
- LnM(η2H2) + CH2=CHR → Ln−1MH2(CH2=CHR) + L
- a fémről egy hidrogén vándorol a szénatomra (vándorlás és beékelődés):
- Ln−1MH2(CH2=CHR) → Ln−1M(H)(CH2−CH2R)
- a második hidrogénatom vándorlása a fémről az alkilcsoportra, ezzel egyidejűleg az alkán disszociációja („reduktív elimináció”):
- Ln−1M(H)(CH2−CH2R) → Ln−1M + CH3−CH2R
Szervetlen szubsztrátok
[szerkesztés]A nitrogénből és hidrogénből történő ammóniagyártást nagy léptékben végzik a Haber–Bosch-eljárással, a becslések szerint erre a világ energiatermelésének 1%-át fordítják.
Az oxigén részleges hidrogénezésével hidrogén-peroxid állítható elő, ezt a folyamatot azonban nem használják kereskedelmi gyártásra.
Ipari alkalmazások
[szerkesztés]A katalitikus hidrogénezésnek különböző ipari alkalmazásai vannak, ezekben a legtöbb esetben heterogén katalizátort alkalmaznak.[2]
Élelmiszeripar
[szerkesztés]A hidrogénezés legnagyobb léptékű alkalmazása a növényi olajok feldolgozása.[2] A tipikus növényi olajok többszörösen telítetlen (több kettős kötést tartalmazó) zsírsavakból származnak. Ezek részleges hidrogénezésével a bennük található kettős kötések nagy része – de nem mindegyike – redukálódik. A hidrogénezés mértékét a hidrogén és a katalizátor mennyiségének, valamint a reakció hőmérsékletének és időtartamának korlátozásával szabályozzák.[23]

Jellemző növényi olajok részleges hidrogénezése a margaringyártás során. A folyamat során a C=C kettős kötések nagyrészt megszűnnek, ami a termék olvadáspontját megnöveli
A növényi olajok hidrogénezéssel szilárd vagy félszilárd zsírokká alakulnak, ilyenek vannak például a margariban. A zsírok telítettsége mértékének változásával néhány fontos fizikai jellemzőben, például az olvadási tartományban is változás áll be, emiatt szilárdulnak meg az olajok. A sütéshez előnyösebb a szilárd vagy félszilárd zsír, mert a kisütött terméknek jobb textúrát ad az, ahogy a zsír keveredik a liszttel. Mivel a részlegesen hidrgénezett növényi olaj olcsóbb, mint az állati eredetű zsír, konzisztenciáját tekintve széles választékban elérhető, és más előnyös tulajdonságai is vannak (stabilabb az oxidációval szemben és hosszabb ideig eláll), a sütőipari termékek nagy részében főként ezeket használják zsiradékként.
A részleges hidrogénezés egyik, az egészségre hatással levő következménye az, hogy a megmaradó telítetlen kötések izomerizációja miatt transz-izomerek keletkeznek, melyek növelik a szív- és érrendszeri megbetegedések kockázatát.[24] A ciszből transz izomerré történő átalakulást segíti, hogy a transz konfiguráció energetikailag kedvezőbb. Egyensúlyban a transz/cisz izomerek aránya kb. 2:1. Számos ország és régió vezette be, hogy a címkén kötelező feltüntetni az élelmiszerek transz-zsírsav tartalmát, és javasolják a gyártóknak ezek mennyiségének csökkentését.[25][26][27]
Petrolkémiai ipar
[szerkesztés]A petrolkémiai folyamatok során az alkénekből és aromás vegyületekből hidrogénezéssel telített alkánokat (parafinnok) és cikloalkánokat (naftének) nyernek, melyek toxicitása és reakciókészsége is kisebb. A – néha hosszabb ideig levegőn tárolt – folyékony üzemanyagok szempontjából jelentős tényező, hogy a telített szénhidrogének eltarthatósága sokkal jobb, míg az alkének hajlamosok hidroperoxidokat képezni.
Szerves kémia
[szerkesztés]A telítetlen vegyületek hidrogénezéssel telített származékokká alakíhatóak. Nemcsak alkének és alkinek, hanem aldehidek, iminek és nitrilek is telíthetők.[28] ezekből a megfelelő alkoholok és aminok keletkeznek. Ily módon az alkénből és szén-monoxidból hidroformilezéssel nyerhető alkil-aldehidekből alkohol állítható elő, például az 1-propanolt az etilénből és szén-monoxidból nyert propionaldehidből állítják elő. A xilitet a xilóz nevű – aldehidcsoportot tartalmazó – cukor hidrogénezésével nyerik. Primer aminokat elő lehet állítani nitrilek hidrogénezésével, míg nitrilek könnyen szintetizálhatók cianid és megfelelő elektrofil reakciójával.
A kezdetek
[szerkesztés]Heterogén katalitikus hidrogénezés
[szerkesztés]Az első hidrogénezési reakció a hidrogén oxigénre történő, platina által katalizált addíciója volt a Döbereiner-féle gyújtókészülékben, melyet már 1823-ban forgalmaztak. A hidrogénezési eljárás atyjának Paul Sabatier francia kémikust tartják. 1897-ben, James F. Boyce amerikai kémikus korábbi munkáját követve felfedezte, hogy a nikkelnyomok katalizálják a hidrogén gázállapotú szénhidrogén-molekulákra történő addícióját, ezt ma Sabatier-folyamatnak (vagy Sabatier–Senderens-eljárásnak) nevezzük. Ezen munkásságáért 1912-ben megosztott kémiai Nobel-díjban részesült. 1902-ben Németországban, majd 1903-ban Nagy-Britanniában Wilhelm Normann szabadalmat kapott a folyékony olajok hidrogénezésére, ezzel elindítva egy ma már világméretű iparágat. Az ipari szempontból fontos, elsőként 1905-ben leírt Haber–Bosch-eljárás során a nitrogént hidrogénezik. Az 1922-en közölt Fischer–Tropsch-eljárás segítségével a kőszénből könnyen előállítható szén-monoxid hidrogénezésével folyékony üzemanyagok állíthatók elő.
1922-ben Voorhees és Adams leírt egy berendezést, amelyben légkörinél nagyobb nyomáson lehet hidrogénezést végezni.[29] 1924-ben Murray Raney kifejlesztette a nagyon finomra porított nikkelt, melyet széles körben használnak a hidrogénezési reakciók, például a nitrilek aminná történő átalakítása vagy a margaringyártás katalizátoraként.
Homogén katalitikus hidrogénezés
[szerkesztés]Az 1930-as években Calvin felfedezte, hogy a réz(II) komplexei oxidálják a H2-t. Az 1960-es években kifejlesztették a jól definiált, átmenetifém-komplexeket tartalmazó homogén katalitárokat, például a Wilkinson-katalitárt (RhCl(PPh3)3), majd nem sokkal ezt követően felismerték, hogy a kationos Rh és Ir katalizálják az alkének és karbonilok hidrogénezését.[30] Az 1970-es években a levodopa szintézisében megvalósították az aszimmetriás hidrogénezést, az 1990-es években pedig feltalálták a Noyori aszimmetriás hidrogénezést.[31] A homogén hidrogénezés fejlődésére hatással voltak azok a munkák, melyeket az 1930-as és 1940-es években kezdtek a hidroformilezés és a Ziegler–Natta-polimerizáció kapcsán.
Fémmentes hidrogénezés
[szerkesztés]A gyakorlatban a hidrogénezéshez a legtöbb esetben fémkatalizátor szükséges. Néhány hidrogéndonor esetében azonban a hidrogénezés katalizátor nélkül is végbemegy, ilyen jellemző hidrogéndonorok a diimidek és az alumínium-izopropoxid – utóbbi például a Meerwein–Ponndorf–Verley-redukcióban használatos. Végeztek tudományos kutatásokat néhány fémmentes katalizátorrendszerrel, ezek egyike terc-butanol, kálium-terc-butoxid és nagyon magas hőmérséklet alkalmazásával ketonok redukciójára alkalmas.[32] Az alábbi reakció a benzofenon hidrogénezését mutatja be:
A kinetikai vizsgálatok szerint[33] a reakció mindhárom reaktánsra nézve elsőrendű, ami hattagú gyűrűs átmeneti állapotra enged következtetni.
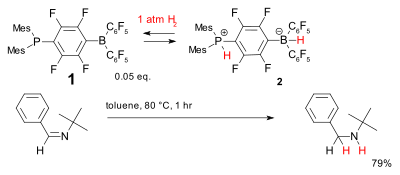
Másik fémmentes hidrogénezési rendszer az 1 foszfin-borán vegyület, nevezik frusztrált Lewis-párnak is. Viszonylag alacsony hőmérsékleten reverzibilisen dihidrogént tud megkötni, ekkor 2 foszfónium-borát keletkezik, mellyel sztérikusan gátolt egyszerű imineket lehet redukálni.[34]
Beszámoltak arról, hogy a nitrobenzol anilinné történő redukcióját fullerének és azok monoanionja katalizálja, légköri nyomású hidrogén és UV-fény jelenlétében[35]
A hidrogénezéshez használt berendezések
[szerkesztés]A laboratóriumi hidrogénezésnek három fő módszere van:
- légköri nyomáson végzett szakaszos hidrogénezés
- nagy hőmérsékleten és/vagy nyomáson végzett szakaszos hidrogénezés[36]
- folyamatos hidrogénezés
Légköri nyomáson végzett szakaszos hidrogénezés
[szerkesztés]Ez az első, és még ma is gyakran használt hidrogénezési mód a laboratóriumi gyakorlatokon. Az oldott reaktánst tartalmazó, nitrogénnel vagy argonnal oxigénmentesített gömblombikba szilárd katalizátort tesznek, majd áteresztő gumidugóval lezárják azt. A hidrogéngázt H2-vel töltött ballonból juttatják be. A lombik tartalmát kevertetik. A hidrogénfogyás mérhető – például színes folyadékot, többnyire réz-szulfát oldatot tartalmazó osztott csővel –, így követni lehet a hidrogénezési folyamat menetét.
Nagy hőmérsékleten és/vagy nyomáson végzett szakaszos hidrogénezés
[szerkesztés]Mivel számos hidrogénezési reakció – például a védőcsoportok hidrogenolízise és az aromás rendszerek redukciója – légköri nyomáson és hőmérsékleten csak nagyon lassan megy végbe, elterjedtek a túlnyomásos rendszerek. Ezekben az esetekben a reaktáns nyomásálló tartályban lévő oldatához inert atmoszféra alatt adják hozzá a katalizátort. A hidrogént közvetlenül gázpalackból vagy laboratóriumi hidrogénforrásból nyerik, a nyomás alatt levő reakcióelegyet kevertetik.[36] Melegítés is történhet, mivel a nyomás kompenzálja a gáz oldhatóságának csökkenését.
Folyamatos hidrogénezés
[szerkesztés]A laboratórimban kedvelt eljárássá vált a folyamatos hidrogénezés, és elterjedtsége az iparban is nő. Az eljárás alapja, hogy a reaktáns híg oldatát rögzített katalizátorágy felett folyamatosan áramoltatják hidrogén jelenlétében. HPLC-s pumpával a használható nyomástartomány a légköri nyomástól akár 100 bar-ig terjedhet. A hőmérséklet is növelhető. Laboratóriumi célra különböző előre töltött katalizátorok is elérhetők, így nem kell a piroforos katalizátorok kezelésével bajlódni.
Ipari reaktorok
[szerkesztés]A katalitikus hidrogénezést hordozóra felvitt katalizátorral töltött folyamatos csőreaktorban végzik, jellemzően nagy hőmérsékleten és nyomáson, bár ez az alkalmazott katalizátortól is függ. A katalizátortöltet általában jóval kevesebb, mint a szakaszos laboratóriumi hidrogénezés esetében, és az aktivitás, szelektivitás és a katalizátor stabilitásának növelése céljából a fémhez különböző promotereket is adnak, vagy fémkeveréket használnak. Kis aktivitása ellenére általában nikkelt alkalmaznak, mivel a nemesfémekhez képest sokkal olcsóbb.
Mechanikusan kevert gáz-folyadék reaktorokat is használnak katalitikus hidrogénezésre.[37]
Jegyzetek
[szerkesztés]- ↑ Hudlický, Miloš. Reductions in Organic Chemistry. Washington, D.C.: American Chemical Society, 429. o. (1996). ISBN 0-8412-3344-6
- ↑ a b c Paul N. Rylander, "Hydrogenation and Dehydrogenation" in Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim, 2005. doi:10.1002/14356007.a13_487
- ↑ Advanced Organic Chemistry Jerry March 2nd Edition
- ↑ Scott D. Barnicki "Synthetic Organic Chemicals" in Handbook of Industrial Chemistry and Biotechnology edited by James A. Kent, New York : Springer, 2012. 12th ed. ISBN 978-1-4614-4259-2.
- ↑ (2000) „Hydrogenation of nitrobenzene using polymer bound Ru(III) complexes as catalyst”. Ind. Jr. of Chem. Tech. 7, 280. o.
- ↑ (1998) „Hydrogenation of nitrobenzene using polymer anchored Pd(II) complexes as catalyst”. Journal of Molecular Catalysis 130, 57. o. DOI:10.1016/s1381-1169(97)00197-0.
- ↑ C. F. H. Allen and James VanAllan (1955). „m-Toylybenzylamine”. Org. Synth..; Coll. Vol. 3: 827
- ↑ A. B. Mekler, S. Ramachandran, S. Swaminathan, and Melvin S. Newman (1973). „2-Methyl-1,3-Cyclohexanedione”. Org. Synth..; Coll. Vol. 5: 743
- ↑ (1986. március 1.) „Application of organometallic catalysis to the commercial production of L-DOPA”. Journal of Chemical Education 63 (3), 222. o. DOI:10.1021/ed063p222.
- ↑ a b Shriver & Atkins' inorganic chemistry., 5th, New York: W. H. Freeman and Co., 696. o. (2010. november 4.). ISBN 978-1-4292-1820-7
- ↑ (2007. december 1.) „From a Chiral Switch to a Ligand Portfolio for Asymmetric Catalysis”. Accounts of Chemical Research 40 (12), 1240–1250. o. DOI:10.1021/ar7001057.
- ↑ (2007) „Asymmetric Catalysis at Chiral Metal Surfaces”. Chemical Reviews 107 (11), 4863–90. o. DOI:10.1021/cr0683663. PMID 17927256.
- ↑ Platinum Heterogeneous Catalysts - Alfa Aesar. www.alfa.com . [2018. január 18-i dátummal az eredetiből archiválva]. (Hozzáférés: 2018. április 28.)
- ↑ H. Lindlar and R. Dubuis (1973). „Palladium Catalyst for Partial Reduction of Acetylenes”. Org. Synth..; Coll. Vol. 5: 880
- ↑ S. Robert E. Ireland and P. Bey (1988). „Homogeneous Catalytic Hydrogenation: Dihydrocarvone”. Org. Synth..; Coll. Vol. 6: 459
- ↑ (2007) „Catalytic Hydrogenation of Maleic Acid at Moderate Pressures A Laboratory Demonstration”. Journal of Chemical Education 84, 1948. o. DOI:10.1021/ed084p1948.
- ↑ van Es, T.; Staskun, B. "Aldehydes from Aromatic Nitriles: 4-Formylbenzenesulfonamide" Org. Synth., Coll. Vol. 6, p. 631 (1988). (Article Archiválva 2007. szeptember 27-i dátummal a Wayback Machine-ben.)
- ↑ (2004) „Catalytic Hydrogenation of Organic Compounds without H2 Supply: An Electrochemical System”. Journal of Chemical Education 81 (9), 1350. o. DOI:10.1021/ed081p1350.
- ↑ Kubas, G. J., "Metal Dihydrogen and σ-Bond Complexes", Kluwer Academic/Plenum Publishers: New York, 2001
- ↑ Gallezot, Pierre. "Hydrogenation - Heterogeneous" in Encyclopedia of Catalysis, Volume 4, ed. Horvath, I.T., John Wiley & Sons, 2003.
- ↑ (1934) „Exchange reactions of hydrogen on metallic catalysts”. Transactions of the Faraday Society 30, 1164. o. DOI:10.1039/TF9343001164.
- ↑ Johannes G. de Vries, Cornelis J. Elsevier, eds. The Handbook of Homogeneous Hydrogenation Wiley-VCH, Weinheim, 2007. ISBN 978-3-527-31161-3
- ↑ Ian P. Freeman "Margarines and Shortenings" in Ullmann's Encyclopedia of Industrial Chemistry, 2005, Wiley-VCH, Weinheim. doi:10.1002/14356007.a16_145
- ↑ (2006) „New and Existing Oils and Fats Used in Products with Reduced Trans-Fatty Acid Content”. Journal of the American Dietetic Association 106, 867–880. o. DOI:10.1016/j.jada.2006.03.010.
- ↑ „Deadly fats: why are we still eating them?”, The Independent, 2008. június 10.. [2008. június 14-i dátummal az eredetiből archiválva] (Hozzáférés: 2008. június 16.)
- ↑ „New York City passes trans fat ban”, msnbc, 2006. december 5.. [2010. január 6-i dátummal az eredetiből archiválva] (Hozzáférés: 2010. január 9.)
- ↑ „F.D.A. Gives Food Industry 3 Years to Eliminate Trans Fats”, The New York Times, 2015. június 16.. [2015. június 16-i dátummal az eredetiből archiválva] (Hozzáférés: 2015. június 16.)
- ↑ (2014. február 2.) „Catalytic Hydrogenation of Carboxylic Acid Esters, Amides, and Nitriles with Homogeneous Catalysts”. Organic Process Research & Development 18 (2), 289–302. o. DOI:10.1021/op4003278.

- ↑ Archived copy. [2008. szeptember 10-i dátummal az eredetiből archiválva]. (Hozzáférés: 2008. augusztus 5.)
- ↑ (1976. április 1.) „Catalytic hydrogenation using cationic rhodium complexes. I. Evolution of the catalytic system and the hydrogenation of olefins”. Journal of the American Chemical Society 98 (8), 2134–2143. o. DOI:10.1021/ja00424a020.
- ↑ C. Pettinari, F. Marchetti, D. Martini "Metal Complexes as Hydrogenation Catalysts" Comprehensive Coordination Chemistry II, 2004, volume 9. pp. 75–139. doi:10.1016/B0-08-043748-6/09125-8
- ↑ (1964) „Homogeneous Hydrogenation in the Absence of Transition-Metal Catalysts”. Journal of the American Chemical Society 86 (18), 3750. o. DOI:10.1021/ja01072a028.
- ↑ (2002) „Hydrogenation without a Transition-Metal Catalyst: On the Mechanism of the Base-Catalyzed Hydrogenation of Ketones”. Journal of the American Chemical Society 124 (29), 8693–8. o. DOI:10.1021/ja016152r. PMID 12121113.
- ↑ (2007) „Metal-Free Catalytic Hydrogenation”. Angewandte Chemie International Edition 46 (42), 8050. o. DOI:10.1002/anie.200702908.
- ↑ (2009) „A Nonmetal Catalyst for Molecular Hydrogen Activation with Comparable Catalytic Hydrogenation Capability to Noble Metal Catalyst”. Journal of the American Chemical Society 131 (45), 16380–2. o. DOI:10.1021/ja9061097. PMID 19845383.
- ↑ a b (1928. november 4.) „Apparatus for catalytic reduction”. Organic Syntheses 8, 10. o. DOI:10.15227/orgsyn.008.0010.
- ↑ (1982) „Mechanically agitated gas–liquid reactors”. Chemical Engineering Science 37 (6), 813. o. DOI:10.1016/0009-2509(82)80171-1.
Fordítás
[szerkesztés]Ez a szócikk részben vagy egészben a Hydrogenation című angol Wikipédia-szócikk ezen változatának fordításán alapul. Az eredeti cikk szerkesztőit annak laptörténete sorolja fel. Ez a jelzés csupán a megfogalmazás eredetét és a szerzői jogokat jelzi, nem szolgál a cikkben szereplő információk forrásmegjelöléseként.





![A karvon kevésbé gátolt alkéncsoportjának szelektív hidrogénezése homogén katalizátorral (Wilkinson-katalizátorral)[15]](http://upload.wikimedia.org/wikipedia/commons/thumb/d/d3/CarvoneH2.png/162px-CarvoneH2.png)
![A nitrogén hidrogénezése {\displaystyle {\ce {{\underset {nitrogen}{N{\equiv }N}}+{\underset {hidrogen \atop (200atm)}{3H2}}->[{\ce {Fe\ katalizator}}][350-550^{\circ }{\ce {C}}]{\underset {ammonia}{2NH3}}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/0c8bb0e399d8082e4fade176ef2fd56fb63120d8)