Glutamin
| l-Glutamin[1] | |||
| |||
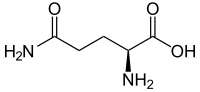
 Az l-izomer és az ikerion pálcikamodellje | |||
| IUPAC-név | glutamin | ||
| Szabályos név | 2-amino-4-karbamoilbutánsav | ||
| Más nevek | l-glutamin (levo)glutamid | ||
| Kémiai azonosítók | |||
|---|---|---|---|
| Rövidítés | Gln, Q | ||
| CAS-szám | 56-85-9 | ||
| PubChem | 738 | ||
| ChemSpider | 718 | ||
| KEGG | C00303 | ||
| ChEBI | 28300 | ||
| ATC kód | A16AA03 | ||
| |||
| |||
| InChIKey | ZDXPYRJPNDTMRX-UHFFFAOYSA-N | ||
| UNII | 0RH81L854J | ||
| ChEMBL | 930 | ||
| Kémiai és fizikai tulajdonságok | |||
| Kémiai képlet | C5H10N2O3 | ||
| Moláris tömeg | 146,14 g/mol | ||
| Olvadáspont | 185 °C körül bomlik | ||
| Oldhatóság (vízben) | oldódik | ||
| Ha másként nem jelöljük, az adatok az anyag standardállapotára (100 kPa) és 25 °C-os hőmérsékletre vonatkoznak. | |||
A glutamin (rövidítve Gln vagy Q) egyike a 20 genetikailag kódolt aminosavnak. Nem tekintik esszenciális aminosavnak, de bizonyos esetekben, például intenzív atlétikai edzés vagy egyes gyomor-bélbetegségek hatására feltételesen esszenciálissá válhat. Amid oldallánca a glutaminsav hidroxilcsoportnak amin funkciós csoportra történő cseréjével vezethető le, így a glutaminsav amidjának tekinthető. Kodonjai CAA és CAG. Az emberi vérben a glutamin a legnagyobb mennyiségben előforduló szabad aminosav, koncentrációja körülbelül 500–900 µmol/l.[2]
A glutamin szó a latin gluten (enyv) és az ammónia → amin összevonásából keletkezett.[3]
Szerkezete
[szerkesztés]
Funkciói
[szerkesztés]A glutamin számos biokémiai folyamatban szerepet játszik, többek között:
- a fehérjeszintézisben (mint a 20 fehérjealkotó aminosav egyike)
- ammónium termelése révén a vese sav–bázis egyensúlyának szabályozásában[4]
- a glükóz mellett a sejtek energiaforrása[5]
- nitrogéndonor számos anabolikus folyamatban, például a purinszintézisben[2]
- széndonor a citromsavciklusban[6]
- a vérkeringésben nem toxikus ammónia transzporter
Előállító és felhasználó szervek
[szerkesztés]Előállítók
[szerkesztés]A glutamint a glutamát-szintetáz enzim állítja elő glutamátból és ammóniából. A legjelentősebb glutamin előállító szövet az izomszövet, az összes glutamin mintegy 90%-át ez állítja elő. Kis mennyiségben a tüdő és az agy is bocsát ki glutamint.[7] Bár a máj is képes glutamin szintézisére, szerepe a glutamin metabolizmusában inkább szabályozó semmint termelő, mivel a máj nagy mennyiségű bélből származó glutamint vesz fel.[2]
Felhasználók
[szerkesztés]A glutamin legnagyobb fogyasztói a bélsejtek,[2] a sav–bázis egyensúlyért felelős vesesejtek, az aktivált immunsejtek,[8] és számos rákos sejt.[6] Utóbbi kapcsán különböző glutamin analógokat, mint a DON, azaszerin vagy acivicin vizsgálnak mint rákellenes gyógyszereket.
Példák a glutamin felhasználására
[szerkesztés]Sérülés vagy betegség okozta katabolikus állapotban a glutamin feltételesen esszenciálissá válhat (azaz táplálékkal vagy táplálékkiegészítőkkel kell bevinni).[9] A glutamint széles körben vizsgálták az elmúlt 10–15 évben, és kimutatták, hogy elősegíti a sérülések, traumák, égési sérülések és a műtét utáni sebek gyógyulását, illetve csökkenti a rák kezelése során fellépő mellékhatásokat. A glutamint táplálékkiegészítőként is forgalmazzák az izomtömeg növeléséhez súlyemelők, testépítők, valamint az állóképességi és egyéb sportot űzők számára.
A bizonyítékok alapján a szájon át bevitt glutamin az agyalapi mirigy elülső részének stimulációja révén emelheti a plazma HGH szintjét.[10] A biológiai kutatásokban gyakran adnak l-glutamint a sejttenyészetek közegébe.[11][12] A tenyészet magas glutaminszintje azonban gátolhatja más aminosavak transzportfolyamatait.[13]
Fordítás
[szerkesztés]Ez a szócikk részben vagy egészben a Glutamine című angol Wikipédia-szócikk ezen változatának fordításán alapul. Az eredeti cikk szerkesztőit annak laptörténete sorolja fel. Ez a jelzés csupán a megfogalmazás eredetét és a szerzői jogokat jelzi, nem szolgál a cikkben szereplő információk forrásmegjelöléseként.
Jegyzetek
[szerkesztés]- ↑ szerk.: Weast, Robert C.: CRC Handbook of Chemistry and Physics, 62nd, Boca Raton, FL: CRC Press, C-311. o. (1981. február 21.). ISBN 0-8493-0462-8
- ↑ a b c d Brosnan JT (2003. June). „Interorgan amino acid transport and its regulation”. J. Nutr. 133 (6 Suppl 1), 2068S–2072S. o. PMID 12771367.
- ↑ Fülöp József: Rövid kémiai értelmező és etimológiai szótár. Celldömölk: Pauz–Westermann Könyvkiadó Kft. 1998. 57. o. ISBN 963 8334 96 7
- ↑ Hall, John E.; Guyton, Arthur C.. Textbook of medical physiology, 11th, St. Louis, Mo: Elsevier Saunders, 393. o. (2006). ISBN 0-7216-0240-1
- ↑ (2004) „Glutamine breakdown in rapidly dividing cells: Waste or investment?”. BioEssays 26 (7), 778–785. o. DOI:10.1002/bies.20063. PMID 15221859.
- ↑ a b (2007) „Deficiency in glutamine but not glucose induces MYC-dependent apoptosis in human cells”. The Journal of Cell Biology 178 (1), 93–105. o. DOI:10.1083/jcb.200703099. PMID 17606868. PMC 2064426.
- ↑ (2003) „Glutamine and glutamate as vital metabolites”. Brazilian Journal of Medical and Biological Research 36 (2), 153–163. o. DOI:10.1590/S0100-879X2003000200002. PMID 12563517.
- ↑ (2000) „Double-blind randomized controlled trial of glutamine-enriched polymeric diet in the treatment of active Crohn's disease”. Journal of pediatric gastroenterology and nutrition 30 (1), 78–84. o. PMID 10630444.
- ↑ Glutamine. University of Maryland Medical Center, 2011. május 24. (Hozzáférés: 2012. június 24.)
- ↑ (1995) „Increased plasma bicarbonate and growth hormone after an oral glutamine load”. The American journal of clinical nutrition 61 (5), 1058–1061. o. PMID 7733028.
- ↑ Thilly, William G.. Mammalian cell technology. London: Butterworths, 110. o. (1986). ISBN 0-409-90029-X. Hozzáférés ideje: 2012. június 22. „13 amino acids in Eagle's popular culture medium...are arginine, cyst(e)ine, glutamine...”
- ↑ Yang H, Roth CM, Ierapetritou MG. (2011) Analysis of amino acid supplementation effects on hepatocyte cultures using flux balance analysis, OMICS, A Journal of Integrative Biology, 15(7-8): 449–460.
- ↑ Yang H, Ierapetritou MG, Roth CM. (2010) Effects of amino acid transport limitations on cultured hepatocytes, Biophysical Chemistry, 152(1-3):89-98.
