Ftálsav
| Ftálsav | |||
 |

| ||
| IUPAC-név | Ftálsav | ||
| Szabályos név | Benzol-1,2-dikarbonsav | ||
| Kémiai azonosítók | |||
|---|---|---|---|
| CAS-szám | 88-99-3 | ||
| PubChem | 1017 | ||
| ChemSpider | 992 | ||
| |||
| Kémiai és fizikai tulajdonságok | |||
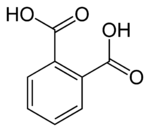
| Kémiai képlet | C6H4(COOH)2 | ||
| Moláris tömeg | 166,14 g/mol | ||
| Megjelenés | fehér szilárd anyag | ||
| Sűrűség | 1,593 g/cm³ (szilárd) | ||
| Olvadáspont | 207 °C[1] | ||
| Oldhatóság (vízben) | gyenge | ||
| Savasság (pKa) | pKa1 = 2,943 pKa2 = 5,432 | ||
| Veszélyek | |||
| EU osztályozás | Irritatív (Xi)[2] | ||
| NFPA 704 | |||
| R mondatok | R36/37/38[2] | ||
| S mondatok | S26, S37/39[2] | ||
| Rokon vegyületek | |||
| Rokon karbonsavak | Izoftálsav Tereftálsav | ||
| Rokon vegyületek | Ftálsav-anhidrid Ftálimid | ||
| Ha másként nem jelöljük, az adatok az anyag standardállapotára (100 kPa) és 25 °C-os hőmérsékletre vonatkoznak. | |||
A ftálsav (C6H4(COOH)2, benzol-1,2-dikarbonsav) aromás dikarbonsav. Izomerei az izoftálsav és a tereftálsav. Fehér kristályos vegyület. Olvadáspontján, 210 °C-on ftálsav-anhidriddé alakul.[3] Kétértékű savként viselkedik.
Neve a naftalin szó rövidített alakja, ui. annak oxidációjával nyerhető.[4]
Tulajdonságai
[szerkesztés]
Fizikai tulajdonságai
[szerkesztés]A ftálsav fehér színű, kristályos szilárd anyag. Prizmákban vagy lemezekben kristályosodik. A ftálsav 210 °C-on olvad, majd megolvadás után ftálsav-anhidriddé alakul. Hideg vízben, éterben rosszul oldódik, forró vízben jobban oldható. Jól oldódik alkoholban.
Kémiai tulajdonságai
[szerkesztés]Kétértékű aromás karbonsav, a benzolgyűrűn a két karboxilcsoport orto-helyzetben található, ez befolyásolja a gyűrű tulajdonságait. A benzoesavnál lényegesen erősebb sav. Kétértékű savként normál és savanyú sókat képez, sóit ftalátoknak nevezzük. Alkoholokkal normál és savanyú észtereket alkot. A ftálsav adja a benzolgyűrűs vegyületekre jellemző elektrofil szubsztitúciós reakciókat (nitrálás, szulfonálás, halogénezés). A ftálsav benzolgyűrűje viszonylag könnyen hidrogénezhető. Kalciumsója kalcium-hidroxid-felesleg jelenlétében, hevítés hatására benzollá dekarboxileződik, és mellette kalcium-karbonát képződik.
Felhasználása
[szerkesztés]A ftálsavat főként ftálsav-anhidrid formában használják többek között festékek, parfümök, szacharin és ftalátok gyártásában.
Jegyzetek
[szerkesztés]- ↑ A különböző források eltérő értékeket adnak meg, például: (i) 480 K (207 °C, NIST weblap), (ii) 210−211 °C, bomlik (Sigma-Aldrich online), (iii) 191 °C zárt csőben (Ullmann's Encyclopedia of Industrial Chemistry), (iv) 230 °C ftálsav-anhidridre és vízre bomlással (J.T.Baker MSDS).
- ↑ a b c A ftálsav (BGIA GESTIS)[halott link] (németül)
- ↑ Dr. Otto – Albrecht Neumüller: Römpp vegyészeti lexikon. Budapest: Műszaki Könyvkiadó. 1982. 2 kötet., 221. o. ISBN 963-10-3269-8
- ↑ Fülöp József: Rövid kémiai értelmező és etimológiai szótár. Celldömölk: Pauz–Westermann Könyvkiadó Kft. 1998. 52. o. ISBN 963 8334 96 7


