Tallium-jodid
| tallium-jodid | |

| |
| __ Tl+ __ I− (168 °C felett) | |
| |
| Más nevek | tallium-monojodid tallium(I)-jodid |
| Kémiai azonosítók | |
| CAS-szám | 7790-30-9 |
| PubChem | 62679 |
| Kémiai és fizikai tulajdonságok | |
| Kémiai képlet | TlI |
| Moláris tömeg | 331,29 g·mol−1 |
| Megjelenés | szilárd anyag, 168°C alatt sárga, felette vörös |
| Sűrűség | 7,29 g/mol−1[1] |
| Olvadáspont | 442 °C |
| Forráspont | 824 °C |
| Oldhatóság (vízben) | oldhatatlan (6,3 mg/100 g)[1] |
| Kristályszerkezet | |
| Kristályszerkezet | rombos (~168 °C alatt)[1] |
| Tércsoport | Cmcm[1] |
| Rácsállandó | a = 458,2 pm[1] Å, b = 1292 pm[1] Å, c = 525,1 pm[1] Å |
| Veszélyek | |
| Főbb veszélyek | mérgező, egészségre veszélyes, környezetre veszélyes |
| R mondatok | R26/28 R33 R51/53 |
| S mondatok | (S1/2) S13 S28 S45 S61 |
| Gyúlékonyság | nem gyúlékony |
| Rokon vegyületek | |
| Azonos kation | tallium-fluorid tallium-klorid tallium-bromid |
| Azonos anion | gallium(I)-jodid indium(I)-jodid |
| Rokon vegyületek | higany(II)-jodid ólom(II)-jodid |
| Az infoboxban SI-mértékegységek szerepelnek. Ahol lehetséges, az adatok standardállapotra (100 kPa) és 25 °C-os hőmérsékletre vonatkoznak. Az ezektől való eltérést egyértelműen jelezzük. | |
A tallium-jodid talliumból és jódból álló kémiai vegyület, képlete TlI (TlI). Az ezüst-jodiddal, a higany(II)-jodiddal és az ólom(II)-jodidal együtt a kevés vízben oldhatatlan fém-jodid egyike.
Előállítása
[szerkesztés]Vizes oldatban bármely oldható talliumsó és jodidion reakciójával előállítható, így például elő lehet állítani tallium-szulfát vagy tallium-nitrát és kálium-jodid reakciójával.[1]
Fenolok tallium(I)-acetáttal segített jódozása során melléktermékként keletkezik.
Tulajdonságai
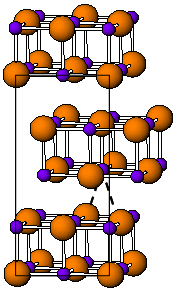
[szerkesztés]Két enantiotrop (egymásba átalakulni képes) kristálymódosulata van. 168 °C alatt[1] sárga színű, fényérzékeny, torzult nátrium-klorid szerkezetű rombos kristályokat alkot.[2] A torzult szerkezet feltehetően a kedvező tallium–tallium kölcsönhatás eredménye, a legkisebb Tl–Tl távolság 383 pm.[3] 168 °C (más források szerint 175 °C[4]) felett színe vörösre, szerkezete cézium-klorid típusú ráccsá változik. A fázisátmenet révén elektromos vezetőképessége két nagyságrenddel nő. A szerkezet szobahőmérsékletre hűtés után is megmarad egy darabig,[1] de a CsCl szerkezet szobahőmérsékleten is stabilizálható, ha a tallium-jodidhoz más jodidokat vagy tallium(I)-halogenidet – például RbI, CsI, KI, AgI, TlBr és TlCl – adalékolnak.[5] Lehetséges, hogy a szennyezők jelenléte felelős azért, hogy köbös és rombos fázisok együtt léteznek normál körülmények között.[6] Nagy – 160 kbar – nyomáson fémes vezetővé válik.[4]
Tallium(III)-jodiddá történő oxidációja nem megy végbe, ehelyett a Tl+I3− képletű tallium-trijodid keletkezik.
Felhasználása
[szerkesztés]Tallium(I)-bromiddal alkotott tallium-bromid-jodid elegykristályként az ATR (gyengített totálreflexiós) spektroszkópiában használják.[7] Higanylámpákba adva növeli azok teljesítményét.[8] Ezek fénye leginkább a látható színkép kék-zöld tartományába esik, melyet a víz kevésbé nyel el, ezért az ilyen lámpákat víz alatti világításra használják.[9] Nátrium-jodidhoz vagy cézium-jodidhoz nyomnyi mennyiségben adagolva szcintillátor előállítására használják, melyet a radioaktív sugárzás érzékelésére szolgáló szcintillációs detektorokban alkalmaznak.
Biztonság
[szerkesztés]Mint minden talliumvegyület, a tallium-jodid is erősen mérgező. Hőre érzékeny.
Jegyzetek
[szerkesztés]- ↑ a b c d e f g h i j Georg Brauer: Handbuch der präparativen anorganischen Chemie, Band 2; ISBN 3-432-87813-3, S. 876.
- ↑ Greenwood 321. o.
- ↑ Anja-Verena Mudring (2007). „Thallium Halides - New Aspects of the Stereochemical Activity of Electron Lone Pairs of Heavier Main-Group Elements”. European Journal of Inorganic Chemistry 2007 (6), 882–890. o. DOI:10.1002/ejic.200600975.
- ↑ a b Greenwood 322. o.
- ↑ S. Sultana et al. "Electrical conductivity in TlI–TiO2 composite solid electrolyte" Physica B: 404 (2009) 36
- ↑ R. P. Lowndes and C. H. Perry "Molecular structure and anharmonicity in thallium iodide" J. Chem. Phys. 58 (1973) 271 Archiválva 2012. július 10-i dátummal az Archive.is-en
- ↑ J Michael Hollas: Moderne Methoden in der Spektroskopie; ISBN 978-3-540-67008-7, S. 59.
- ↑ G. H. Reiling, "Characteristics of Mercury Vapor-Metallic Iodide Arc Lamps," J. Opt. Soc. Am. 54, 532 (1964)
- ↑ Underwater Journal and information bulletin, IPC Science and Technology Press, (1973), p 245
Fordítás
[szerkesztés]Ez a szócikk részben vagy egészben a Thallium(I)-iodid című német Wikipédia-szócikk ezen változatának fordításán alapul. Az eredeti cikk szerkesztőit annak laptörténete sorolja fel. Ez a jelzés csupán a megfogalmazás eredetét és a szerzői jogokat jelzi, nem szolgál a cikkben szereplő információk forrásmegjelöléseként.
Ez a szócikk részben vagy egészben a Thallium(I) iodide című angol Wikipédia-szócikk ezen változatának fordításán alapul. Az eredeti cikk szerkesztőit annak laptörténete sorolja fel. Ez a jelzés csupán a megfogalmazás eredetét és a szerzői jogokat jelzi, nem szolgál a cikkben szereplő információk forrásmegjelöléseként.
Források
[szerkesztés]- WebElements
- ↑ Greenwood: Greenwood, N.N.. Az elemek kémiája, 1., Budapest: Nemzeti Tankönyvkiadó (1999). ISBN 963-18-9144-5
