Sziálsav
A sziálsavak kilenc szénatomos vázú α-ketosav-cukrok.[1] A „sziálsav” elnevezést Gunnar Blix, svéd biokémikus vezette be 1952-ben. A leggyakoribb sziálsav az N-acetil-neuraminsav (Neu5Ac vagy NANA), mely az állatokban és egyes prokariótákban található. Ezek széles körben fordulnak elő állati szövetekben, és hasonló vegyületek megtalálhatók más szervezetekben, például mikroalgákban,[2] baktériumokban és archeákban.[3][4][5][6] Gyakran részei glikoproteineknek, glikolipideknek vagy gangliozidoknak, ahol a cukorlánc végén vannak a sejtfelszínen vagy oldékony fehérjékben.[7] Azonban Drosophila-embriókban és más rovarokban is észlelték.[8] A növényeknél azonban nem mutattak ki sziálsavakat.[9]
Emberben az agyban található a legtöbb sziálsav, ahol fontosak az ingerületátvitelben és a szinaptogenezishez szükséges gangliozidszerkezetben.[7] Több mint 50 sziálsav imert, melyek mindegyike szubsztituált amino- vagy hidroxilcsoportú neuraminsav-származék.[1] Általában az aminocsoporthoz acetil- vagy glikolilcsoport tartozik, de más csoport is lehet ott. E szubsztitúciók szövetspecifikusak és fejlődéskor szabályozottak, így az egyes sejtek glikokonjugátum-típusaiban csak egy részük található meg.[8] A hidroxilcsoport szubstituensei változatosak: ott észleltek acetil-, laktil-, metil-, szulfát- és foszfátcsoportot.[10]
Szerkezet
[szerkesztés]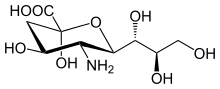
A sziálsavak közé tartozik a legtöbb neuraminsav-származék, de ezek ritkák a természetben. Általában mucinok, glikoproteinek és glikolipidek terminális, nem redukáló helyzetű komponensei a belső és külső membránban is, ahol kívül vannak, és fontos funkciókkal rendelkeznek.[7]

A szénatomok számozása a karboxilátnál kezdődik, és a lánc mentén folytatódik. Az α-anomer az axiális helyzetű karboxiláttal rendelkező.

Az α-anomer a glikánokhoz kötött sziálsavakban van. Azonban oldatban több mint 90%-ban β-anomerként van jelen. A sziálsav-mutarotázként működő bakteriális NanM képes gyorsan egyensúlyivá tenni az oldatot.[11]
Más állatoktól eltérően az ember nem tud N-glikolilneuraminsavat (Neu5Gc) előállítani, de kevés megtalálható humán szövetben külső forrásokból.[12]
Bioszintézis
[szerkesztés]A sziálsavat glükózamin-6-foszfátból és acetil-CoA-ból állítja elő egy transzferáz, N-acetilglükózamin-6-foszfáttá téve. Ebből epimerizációval N-acetilmannózamin-6-foszfát lesz, mely foszfoenolpiroszőlősavval reagálva N-acetilneuraminsav-9-foszfáttá (sziálsav) válik. Ennek aktívvá válásához és oligoszacharid-bioszintézisbe kerüléséhez citidin-trifoszfátból származó citidin-monofoszfátot kap, citidin-monofoszfát-sziálsavvá (CMP-sziálsav) téve azt. Ez az állati sejt magjában keletkezik.[13][14]
Baktériumokban aldoláz is előállíthat sziálsavakat. Ez például mannózszármazékot használ szubsztrátként, 3 szénatomot ad hozzá a piruvátból, sziálsavszerkezetet adva. Ezek kemoenzimatikus sziálsavszármazék-szintézisre használhatók.[15]

Funkció
[szerkesztés]A glikoprotein-tartalmú sziálsavak (szialoglikoproteinek) szelektint kötnek emberben és más élőlényekben. A rákáttétsejtek gyakran sok sziálsavgazdag glikoproteint expresszálnak. Ez negatív töltésűvé teszi a sejtmembránt, sejtközi taszítást okozva,[16] és segítve e késői ráksejtek véráramba kerülését. 2020-ban kimutatták a sziálsav jelenlétét rákos extracelluláris mátrixban.[17]
A sziálsavgazdag részek negatív töltést hoznak létre a sejtfelszínen. Mivel a víz poláris, mindkét hidrogénatomján parciális pozitív töltéssel, vonzódik a sejtfelszínekhez és -membránokhoz. Ez a sejt általi folyadékfelvételhez is hozzájárul.
A polisziálsav poszttranszlációs módosulás, mely idegsejt-adhéziós molekulákban (NCAM) jön létre. A szinapszisban a polisziálsav erős negatív töltése akadályozza a sejtek NCAM-keresztkötését.
Ösztrogén beadása ivartalanított egerekbe dózisfüggő sziálsavtartalom-csökkenést okoz. A sziálsavtartalommal az ösztrogén hatása is mérhető. Referenciaanyagok az ösztradiol (szubkután) és az etinilösztradiol (orális beadás).[18]
Immunitás
[szerkesztés]A sziálsavak minden gerinces és néhány gerinctelen, valamint egyes gerincesekkel kölcsönható baktériumok sejtfelszínein találhatók.
Több vírus, például az Ad26[19] adenovírus- (Adenoviridae)-szerotípus, a rotavírusok (Reoviridae) és az influenzavírusok (Orthomyxoviridae) gazda által szialilált szerkezeteket használhatnak a célgazdasejt kötéséhez. A sziálsavak jó célpontok e vírusokhoz, mivel erősen állandósultak, és nagy mennyiségben jelen vannak sok sejtben. A sziálsavak fontosak több humán vírusfertőzésben. Az influenzavírusok hemagglutininaktivitású (HA) glikoproteinekkel rendelkeznek, melyek a humán eritrociták és a felső légúti sejtek sziálsavjaihoz kötnek. Ez a hemagglutináció (a vírusok vérsejtekhez tapadása) és a vírusok bejutásának alapja. A Gyakori influenzagyógyszer ozeltamivir és zanamivir sziálsavanalógok, melyek az újonnan létrejött vírusokkal interferálnak a vírusenzim neuraminidáz gátlásával.[20]
Egyes baktériumok is a gazda által szialilált szerkezeteket használnak fel a kötéshez és a felismeréshez. Például a szabad sziálsavak egyes baktériumoknak, például a Pneumococcusnak jelzésként működhetnek. A szabad sziálsav segítheti a baktériumot annak felismerésében, hogy a kolóniaképzéshez megfelelő gerinces környezetet ért el. A sziálsav módosulása, például az N-glikolil- vagy O-acetilcsoport csökkenthetik a bakteriális szialidázok működését. Nem ismert e gátló hatás jelentősége.[20]
Metabolizmus
[szerkesztés]A sziálsav szintézise és bomlása a sejt különböző részeiben történik. A szintézis a citoszolban kezdődik, ahol az N-acetilmannózamin-6-foszfát és a foszfoenolpiruvát sziálsavvá egyesülnek. A Neu5Ac-9-foszfátot a magban citidin-monofoszfát (CMP) aktiválja a CMP-Neu5Ac-szintázzal. Bár a sziálsav és más vegyületek közti kapcsolat gyakran α-kötés, ez az egyetlen β-kötés. A CMP-Neu5Ac ezután az endoplazmatikus retikulumba vagy a Golgi-készülékbe kerül, ahol új glikokonjugátumot alkotva oligoszacharidhoz kerülhet. Ez O-acetilezéssel vagy -metilezéssel módosítható. Ha a glikokonjugátum érett, a sejtfelszínhez kerülhet.
A szialidáz a sziálsav-katabolizmus egyik legfontosabb enzimje. Sziálsavakat távolíthat el a sejtfelsíznről vagy a szérum glikokonjugátumairól. A szövetes állatokban a bomlásra hajlamos glikokonjugátumok endocitózissal kerülnek be. A késői endoszóma lizoszómával való egyesülése után a lizoszóma-szialidázok eltávolítják a sziálsavakat. Ezek aktivitása az O-acetilcsoportoktól függ. A szabad sziálsavak a citoszolba kerülnek a lizoszóma membránján keresztül. Ezután újabb glikokonjugátumok keletkezhetnek belőlül a Golgi-készülékben. A sziálsavak lebonthatók acilmannózaminra és piruvátra a citoszolikus acilneuraminát-liáz által.
Súlyos betegségek függnek a sziálsav-metabolizmus jelenlététől vagy hiányától. A szialidózis és a sziálsavhiány a NANS gén mutációival példa ilyen rendellenességre.[21]
Agyfejlődés
[szerkesztés]A sziálsavval kezelt fiatal patkányok felnőve jobban tanultak és jobb lett memóriájuk.[22] A sziálsavbevitel és a kognitív funkció közti összefüggés megjelent nagy mennyiségű sziálsavval etetett malacokban is.[23]

Betegségek
[szerkesztés]A sziálsavak számos humán betegséggel összefüggenek.
NANS-mutációs sziálsavhiány
[szerkesztés]Az N-acetilneuraminsav-szintáz (NANS) gén kétalléles recesszív mutációi súlyos betegséget okozhatnak, mely értelmi fogyatékosságot és alacsony testalkatot eredményez, mutatva a sziálsavak fontosságát az agyfejlődésben.[24] Rövidtávú sziálsav-kiegészítés per os nem mutatott jelentős előnyös hatást a biokémiai paraméterekben.[25]
Salla-kór
[szerkesztés]A Salla-kór különösen ritka betegség, az egyik legenyhébb szabadsziálsav-növekedési zavar,[26] de gyermekkori formája agresszív. E betegség tünete a mentális retardatio.[27] A 6. kromoszóma mutációja okozza ezen autoszomális recesszív kórt.[28] Nagyrészt az idegrendszert érinti,[26] és a lizoszomális raktározás hibáját okozza, melyet egy sziálsavhordozó hiánya okoz, mely a lizoszómamembránban van.[29] 2020-ban gyógyíthatatlan volt, a kezelés tüneti.[26]
Atherosclerosis
[szerkesztés]Az atherosclerosist okozó LDL-részekben alacsony a sziálsavszint.[30] Ilyen részek a kis nagy sűrűségű LDL-részecskék és az elektronegatív LDL.[30] Az alacsony sziálsavszint a kis nagy sűrűségű LDL-részecskékben növeli ezek artériafalakban lévő proteoglikánokhoz való vonzódását.[30]
Influenza
[szerkesztés]Minden influenza A-vírus-törzs sziálsavat igényel a sejtekhez csatlakozáshoz. Az egyes sziálsavformák az egyes influenza A-vírus-változatokhoz különböző mértékben kötődnek. Ez fontos a fertőzhető fajok meghatározásához.[31] Ha egy influenza A-vírust egy sziálsavreceptor felismer, a sejt azt bekebelezi, megfertőzve a sejtet.
Sziálsavak és más nem ulozonsavak (NulO) a prokariótákban
[szerkesztés]A sziálsavak gyakoriak a gerincesekben, ahol számos biológiai folyamatban részt vesznek. Eleinte az újszájúakban találták, de tekinthető egy 9 szénatomos monoszacharidokból álló család, a nem ulozonsavak (NulO) régebbi családjának részének is, melyeket 2015-ben találtak meg baktériumokban és archeákban.[32] Számos patogén baktérium sejtfelszíni jellemzőinek, például a lipo- vagy kapszula-poliszacharidoknak részei a sziálsavak, segítve a gazda nem specifikus immunválaszának megkerülését.[33] Egy 2009-es genomszintű elemzés sok szekvenált mikrobagenomot vizsgált, és kimutatta, hogy a NulO-szintézis útjai sokkal gyakoribbak az filogenetikai fán a korábban feltételezettnél.[34] Ezt támasztják elő 2020-as lektinfestéses tanulmányok és egy molekuláris felmérés prokarióta NulO-kon, kimutatva, hogy sok nem patogén környezeti törzs is termel bakteriális sziálsavakat.[35][36] Egyes anammox-baktériumok az erősen savas α-ketosavcsoport mellett semlegesítő báziscsoportokat (szabad aminokat) tartalmazó NulO-kat termelnek.[37] Hasonló sejtfelszíni sziálsavakat állítottak elő kémiai újramodellezéssel a sejtfelszíntöltés befolyásolásával a C5-ön lévő szabad aminnal, mely semlegesíti a C1 karboxilátját.[38]
Jegyzetek
[szerkesztés]- ↑ a b Varki, Ajit. Sialic Acids, in Essentials of Glycobiology. Cold Spring Harbor Press, Ch. 14. o. (2008). ISBN 9780879697709
- ↑ (2018. december 8.) „Identification of a Kdn biosynthesis pathway in the haptophyte Prymnesium parvum suggests widespread sialic acid biosynthesis among microalgae”. Journal of Biological Chemistry 293 (42), 16277–16290. o. DOI:10.1074/jbc.RA118.004921. PMID 30171074. PMC 6200933.
- ↑ Sialic Acids and Other Nonulosonic Acids, Sialic acids and other nonulosonic acids." Essentials of Glycobiology. Cold Spring Harbor Laboratory Press (2017. december 8.)
- ↑ (2020. december 8.) „Tackling the chemical diversity of microbial nonulosonic acids – a universal large-scale survey approach”. Chemical Science 11 (11), 3074–3080. o. DOI:10.1039/c9sc06406k. PMID 34122812. PMC 8157484.
- ↑ (2009. december 8.) „Innovations in host and microbial sialic acid biosynthesis revealed by phylogenomic prediction of nonulosonic acid structure”. Proceedings of the National Academy of Sciences 106 (32), 13552–13557. o. DOI:10.1073/pnas.0902431106. PMID 19666579. PMC 2726416.
- ↑ (2018. december 8.) „Exploration of the Sialic Acid World”. Adv Carbohydr Chem Biochem 75 (75), 1–213. o. DOI:10.1016/bs.accb.2018.09.001. PMID 30509400. PMC 7112061.
- ↑ a b c (2003) „The role and potential of sialic acid in human nutrition”. European Journal of Clinical Nutrition 57 (11), 1351–1369. o. DOI:10.1038/sj.ejcn.1601704. PMID 14576748.
- ↑ a b (1990) „Sialic acid binding lectins”. Experientia 46 (5), 433–441. o. DOI:10.1007/BF01954221. PMID 2189746.
- ↑ Varki, Ajit. Sialic Acids, in Essentials of Glycobiology. Cold Spring Harbor Press, Ch. 14. o. (2008). ISBN 9780879697709
- ↑ Schauer R. (2000). „Achievements and challenges of sialic acid research”. Glycoconj. J. 17 (7–9), 485–499. o. DOI:10.1023/A:1011062223612. PMID 11421344. PMC 7087979.
- ↑ Severi E, Müller A, Potts JR, Leech A, Williamson D, Wilson KS, Thomas GH (2008). „Sialic acid mutarotation is catalyzed by the Escherichia coli beta-propeller protein YjhT”. J Biol Chem 283 (8), 4841–91. o. DOI:10.1074/jbc.M707822200. PMID 18063573.
- ↑ Tangvoranuntakul, Pam (2003. október 14.). „Human uptake and incorporation of an immunogenic nonhuman dietary sialic acid”. PNAS 100 (21), 12045–12050. o. DOI:10.1073/pnas.2131556100. PMID 14523234. PMC 218710.
- ↑ Fulcher CA (2009. március). „MetaCyc Chimeric Pathway: superpathway of sialic acid and CMP-sialic acid biosynthesis”. MetaCyc.
- ↑ Warren, Leonard (1962). „The Biosynthesis of Sialic Acids”. The Journal of Biological Chemistry 237 (5), 1421. o. DOI:10.1016/S0021-9258(19)83718-3.
- ↑ Hai Yu (2006). „One-pot three-enzyme chemoenzymatic approach to the synthesis of sialosides containing natural and non-natural functionalities”. Nature Protocols 1 (5), 2485–2492. o. DOI:10.1038/nprot.2006.401. PMID 17406495. PMC 2586341.
- ↑ (2005) „The sweet and sour of cancer: Glycans as novel therapeutic targets”. Nature Reviews Cancer 5 (7), 526–42. o. DOI:10.1038/nrc1649. PMID 16069816.
- ↑ (2020) „Nanomotors Sense Local Physicochemical Heterogeneities in Tumor Microenvironments”. Angewandte Chemie 59 (52), 23690–23696. o. DOI:10.1002/anie.202008681. PMID 32918839. PMC 7756332.
- ↑ Jürgen Sandow. Ullmann's Encyclopedia of Industrial Chemistry, 7th, Wiley, 1–81. o.. DOI: 10.1002/14356007.a13_089 (2007). ISBN 978-3527306732
- ↑ Baker, Alexander T. (2019. szeptember 1.). „Human adenovirus type 26 uses sialic acid–bearing glycans as a primary cell entry receptor”. Science Advances 5 (9), eaax3567. o. DOI:10.1126/sciadv.aax3567. PMID 31517055. PMC 6726447.
- ↑ a b (2012) „Multifarious roles of sialic acids in immunity”. Ann N Y Acad Sci 1253 (1), 16–36. o. DOI:10.1111/j.1749-6632.2012.06517.x. PMID 22524423. PMC 3357316.
- ↑ (1998) „Structure, function and metabolism of sialic acids”. Cellular and Molecular Life Sciences 54 (12), 1330–1349. o. DOI:10.1007/s000180050258. PMID 9893709. PMC 7082800.
- ↑ Oliveros E, Vázquez E, Barranco A, Ramírez M, Gruart A, Delgado-García JM, Buck R, Rueda R, Martín MJ (2018). „Sialic Acid and Sialylated Oligosaccharide Supplementation during Lactation Improves Learning and Memory in Rats”. Nutrients 10 (10), E1519. o. DOI:10.3390/nu10101519. PMID 30332832. PMC 6212975.
- ↑ Wang B. (2012). „Molecular Mechanism Underlying Sialic Acid as an Essential Nutrient for Brain Development and Cognition”. Adv. Nutr. 3 (3), 465S–472S. o. DOI:10.3945/an.112.001875. PMID 22585926. PMC 3649484.
- ↑ van Karnebeek, Clara D. M. (2016. július 1.). „NANS-mediated synthesis of sialic acid is required for brain and skeletal development” (angol nyelven). Nature Genetics 48 (7), 777–784. o. DOI:10.1038/ng.3578. ISSN 1546-1718. PMID 27213289.
- ↑ Tran C, Turolla L, Ballhausen D, Buros SC, Teav T, Gallart-Ayala H, Ivanisevic J, Faouzi M, Lefeber DJ, Ivanovski I, Giangiobbe S, Caraffi SG, Garavelli L, Superti-Furga A (2021). „The fate of orally administered sialic acid: First insights from patients with N-acetylneuraminic acid synthase deficiency and control subjects”. Mol Genet Metab Rep. 28, 100777. o. DOI:10.1016/j.ymgmr.2021.100777. PMID 34258226. PMC 8251509.
- ↑ a b c Salla disease | Genetic and Rare Diseases Information Center (GARD) – an NCATS Program. [2016. július 22-i dátummal az eredetiből archiválva]. (Hozzáférés: 2023. április 16.)
- ↑ Free sialic acid storage disease. Orphanet . (Hozzáférés: 2019. február 21.)
- ↑ Ponsot, G. (2007). „Enfermedades por depósito de ácido siálico libre: enfermedad de Salla (incluida su forma infantil grave) y sialuria” (spanyol nyelven). EMC - Pediatría 42, 1–3. o. DOI:10.1016/S1245-1789(07)70257-3.
- ↑ Enfermedades por depósito de ácido siálico libre: Enfermedad de Salla (incluida su forma infantil grave) y sialuria (spanyol nyelven)
- ↑ a b c Ivanova EA, Myasoedova VA, Melnichenko AA, Grechko AV, Orekhov AN (2017). „Small Dense Low-Density Lipoprotein as Biomarker for Atherosclerotic Diseases”. Oxidative Medicine and Cellular Longevity 2017 (10), 1273042. o. DOI:10.1155/2017/1273042. PMID 28572872. PMC 5441126.
- ↑ Racaniello, Vincent: Influenza virus attachment to cells: role of different sialic acids. Virology Blog , 2009. május 5. (Hozzáférés: 2019. április 10.)
- ↑ Ajit, Varki. Sialic Acids and Other Nonulosonic Acids, Sialic acids and other nonulosonic acids, Essentials of Glycobiology, 3rd, Chapter 15: Cold Spring Harbor (NY): Cold Spring Harbor Laboratory Press, 2015–2017. o. (2015)
- ↑ Severi E. (2007). „Sialic acid utilization by bacterial pathogens”. Microbiology 153 (9), 2817–2822. o. DOI:10.1099/mic.0.2007/009480-0. PMID 17768226.
- ↑ Amanda, Lewis (2009). „Innovations in host and microbial sialic acid biosynthesis revealed by phylogenomic prediction of nonulosonic acid structure”. Proceedings of the National Academy of Sciences 106 (32), 13552–13557. o. DOI:10.1073/pnas.0902431106. PMID 19666579. PMC 2726416.
- ↑ Kleikamp, Hugo (2020). „Tackling the chemical diversity of microbial nonulosonic acids–a universal large-scale survey approach”. Chemical Science 11 (11), 3074–3080. o. DOI:10.1039/C9SC06406K. PMID 34122812. PMC 8157484.
- ↑ (2020. március 31.) „Decorating the Anammox House: Sialic Acids and Sulfated Glycosaminoglycans in the Extracellular Polymeric Substances of Anammox Granular Sludge”. Environ. Sci. Technol. 54 (8), 5218–5226. o. DOI:10.1021/acs.est.9b07207. PMID 32227885. PMC 7181257.
- ↑ Pabst, Martin (2021. augusztus 2.). „A general approach to explore prokaryotic protein glycosylation reveals the unique surface layer modulation of an anammox bacterium” (angol nyelven). The ISME Journal 16 (2), 346–357. o. DOI:10.1038/s41396-021-01073-y. ISSN 1751-7370. PMID 34341504. PMC 8776859.
- ↑ (2015) „Chemical Remodeling of Cell-Surface Sialic Acids through a Palladium-Triggered Bioorthogonal Elimination Reaction” (angol nyelven). Angewandte Chemie International Edition 54 (18), 5364–5368. o. DOI:10.1002/anie.201409145. ISSN 1521-3773. PMID 25765364.
Fordítás
[szerkesztés]Ez a szócikk részben vagy egészben a Sialic acid című angol Wikipédia-szócikk ezen változatának fordításán alapul. Az eredeti cikk szerkesztőit annak laptörténete sorolja fel. Ez a jelzés csupán a megfogalmazás eredetét és a szerzői jogokat jelzi, nem szolgál a cikkben szereplő információk forrásmegjelöléseként.
