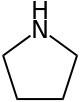
Pirrolidin
| Pirrolidin | |||
 |

| ||
| Más nevek | azolidin azaciklopentán tetrahidropirrol prolamin | ||
| Kémiai azonosítók | |||
|---|---|---|---|
| CAS-szám | 123-75-1 | ||
| PubChem | 31268 | ||
| ChemSpider | 29008 | ||
| ChEBI | 33135 | ||
| RTECS szám | UX9650000 | ||
| |||
| |||
| InChIKey | RWRDLPDLKQPQOW-UHFFFAOYSA-N | ||
| UNII | LJU5627FYV | ||
| ChEMBL | 22830 | ||
| Kémiai és fizikai tulajdonságok | |||
| Kémiai képlet | C4H9N | ||
| Moláris tömeg | 71,12 g/mol | ||
| Megjelenés | színtelen, átlátszó folyadék | ||
| Sűrűség | 0,866 g/cm³ | ||
| Olvadáspont | -63 °C | ||
| Forráspont | 87 °C | ||
| Oldhatóság (vízben) | elegyedik | ||
| Savasság (pKa) | 11,27 (konjugált sav pKa-ja vízben),[1] 19,56 (konjugált sav pKa-ja acetonitrilben)[2] | ||
| Mágneses szuszceptibilitás | −54,8·10−6 cm³/mol | ||
| Veszélyek | |||
| Főbb veszélyek | rendkívül gyúlékony, ártalmas, korrozív, lehetséges mutagén | ||
| NFPA 704 | |||
| R mondatok | R11-R20/21/22-R34[3] | ||
| S mondatok | S16-S26-S28-S36/37-S45 | ||
| Ha másként nem jelöljük, az adatok az anyag standardállapotára (100 kPa) és 25 °C-os hőmérsékletre vonatkoznak. | |||
A pirrolidin, más néven tetrahidropirrol szerves vegyület, képlete (CH2)4NH. Gyűrűs szekunder amin, telített heterociklusos vegyület. Színtelen folyadék, vízzel és a legtöbb szerves oldószerrel elegyedik. Szaga jellegzetes, ammóniára vagy halra emlékeztető.[4] Számos szubsztituált származéka is ismert.
Nevét a görög pyrrosz (πυρρός = tűzpiros) szóból kapta.[5]
Előállítása és előfordulása
[szerkesztés]1,4-butándiol és ammónia oxid katalizátor felett végzett reakciójával állítják elő.[6]
A természetes és szintetikus kémiában számos származéka előfordul. A pirrolidingyűrű számos természetes alkaloidban, például a nikotinban vagy a higrinben is megtalálható. Számos gyógyszermolekula szerkezetének is része, ilyen például a prociklidin és a bepridil, vagy a racetám vegyületek (pl. piracetám, aniracetám). Két aminosav, a prolin és a hidroxiprolin is szerkezetileg a pirrolidin származékának tekinthető.
Reakciói
[szerkesztés]Bázisos vegyület, bázicitása más dialkil-aminokhoz hasonló mértékű.[7] Más szekunder aminokhoz képest kitűnik kompaktságával, ami gyűrűs szerkezetének következménye.
Bonyolultabb szerves vegyületek szintézisének építőeleme. Egyik felhasználása, hogy enaminok képzésével a ketonok és aldehidek a nukleofil addíciós reakciókkal szemben aktiválhatóak:[8]
Jegyzetek
[szerkesztés]- ↑ (1957) „Correlation of the Base Strengths of Amines”. Journal of the American Chemical Society 79 (20), 5441–5444. o. DOI:10.1021/ja01577a030.
- ↑ (2005) „Extension of the Self-Consistent Spectrophotometric Basicity Scale in Acetonitrile to a Full Span of 28 pKa Units: Unification of Different Basicity Scales”. The Journal of Organic Chemistry 70 (3), 1019–1028. o. DOI:10.1021/jo048252w. PMID 15675863.
- ↑ MSDS
- ↑ Pyrrolidine, The Good Scents Company
- ↑ Fülöp József: Rövid kémiai értelmező és etimológiai szótár. Celldömölk: Pauz–Westermann Könyvkiadó Kft. 1998. 116. o. ISBN 963 8334 96 7
- ↑ Karsten Eller, Erhard Henkes, Roland Rossbacher, Hartmut Höke "Amines, Aliphatic" in Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim, 2005. doi:10.1002/14356007.a02_001
- ↑ H. K. Hall, Jr. (1957). „Correlation of the Base Strengths of Amines”. J. Am. Chem. Soc. 79 (20), 5441. o. DOI:10.1021/ja01577a030.
- ↑ R. B. Woodward, I. J. Pachter, and M. L. Scheinbaum (1974). „2,2-(Trimethylenedithio)cyclohexanone”. Org. Synth. 54, 39. o.; Coll. Vol. 6: 1014
Fordítás
[szerkesztés]Ez a szócikk részben vagy egészben a Pyrrolidine című angol Wikipédia-szócikk ezen változatának fordításán alapul. Az eredeti cikk szerkesztőit annak laptörténete sorolja fel. Ez a jelzés csupán a megfogalmazás eredetét és a szerzői jogokat jelzi, nem szolgál a cikkben szereplő információk forrásmegjelöléseként.