n-butil-amin
| n-butil-amin | |||
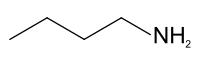 Az n-butil-amin szerkezeti képlete | |||

| |||
| Más nevek | 1-aminobután 1-butánamin monobutil-amin | ||
| Kémiai azonosítók | |||
|---|---|---|---|
| Rövidítés | NBA | ||
| CAS-szám | 109-73-9 | ||
| PubChem | 8007 | ||
| ChemSpider | 7716 | ||
| EINECS-szám | 203-699-2 | ||
| DrugBank | DB03659 | ||
| MeSH | n-butylamine | ||
| ChEBI | 43799 | ||
| RTECS szám | EO29750002 | ||
| |||
| InChIKey | HQABUPZFAYXKJW-UHFFFAOYSA-N | ||
| Beilstein | 605269 | ||
| Gmelin | 1784 | ||
| UNII | N2QV60B4WR | ||
| ChEMBL | 13968 | ||
| Kémiai és fizikai tulajdonságok | |||
| Kémiai képlet | C4H11N | ||
| Moláris tömeg | 73,14 g/mol | ||
| Megjelenés | színtelen folyadék | ||
| Szag | halszerű, ammóniás | ||
| Sűrűség | 740 mg ml−1 | ||
| Olvadáspont | -49 °C | ||
| Forráspont | 77–79 °C | ||
| Oldhatóság (vízben) | elegyedik | ||
| Lúgosság (pKb) | 3,22 | ||
| Mágneses szuszceptibilitás | −58,9·10−6 cm³/mol | ||
| Törésmutató (nD) | 1,401 | ||
| Viszkozitás | 500 µPa s (20 °C-on) | ||
| Gőznyomás | 9,1 kPa (20 °C-on) | ||
| kH | 570 μmol Pa−1 kg−1 | ||
| Megoszlási hányados | 1,056 | ||
| Termokémia | |||
| Std. képződési entalpia ΔfH |
−128,9–−126,5 kJ mol−1 | ||
| Égés standard- entalpiája ΔcH |
−3,0196–−3,0174 MJ mol−1 | ||
| Hőkapacitás, C | 188 J K−1 mol−1 | ||
| Veszélyek | |||
| NFPA 704 | |||
| Lobbanáspont | −7 °C | ||
| Öngyulladási hőmérséklet | 312 °C | ||
| Robbanási határ | 1,7–9,8% | ||
| PEL | C 5 ppm (15 mg/m³) [bőr][2] | ||
| LD50 | 366 mg kg−1 (patkány, szájon át) 626 mg kg−1 (nyúl, bőrön) 430 mg kg−1 (egér, szájon át) 430 mg kg−1 (tengeri malac, szájon át)[1] | ||
| Ha másként nem jelöljük, az adatok az anyag standardállapotára (100 kPa) és 25 °C-os hőmérsékletre vonatkoznak. | |||
Az n-butil-amin az aminok közé tartozó szerves vegyület, képlete CH3(CH2)3NH2. A bután négy izomer aminjának egyike, a másik három a szek-butil-amin, a terc-butil-amin és az izobutil-amin. Színtelen, az aminokra jellemző hal- vagy ammóniára emlékeztető szagú folyadék. Minden szerves oldószerben oldódik. Levegőn tárolás hatására megsárgul.
Szintézise és reakciói
[szerkesztés]Ammónia és alkoholok alumínium-oxid felett végzett reakciójával állítják elő:
- CH3(CH2)3OH + NH3 → CH3(CH2)3NH2 + H2O
Reakciói a többi egyszerű amin jellegzetességeit mutatják: protonálás, alkilezés, acilezés, kondenzációs reakció karbonilvegyületekkel. A többi egyszerű alifás aminhoz hasonlóan gyenge bázis, a [CH3(CH2)3NH3]+ pKa értéke 10,78.[3]
A koordinációs kémiában gyakran használják ligandumként a fémionok, pl. Pt2+, Pd2+ koordinálására, melyekkel tetrabutilamino és dibutilamino komplexeket képez.[4][5]
Felhasználása
[szerkesztés]Peszticidek (például tiokarbazidok), gyógyszerek és emulgeálószerek gyártásához használják fel. Ezen kívül kiindulási anyag a gumi vulkanizálását gyorsító N,N′-dibutilkarbamid, valamint a nylon lágyítószereként használt n-butil-benzolszulfonamid gyártásának. A Fengabin, a benomil és butamoxán nevű gombaölőszer, valamint a cukorbetegség elleni tolbutamid előállításához is használják.[6]

Toxicitása
[szerkesztés]Patkányoknál szájon át adva LD50 értéke 366 mg/kg.[7]
Bőrrel érintkezve a megengedett munkahelyi expozíció határértéke az USA-ban 5 ppm (15 mg/m³).[8]
Jegyzetek
[szerkesztés]- ↑ a b N-Butylamine. Immediately Dangerous to Life and Health Concentrations (IDLH). National Institute for Occupational Safety and Health (NIOSH)
- ↑ a b c NIOSH Pocket Guide to Chemical Hazards #0079. National Institute for Occupational Safety and Health (NIOSH)
- ↑ H. K. Hall, Jr. (1957). „Correlation of the Base Strengths of Amines”. J. Am. Chem. Soc. 79, 5441-5444. o. DOI:10.1021/ja01577a030.
- ↑ (2017. szeptember 11.) „Quantitative Analysis of Different Formation Modes of Platinum Nanocrystals Controlled by Ligand Chemistry”. Nano Letters 17 (10), 6146–6150. o. DOI:10.1021/acs.nanolett.7b02751.
- ↑ (2018. május 22.) „Dish-like higher-ordered palladium nanostructures through metal ion-ligand complexation”. Nano Research 11 (6), 3442–3452. o. DOI:10.1007/s12274-018-1993-0.
- ↑ Karsten Eller, Erhard Henkes, Roland Rossbacher, Hartmut Höke, "Amines, Aliphatic" Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim, 2005.doi:10.1002/14356007.a02_001
- ↑ n-Butylamine MSDS. [2013. november 12-i dátummal az eredetiből archiválva]. (Hozzáférés: 2019. március 6.)
- ↑ CDC - NIOSH Pocket Guide to Chemical Hazards
Fordítás
[szerkesztés]- Ez a szócikk részben vagy egészben a N-Butylamine című angol Wikipédia-szócikk ezen változatának fordításán alapul. Az eredeti cikk szerkesztőit annak laptörténete sorolja fel. Ez a jelzés csupán a megfogalmazás eredetét és a szerzői jogokat jelzi, nem szolgál a cikkben szereplő információk forrásmegjelöléseként.

