Nátrium-klorát
| Nátrium-klorát | |||
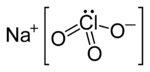 A nátrium-klorát szerkezeti képlete | |||
 nátrium-klorát por | |||
| IUPAC-név | nátrium-klorát | ||
| Más nevek | nátrium-klorát(V) | ||
| Kémiai azonosítók | |||
|---|---|---|---|
| CAS-szám | 7775-09-9 | ||
| PubChem | 516902 | ||
| ChemSpider | 22895 | ||
| EINECS-szám | 231-887-4 | ||
| KEGG | C18765 | ||
| MeSH | Sodium+chlorate | ||
| ChEBI | 65242 | ||
| RTECS szám | FO0525000 | ||
| |||
| |||
| InChIKey | YZHUMGUJCQRKBT-UHFFFAOYSA-M | ||
| UNII | T95DR77GMR | ||
| Kémiai és fizikai tulajdonságok | |||
| Kémiai képlet | NaClO3 | ||
| Moláris tömeg | 106,44 g mol−1 | ||
| Megjelenés | színtelen vagy fehér, higroszkópos szilárd anyag | ||
| Szag | szagtalan | ||
| Sűrűség | 2,49 g/cm³ (15 °C)[1] 2,54 g/cm³ (20,2 °C)[2] | ||
| Olvadáspont | 248-261 °C | ||
| Forráspont | 300-400 °C | ||
| Oldhatóság (vízben) | 79 g/100 ml (0 °C) 89 g/100 ml (10 °C) 105,7 g/100 ml (25 °C) 125 g/100 ml (40 °C) 220,4 g/100 ml (100 °C)[3] | ||
| Oldhatóság | oldódik glicerinben, hidrazinban, metanolban Kevéssé oldódik etanolban, ammóniában[1] | ||
| Oldhatóság (aceton) | 51,8 g/100 g[1] | ||
| Oldhatóság (glicerin) | 20 g/100 g (15,5 °C)[1] | ||
| Oldhatóság (etanol) | 14,7 g/100 g[1] | ||
| Mágneses szuszceptibilitás | −34,7·10−6 cm³/mol | ||
| Törésmutató (nD) | 1,515 (20 °C)[4] | ||
| Gőznyomás | <0,35 mPa[2] | ||
| Kristályszerkezet | |||
| Kristályszerkezet | köbös | ||
| Termokémia | |||
| Std. képződési entalpia ΔfH |
−365,4 kJ/mol[1] | ||
| Standard moláris entrópia S |
129,7 J/mol·K[1] | ||
| Hőkapacitás, C | 104,6 J/mol·K[1] | ||
| Veszélyek | |||
| NFPA 704 | |||
| Lobbanáspont | nem lobbanékony | ||
| LD50 | 6500 mg/kg (patkány, szájon át) 700 mg/kg (kutya, szájon át)[1] | ||
| Rokon vegyületek | |||
| Azonos kation | nátrium-klorid nátrium-hipoklorit nátrium-klorit nátrium-perklorát nátrium-bromát nátrium-jodát | ||
| Azonos anion | ammónium-klorát kálium-klorát bárium-klorát | ||
| Ha másként nem jelöljük, az adatok az anyag standardállapotára (100 kPa) és 25 °C-os hőmérsékletre vonatkoznak. | |||
A nátrium-klorát a nátrium szervetlen vegyülete, formálisan a klórsavval alkotott sója. Képlete NaClO3. Fehér, higroszkópos, vízben jól oldódó kristályos anyag. Erős oxidálószer, 300 °C hőmérséklet felett – oxigén leadása közben – nátrium-kloridra bomlik.[4] Évente több százmillió tonnát gyártanak, ennek nagy részét a papíriparban használják fel fehérítéséhez.[6]
Szénnel, kénnel, vörösfoszforral, fűrészporral keverve ütés, dörzsölés, gyors hevítés hatására felrobbanhat. Higroszkópossága miatt a pirotechnikában általában nátrium-nitráttal vagy kálium-kloráttal keverik, illetve helyettesítik, hobbi célból azonban gyakran használják, mivel nátrium-kloridból is előállítható házilag, így hozzáférhetőbb, mint a kálium-klorát. Régebben gyomirtónak is használták. Európában gyomirtónak való használata tiltva van. Ha egyéb mezőgazdasági vegyszerekkel, pl. kénnel keveredik, meg kell nedvesíteni, így kizárható a begyulladás és/vagy robbanás.
Előállítása
[szerkesztés]Iparilag forró telített nátrium-klorid oldat elektrolízisével állítják elő. Az egyszerűsített bruttó reakció az alábbi:[6]
- NaCl(aq) + 3 H2O(l) ⟶ NaClO3(aq) + 3 H2(g)
Előállítható úgy is, ha forró tömény nátrium-hidroxid oldatba elemi klórt vezetnek, majd a kapott terméket kristályosítással tisztítják.
- 3 Cl2(g) +6 NaOH(aq) ⟶ NaClO3(aq) +5 NaCl(aq) + 3 H2O(l)
Források
[szerkesztés]- N. N. Greenwood – A. Earnshaw: Az elemek kémiája. Budapest: Nemzeti Tankönyvkiadó. 2004. 1174. o. ISBN 963-19-5255-X
Fordítás
[szerkesztés]Ez a szócikk részben vagy egészben a Sodium chlorate című angol Wikipédia-szócikk ezen változatának fordításán alapul. Az eredeti cikk szerkesztőit annak laptörténete sorolja fel. Ez a jelzés csupán a megfogalmazás eredetét és a szerzői jogokat jelzi, nem szolgál a cikkben szereplő információk forrásmegjelöléseként.
Hivatkozások
[szerkesztés]- ↑ a b c d e f g h i j k http://chemister.ru/Database/properties-en.php?dbid=1&id=786
- ↑ a b GPS Safety Summary of Sodium Chlorate. http://www.arkema.com . Arkema. [2014. május 25-i dátummal az eredetiből archiválva]. (Hozzáférés: 2014. május 25.)
- ↑ Seidell, Atherton. Solubilities of Inorganic and Organic Compounds. Van Nostrand (1952)
- ↑ a b [1] from PubChem
- ↑ a b c Sigma-Aldrich Co., Sodium chlorate. Retrieved on 2014-05-25.
- ↑ a b Helmut Vogt, Jan Balej, John E. Bennett, Peter Wintzer, Saeed Akbar Sheikh, Patrizio Gallone “Chlorine Oxides and Chlorine Oxygen Acids” in Ullmann's Encyclopedia of Industrial Chemistry 2002, Wiley-VCH. doi:10.1002/14356007.a06_483

