Citromsavciklus

A citromsavciklus (más néven Szent-Györgyi–Krebs-ciklus, Krebs-ciklus, trikarbonsavciklus, citrátkör) alapvető fontosságú anyagcsere-folyamat minden olyan élő sejtben, amely oxigént használ a sejtlégzés folyamatában.
Ezekben az aerob organizmusokban a citromsavciklus annak az anyagcsere-útvonalnak a része, amelyben a szénhidrátok, zsírok és fehérjék CO2-dá és vízzé alakulnak, miközben energia termelődik.
A szénhidrátlebontás és ATP-termelés folyamatában végbemenő négy anyagcsere-útvonalból ez a harmadik. A megelőző kettő a glikolízis és a piruvátoxidáció, a következő pedig a légzési lánc.
A citromsavciklusban előanyagok (prekurzorok) is termelődnek (például aminosavak), és néhány reakciója fontos olyan sejtekben is, melyek fermentációt végeznek.
A Szent-Györgyi–Krebs-ciklus felfedezőiről, Szent-Györgyi Albertről és Hans Adolf Krebsről kapta a nevét. Szent-Györgyit 1937-ben a citrátkör egyes reakcióinak kutatásáért (és a C-vitamin vizsgálatáért),[1] Krebst pedig 1953-ban a citrátkör felfedezéséért Nobel-díjjal jutalmazták.[2]
Áttekintés
[szerkesztés]|
aminosav-bioszintézis
és -oxidáció |
A folyamatban két szénatom CO2-dá oxidálódik, az elektronok NAD-ra és ubikinonra kerülnek, tiszta nyereségnek a GTP tekinthető.
| szubsztrát | koenzim | enzim | reakciótípus | inibitor | aktivátor | reakciótermék | |
|---|---|---|---|---|---|---|---|
| 1 | oxálecetsav | acetil-CoA, H2O | citrát-szintáz | kondenzáció | citrát, NADH, szukcinil-CoA | – | citrát |
| 2a | citrát | – | akonitáz | dehidráció | – | – | cisz-akonitát, H2O |
| 2b | cisz-akonitát | H2O | hidratáció | izocitrát | |||
| 3a | izocitrát | NAD+ | izocitrát-dehidrogenáz | oxidáció | NADH, ATP | Ca2+, ADP | oxálszukcinát, NADH |
| 3b | oxálszukcinát | H+ | dekarboxiláció | α-ketoglutarát, CO2 | |||
| 4 | α-ketoglutarát | NAD+, CoA-SH | α-ketoglutarát-dehidrogenáz | oxidatív dekarboxiláció | NADH, szukcinil-CoA | Ca2+ | szukcinil-CoA, NADH, CO2 |
| 5 | szukcinil-CoA | GDP, foszfát | szukcinil-CoA-szintetáz | foszforilálás | – | – | szukcinát, GTP, CoA-SH |
| 6 | szukcinát | FAD | szukcinát-dehidrogenáz | oxidáció | – | – | fumarát, ubikinol[3] |
| 7 | fumarát | H2O | fumaráz | hidratáció | – | – | L-malát |
| 8 | L-malát | NAD+ | malát-dehidrogenáz | oxidáció | – | – | oxálecetsav, NADH |
A folyamatok egyszerűsített áttekintése
[szerkesztés]
- A citromsavciklus elején az acetil-CoA átadja a két szénatomos acetilcsoportját a négy szénatomból álló oxálacetát molekulának és így citrát (citromsav) keletkezik (6 szénatomos).
- A citrát ezután több átalakuláson megy keresztül, először az egyik, majd a másik karboxilcsoportját is elveszti CO2 formájában.
- A folyamat oxidatív lépései során felszabaduló energia nagyenergiájú elektronok formájában a NAD+-hoz jut és NADH képződik belőlük. Minden citromsavciklusba került acetilcsoportból három molekula NADH képződik.
- Az elektronfelvételre képes FAD-ra kerülő elektronokat ubikinonnak adja, redukálva ubikinollá.
- A 4 szénatomos oxálecetsav-molekula minden ciklus végén újraképződik és a ciklus folytatódik.
Reakciótermékek
[szerkesztés]Egy ciklus alatt egy GTP, három NADH, egy ubikinol és két CO2 keletkezik.
Mivel minden glükózmolekulából két acetil-CoA keletkezik, glükózmolekulánként két ciklusra van szükség. Ebből kifolyólag mindenből a duplája képződik: kettő GTP, hat NADH, kettő ubikinol és négy CO2.
| leírás | reaktáns | termékek |
| A citromsavciklus reakcióinak összesített egyenlete: | acetil-CoA + 3 NAD+ + ubikinon + GDP + Pi + 2 H2O | → CoA-SH + 3 NADH + 3 H+ + ubikinol + GTP + 2 CO2 |
| Ha összegezzük a piruvát dekarboxiláció és a citromsavciklus során fellépő reakciókat, a következő összesített egyenletet kapjuk (piruvát oxidáció a légzési lánc előtt): | piruvát + 4 NAD+ + ubikinon + GDP + Pi + 2 H2O | → 4 NADH + 4 H+ + ubikinol + GTP + 3 CO2 |
| Ha ezekhez hozzátesszük még a glikolízis reakciót is, a következő összesített egyenletet kapjuk a teljes glükózoxidációról a légzési lánc előtt: | glükóz + 10 NAD+ + 2 ubikinon + 2 ADP + 2 GDP + 4 Pi + 2 H2O | → 10 NADH + 10 H+ + 2 ubikinol + 2 ATP + 2 GTP + 6 CO2 |
A fenti reakciók akkor vezetnek egyensúlyra, ha a Pi a H2PO4- iont, az ADP és a GDP rendre az ADP2- és a GDP2- iont, az ATP és a GTP rendre az ATP3- és a GTP3- ionokat jelölik).
Ha számításba vesszük, hogy a GTP később ATP-vé alakul és a maximum 28 ATP-t, ami a 10 NADH-ből és a 2 ubikinolból keletkezik az oxidatív foszforiláció során, azt kapjuk, hogy egy glükózmolekulából maximálisan 30-32 ATP-molekula képződhet.
A citromsavciklus lépései
[szerkesztés]1. reakció: citrát-szintáz
[szerkesztés]
 |
A ciklus első reakciójában citrát képződik. Az acetil-CoA oxálacetáttal citrátot képez kondenzációs, majd hidrolitikus reakció során. Az irreverzibilis reakciót (ΔG'°=-31,4 kJ/mol) a citrát-szintáz enzim katalizálja. Az enzim először a mitokondriumban alacsony koncentrációban jelen levő oxálacetátot köti, majd egy konformációváltozás után az acetil-CoA is kötődni tud. Köztitermékként citril-CoA képződik, ebből H2O belépésével CoA szabadul fel. A magas magas csoportátviteli potenciájú tioészterkötés hidrolízise a reakciót erősen exergonikussá teszi, ami azért fontos, mert az oxálacetát koncentrációja alacsony. A szubsztrátok kötődési sorrendje azért fontos, mert így az enzim nem tudja az acetil-CoA-t hidrolizálni. A tioészterkötés hidrolízisének feltétele a citril-CoA létrejöttéhez kötődő konformációváltozás. A reakció terméke, a citrát tovább alakulhat a mitokondriumban, vagy a transzportrendszeren keresztül a citoszolba kerülhet. A citrát citoszolba történő transzportja a mitokondriumban képződő acetil-CoA citoszolba jutását szolgálja, ahol főleg zsírsavak és koleszterin szintézisére használódik fel valamint a NADPH termelését is lehetővé teszi. |
 |
2. reakció: akonitáz
[szerkesztés]
 |
A mitokondriumban maradó citrát reverzibilis izomerizáció során átalakulhat izocitráttá. A folyamat kétlépéses és átmeneti dehidratálással jár. A reakciót az akonitáz enzim katalizálja, amely egy FeS-központot tartalmaz. A központ a szubsztrátkötésben, a vízaddícióban és a dehidrációban is szerepet játszik. A cisz-akonitát, mely köztitermékként jön létre, az enzimhez kötődik. Egyensúlyi állapotban csak 6-7%-ban izomerizálódik a citrát, de a folyamat az aktuális koncentrációktól függ, ami folyamatosan változik a sejt energiaállapota szerint. Az izocitrát fogyásának sebessége az izocitrát-dehidrogenáz enzim aktivitásától függ. |
 |
3. reakció: izocitrát-dehidrogenáz
[szerkesztés]
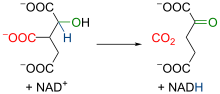 |
Az izocitrát-dehidrogenáz enzim az első dehidrogenálást katalizálja. A reakció során α-ketoglutarát és CO2 keletkezik, egy NAD+-molekula pedig redukálódik. Az irreverzibilis reakció oxidatív dekarboxilálás. Az α-ketoglutarát a mitokondriumban különböző folyamatokban vehet részt. |
 |
4. reakció: α-ketoglutarát-dehidrogenáz
[szerkesztés]
 |
Az α-ketoglutarát-dehidrogenáz enzimkomplex működése a piruvát-dehidrogenáz enzimkomplexhez hasonló. Ez az enzim az α-ketoglutarát szukcinil-koenzim-A-vá való átalakulását katalizálja. A reakció irreverzibilis oxidatív dekarboxilezés, melynek során az alfa-ketosav oxidációjából származó energia segítségével magas csoportátviteli potenciálú tioészterkötés jön létre. A komplex három enzimből épül fel: α-ketoglutarát-dehidrogenáz, dihidrolipoil-transzszukciniláz és dihidrolipoil-reduktáz. Ugyanazok a kofaktorok szükségesek a működéshez itt, mint a piruvát-dehidrogenáz-komplex esetében. A folyamatban szukcinil-CoA és CO2 képződik, valamint egy NAD+-molekula redukálódik. A piruvát-dehidrogenázzal ellentétben ez a komplex nem tartalmaz kinázt és foszfatázt. A szukcinil-CoA a porfirinszintézis előanyaga, ezért távozhat a körfolyamatból. |
 |
5. reakció: szukcinil-CoA-szintetáz
[szerkesztés]
 |
A szukcinil-CoA-szintetáz enzim a szukcinil-CoA hidrolízisét katalizálja, melynek során CoA és szukcinát keletkezik. A magas csoportátviteli potenciálú reakcióhoz kapcsolt reakció a foszforiltranszfer. Első lépésként a reakcióban átmenetileg maga az enzim, majd GDP foszforilálódik GTP-vé – mely energetikailag ekvivalens az ATP-vel. A reakció szubsztrátszintű foszforiláció, melyben nagy energiájú kötés alakul ki a légzési lánctól függetlenül. |
 |
6. reakció: szukcinát-dehidrogenáz
[szerkesztés]
 |
A szukcinát-dehidrogenáz enzim a szukcinát fumaráttá való oxidációját katalizálja. Ebben a lépésben kapcsolódik a citromsavciklus a légzési lánchoz. Az enzim több FeS központot tartalmazó flavoprotein. A reverzibilis reakció sztereospecifikus, kizárólag fumarát képződik. Az enzim a többitől eltérően a mitokondrium belső membránjában helyezkedik el és a terminális oxidációs légzési lánc II. komplexének része. Az enzimhez kovalensen kötött FAD redukálódik és a keletkező FADH2 hidrogénjei redukálják az ubikinont. |
 |
7. reakció: fumaráz
[szerkesztés]
 |
A fumaráz enzim által katalizált reakcióban egy proton (H+) és egy OH- csoport kapcsolódik a fumaráthoz transz helyzetben, melyek egy vízmolekulából származnak. Az addíció sztereospecifikus, kizárólag a malát L-izomerje képződik, ellenkező irányban is csak fumarát képződhet. (A maleát, a fumarát cisz-izomerje és a D-malát nem szubsztrátja az enzimnek.) |
 |
8. reakció: malát-dehidrogenáz
[szerkesztés]
 |
A ciklus utolsó enzime, a malát-dehidrogenáz a malát oxálacetáttá való átalakulását katalizálja. Az enzim a NAD+ koenzimmel működik. A reakció ΔG'°=+29,7 kJ/mol ellenére reverzibilis. Az egyensúlyi koncentrációviszonyok szerint a reakció a malátképződés irányába lenne eltolva. Az aktuális oxálacetát-koncentráció azonban igen alacsony (10−6 M), illetve a reakció NADH/NAD+ arány szerint tolódhat az oxálacetát irányába. |
 |
Szabályzás
[szerkesztés]Bár a piruvát-dehidrogenáz gyakorlatilag nem része a citromsavciklusnak, mégis fontos szerepet játszik benne.
A citromsavciklus több enzimét negatív feedback-ként szabályozza az ATP, ha nagy a sejt energiatöltete (energy charge). Ide tartozik a piruvát-dehidrogenáz, a citrát-szintáz, az izocitrát dehidrogenáz és az alfa-ketoglutarát dehidrogenáz is. Ezek az enzimek, melyek a citromsavciklus első három lépését szabályozzák, gátlódnak, ha megnő az ATP koncentrációja. Ez a szabályzás biztosítja, hogy a citromsavciklus ne oxidáljon piruvátot és acetil-CoA-t, ha elegendő ATP van a sejtben. A negatív feedback alloszterikus mechanizmus által megy végbe.
Több enzim negatívan szabályozódik, mikor a redukáló ekvivalensek szintje magas a sejtben (magas NADH/NAD+ arány). Ez a szabályzómechanizmus NADH szubsztrát-inhibíciója (gátlás) során valósul meg, azokon az enzimeken, melyeknek a NAD+ a szubsztátja. Ide tartozik a piruvát-dehidrogenáz, a citrát-szintáz, az izocitrát-dehidrogenáz és az alfa-ketoglutarát-dehidrogenáz.
A kalcium regulátor szerepet játszik. Aktiválja a piruvát-dehidrogenázt, az izocitrát-dehidrogenázt és az oxoglutarát-dehidrogenázt. Ez megnöveli a reakciósebességet a ciklus több lépésében és növeli a fluxust a metabolikus útvonal egészében.
A citrát feedback gátlást végez, mivel gátolja a foszfofruktokináz enzimet, ami a glikolízisben fruktóz-1,6-bifoszfátot állít elő, ami a piruvát prekurzora (előanyaga).
Ez meggátolja az állandó magas fluxust, ha felgyülemlik a citrát és csökken a enzim számára szükséges szubsztrát mennyisége.
Főbb anyagcsereútvonalak, amelyek a citromsavciklusban egyesülnek
[szerkesztés]A legtöbb katabolikus (lebontó) anyagcsere-útvonal a citromsavciklusban egyesül. Azokat a reakciókat, amelyek a citromsavciklus köztitermékeit hozzák létre, (azért, hogy feltöltsék azt, ha kevés van belőlük) anaplerotikus reakcióknak nevezzük.
A citromsavciklus a szénhidrát-lebontás (cukorbontás) harmadik lépése. A glikolízis során a glükóz (6 C atom) piruvátra (3 C atom) bomlik. Az eukariótákban a piruvát a mitokondriumba jut és itt acetil-CoA-vá alakul a piruvát dekarboxiláció során, majd belép a citromsavciklusba.
A fehérjebontásban a fehérjéket proteáz enzimek aminosavakra bontják. Ezek az aminosavak bejutnak a sejtbe és ott energiává alakulhatnak a citromsavciklusban.
A zsírbontásban a trigliceridek hidrolizálnak, melynek eredményeképp zsírsavak és glicerin keletkezik.
A májban a glicerin glükózzá alakul dihidroxiaceton-foszfáton és glicerilaldehid-3-foszfáton keresztül a glükoneogenezis folyamatában.
Sok szövetben – különösképpen a szívizomszövetben – a zsírsavak a béta-oxidáció folyamatában bomlanak tovább, melynek eredményeképpen acetil-CoA keletkezik és ez beléphet a citromsavciklusba. Néha a béta-oxidáció során propionil-CoA jön létre, ami további glükóz képződéséhez használódik fel a májban.
A citromsavciklust minden esetben oxidatív foszforiláció követi.
A folyamat energiát von el (elektronok formájában) a NADH-tól és a ubikinoltól ezeket NAD+-dá és ubikinonná oxidálva, a körfolyamat tehát folytatódhat. A citromsavciklus maga nem használ fel oxigént, de az oxidatív foszforiláció igen.
Egy glükózmolekula teljes lebontásakor tehát (a glikolízis, a citromsavciklus és az oxidatív foszforiláció során) 36 ATP-molekula képződik.
A citromsavciklust amfibolikus anyacsere-útvonalnak nevezik, mert anabolikus és katabolikus folyamatokban is szerepet játszik.
Jegyzetek
[szerkesztés]- ↑ http://www.nobelprize.org/nobel_prizes/medicine/laureates/1937/
- ↑ http://www.nobelprize.org/nobel_prizes/medicine/laureates/1953/
- ↑ Bánhegyi Gábor, Sipeki Szabolcs - Biokémia, molekuláris és sejtbiológia ISBN 9789633310137
- ↑ H. Lauble, C. D. Stout: Steric and conformational features of the aconitase mechanism. In: Proteins 22, S. 1-11 , 1995
- ↑ Mesecar, A.D., Stoddard, B.L., Koshland Jr., D.E. Orbital steering in the catalytic power of enzymes: small structural changes with large catalytic consequences. Science v277 pp.202-206 , 1997
- ↑ Knapp, J.E., Carroll, D., Lawson, J.E., Ernst, S.R., Reed, L.J., Hackert, M.L. Expression, purification, and structural analysis of the trimeric form of the catalytic domain of the Escherichia coli dihydrolipoamide succinyltransferase. Protein Sci. v9 pp.37-48 , 2000
- ↑ Fraser, M.E., James, M.N., Bridger, W.A., Wolodko, W.T. Phosphorylated and dephosphorylated structures of pig heart, GTP-specific succinyl-CoA synthetase. J.Mol.Biol. v299 pp.1325-1339, 2000
- ↑ V. Yankovskaya, R. Horsefield, S. Tornroth, C. Luna-Chavez, H. Miyoshi, C. Leger, B. Byrne, G. Cecchini, S. Iwata: Architecture of succinate dehydrogenase and reactive oxygen species generation. In: Science 299, S. 700-704, 2003
- ↑ Weaver, T., Lees, M., Zaitsev, V., Zaitseva, I., Duke, E., Lindley, P., McSweeny, S., Svensson, A., Keruchenko, J., Keruchenko, I., Gladilin, K., Banaszak, L. Crystal structures of native and recombinant yeast fumarase. J.Mol.Biol. v280 pp.431-442, 1998
- ↑ Tomita, T., Fushinobu, S., Kuzuyama, T., Nishiyama, M.: Structural basis for alteration of cofactor specificity of malate dehydrogenase from Thermus flavus
Források
[szerkesztés]- Neil A. Campbell, Jane B. Reece. Biology, 7th ed., Benjamin Cummings (2005. Dec). ISBN 978-0805371468
- Solomon, E.P., Berg, L.R., Martin, D.W.. Biology. Brooks Cole (2005. Mar). ISBN 978-0534495480
- Dr. Ádám Veronika, Dux L., Faragó A., Fésüs L., Machovich R., Mandl J., Sümegi B.. Orvosi biokémia, 2. kiadás, Medicina (2001. Mar). ISBN 963-2426916
További információk
[szerkesztés]- Animáció a citromsavciklusról – Smith College
- Citromsavciklus. YouTube
- Megjegyzések a citromsavciklussal kapcsolatban Archiválva 2008. május 22-i dátummal a Wayback Machine-ben – rahulgladwin.com
- Részletes animáció Archiválva 2005. június 25-i dátummal a Wayback Machine-ben – johnkyrk.com
- citromsavciklus-teszt Archiválva 2008. július 6-i dátummal a Wayback Machine-ben – Pittsburghi Egyetem
- A citromsavciklus logikája – ufp.pt
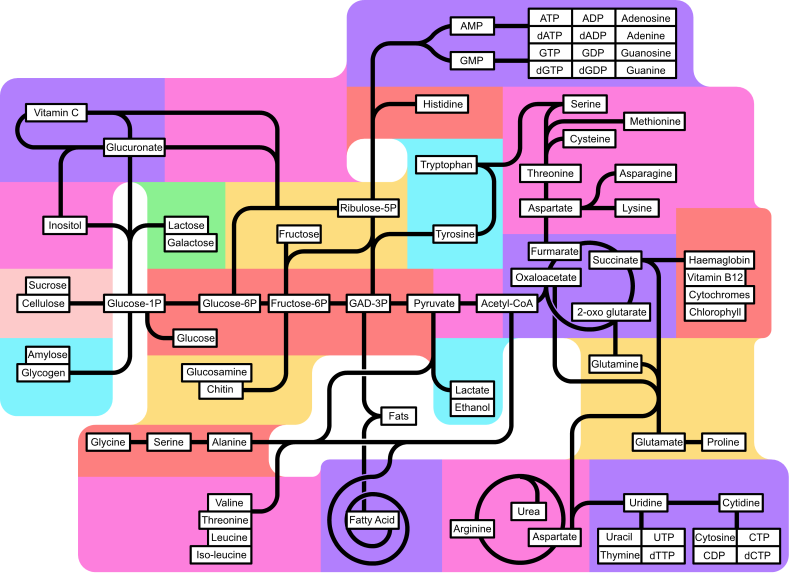
| A citromsavciklus anyagcsere-útvonala | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
A metabolikus útvonalak áttekintése
[szerkesztés]|
Más cukrok anyagcseréje |