Aromásszénhidrogén-receptor
| Aromásszénhidrogén-receptor | |
| Azonosítók | |
| Jel | AHR, bHLHe76, RP85 |
| OMIM | 600253 |
| RefSeq | NM_001621 |
| UniProt | P35869 |
| PDB | 7ZUB |
| Egyéb adatok | |
| Lokusz | 7. krom. p21.1 |
Az aromásszénhidrogén-receptor (röviden AhR, AHR, ahr, ahR, más néven AH-receptor vagy dioxinreceptor) az AHR gén által kódolt fehérje. Ez a génexpressziót szabályzó transzkripciós faktor. Eredetileg xenobiotikum-érzékelő és enzimeket, például a citokróm P450-et szabályzó anyagnak gondolták. A legfontosabb ilyen xenobiotikumok az aromás szénhidrogének, melyekből a receptor neve is származik.
Később kiderült, hogy az AhR-t számos endogén indolszármazék, például a kinurenin aktiválja vagy deaktiválja. A metabolikus enzimek szabályzása mellett az AhR szerepet játszik az immunregulációban, az őssejtkezelésben és a sejtdifferenciációban.[1][2][3]
Az aromásszénhidrogén-receptor a bázikus hélix-gyűrű-hélix transzkripciós faktorok közé tartozik. Számos exogén ligandumot, például növényi flavonoidokat, polifenolokat és indolokat köt, valamint szintetikus policiklikus aromás szénhidrogéneket és dioxinszerű vegyületeket. Az AhR általában inaktív citoszol-transzkripciósfaktor, mely több társchaperonhoz kötődik. Vegyületekhez, például 2,3,7,8-tetraklórdibenzo-p-dioxinhoz (TCDD) kötve a chaperonok disszociálnak, így az AhR a sejtmagba kerül, és dimerizálódik az ARNT-vel (AhR-magitranszlokátor), megváltoztatva a géntranszkripciót.
Funkciós doménjei
[szerkesztés]
Az AhR több funkciójához fontos domént tartalmaz, és a bázikus hélix-gyűrű-hélix/Per-Arnt-Sim (bHLH/PAS) transzkripciósfaktor-család tagja.[4][5] A bHLH a fehérjén N-terminális helyzetű, és számos transzkripciós faktorban jelen van.[6] A bHLH-szupercsalád tagjaiban 2 eltérő működésű, nagy állandóságú domén található. Az első a bázikus (b) régió, mely a transzkripciós faktor DNS-kötésében fontos. A másik a hélix-gyűrű-hélix (HLH), mely megkönnyíti a fehérje-fehérje interakciókat. Része továbbá két PAS domén, a PAS-A és a PAS-B, melyek a Drosophila period (Per), single-minded (Sim) génjeinek, valamint az AhR partnerének, az ARNT-nak doménjeihez nagy homológiát mutató 200-350 aminosavas szakaszok.[7] A PAS domének segítenek másodlagos interakciókat más PAS-tartalmú fehérjékkel, mint ami az AhR és az ARNT esetén fennáll, így dimer és heteromer komplexek keletkezhetnek. Az AhR ligandumkötő helye a PAS-B doménben van,[8] és számos, a ligandumkötéshez fontos állandó aminosavat tartalmaz.[9] A fehérje C-terminális végén glutamin- (Q-) gazdag domén van, mely a koaktivátorok működtetésében és a transzaktivációban fontos.[10]
Ligandumok
[szerkesztés]Az AhR-ligandumok 2 kategóriába sorolhatók: szintetikusak vagy természetben előfordulók. Az első felfedezett ligandumok szintetikusak voltak, és halogénezett aromás vegyületek (poliklórozott dibenzodioxinok, dibenzofuránok és bifenilek) és policiklusos aromás szénhidrogének (3-metilkolantrén, benzo[a]pirén, benzantracének és benzoflavonok) voltak.[11][12] Számos szintetikus ligandumot terveztek mellrákkezelésre.[13]
Kutatások folytak természetesen előforduló vegyületekre is endogén ligandum azonosítására. Természetes Ahr-ligandumok például triptofánszármazékok, például az indigófesték és az indirubin,[14] tetrapirrolok, például a bilirubin,[15] az arachidonsav-metabolit lipoxin A4 és prosztaglandin G,[16] módosult alacsony sűrűségű lipoprotein[17] és bizonyos étkezési karotinoidok.[12] Feltételezték korábban, hogy az endogén ligandum receptoragonista, azonban Savouret et al. kimutatta, hogy nem feltétlenül igaz ez, mivel a 7-ketokoleszterin teljesen gátolja az Ahr jelátvitelét.[18]
A karbidopa szelektív aromásszénhidrogénreceptor-modulátor (SAhRM).[19] További SAhRM-ek például a mikrobiális eredetű 1,4-dihidroxi-2-naftoesav[20] és a növényi eredetű 3,3-diindolilmetán.[21]
Az indolokarbazol (ICZ) az egyik legerősebb nem halogénezett AhR-agonista in vitro.[22]
Ligandumfüggetlen AhR-aktivitás látható az emlős-AhR-ben. Az emlős-AhR-nek nincs szüksége exogénligandum-függő aktivációra a működéshez, és szerepet játszhat egyes transzformáló növekedési faktor β (TGF-b)-izoformák expressziójában. Ez nem azt jelenti, hogy a ligandumdependens AhR-aktiváció nem szükséges az AhR-működéshez, hanem hogy ha szükséges ligandum, azt endogén módon biztosítják ismeretlen sejtek vagy szövetek.[23]
Jelzőútvonal
[szerkesztés]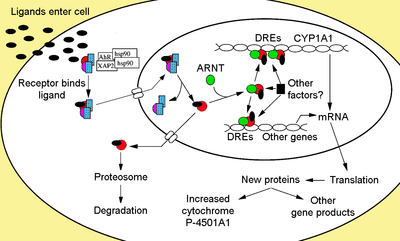

Citoszolkomplex
[szerkesztés]A nem ligandumkötött AhR a citoplazmában van inaktív fehérjekomplexként, mely Hsp90-dimerből,[24][25] prosztaglandin E-szintáz 3-ból (PTGES3, p23),[26][27][28][29] egy immunofilin szerű AH-receptorral kölcsönható proteinből, más néven hepatitis B-vírus X-asszociált protein 2-ből (XAP2),[30] AhR-kölcsönható proteinből (AIP)[31][32] és AhR-aktivált 9-ből (ARA9) áll.[33] A Hsp90-dimer a PTGES3-mal (p23) több funkciót lát el: védi a receptort a proteolízistől, a receptort ligandumkötést lehetővé tevő konformációban rögzíti, és megakadályozza az idő előtti ARNT-kötést.[8][27][29][34][35][36] Az AIP a Hsp90 C-terminusával kölcsönhat, és az AhR magi lokalizációs szekvenciájához (NLS) köt, megakadályozva a receptor nem megfelelő áthelyezését a magba.[37][38][39]
TGF-β-jelzőútvonal
[szerkesztés]A TGF-β citokinek egy jelzőfehérje-család tagjai, melynek tagjai az aktivin, a Nodal-alcsalád, csontmorfogeetikai fehérjék, növekedési és differenciációs faktorok és a Müller-inhibitor-alcsalád. A TGF-β-jelzés fontos a sejtfiziológiában és -fejlődésben: gátolja a sejtproliferációt, segíti az apoptózist, indukálja a differenciációt, és meghatározza a sejt fejlődését állatokban.[40] TGF-β-aktivátorok például a plazmin, katepszin, a kalpain, a trombospondin 1, egy angiogenezis-gátló glikoprotein és a mátrix-metalloproteináz 2 (MMP-2). A sejtközi mátrix fontos szabályzó szereppel rendelkezik a TGF-β-jelzésben.[41][42]
Receptoraktiváció
[szerkesztés]Az AhR ligandumkötésekor felszabadul az AIP, felfedve a bHLH-n lévő NLS-t,[43] lehetővé téve a magba jutást.[44] Feltételezések szerint a magban a Hsp90 lebomlik, felfedve a két PAS domént, lehetővé téve az ARNT kötését.[36][45][46][47] Az aktivált AhR/ARNT heterodimer képes közvetlenül vagy közvetve kölcsönhatni a DNS-sel a dioxinreszponzív gének 5’-szabályzórégiójában lévő felismerő szakaszokkal.[36][46][48]
DNS-kötés (xenobiotikus válaszelem – XRF)
[szerkesztés]Az AhR/ARNT komplex AhR-, dioxin- vagy xenobiotikum-reszponzív elemnek (AHRE, DRE, XRE) nevezett klasszikus felismerési motívuma tartalmazza az 5’-GCGTG-3’ magszekvenciát[49] az 5’-T/GNGCGTGA/CG/CA-3’ konszenzusszekvenciában[50][51] az AhR-reszponzív gének promoterén belül. Az AhR/ARNT heterodimer közvetlenül aszimmetrikusan kötődik az AHRE/DRE/XRE-magszekvenciához: az ARNT az 5’-GTG-3’, az AhR az 5’-TC/TGC-3’ részhez kötődik.[52][53][54] 2004-ben feltételezték, hogy egy másik elem, az AHRE-II (5’-CATG(N6)C[T/A]TG-3’) képes közvetett kapcsolatra az AhR/ARNT komplexszel.[55][56] Válaszelemtől függetlenül az eredmény számos változás a génexpresszióban.
Fiziológiai és toxikológiai szerepe
[szerkesztés]Szerepe a fejlődésben
[szerkesztés]Az evolúció tekintetében az AhR legrégebbi fiziológiai szerepe nem ismert. Az AhR feltehetően gerinctelenekből fejlődött, ahol ligandumfüggetlen szerepe volt normál fejlődési folyamatokban.[57] A Drosophila AhR-homológja, a spineless (ss) szükséges a csápok és a lábak disztális részének fejlődéséhez.[58][59] Az ss az emlősök Arnt fehérjéjével homológ tango (tgo) fehérjével dimert alkot, elindítva a géntranszkripciót. A receptor fejlődése gerincesekben lehetővé tette ligandumok kötését, és segíthette az embert a füstös tüzek tolerálásában. A fejlődő gerincesekben az AhR szerepet játszhat a sejtproliferációban és -differenciációban.[60] Bár nincs egyértelmű endogén liganduma, az AhR szerepet játszhat számos fejlődési útvonal differenciációjában, beleértve a hematopoiesist,[61] lymphoid systems,[62][63] a T-sejteket,[64] a neuronokat[65] és a hepatocitákat.[66] Az AhR fontos funkcióval rendelkezhet a vérképző őssejtekben: az AhR-antagonizmus segíti megújulásukat és ex vivo növekedésüket,[67] és fontos a megakariociták differenciációjában.[68] Felnőttkorban a jelzés a stresszválasszal függ össze, és az AhR-mutációk összefüggnek a major depresszióval.[69]
Adaptív és veleszületett válasz
[szerkesztés]Az adaptív válasz a xenobiotikumbontó enzimek indukciójában jelenik meg. E válaszra az első bizonyítékot a citokróm P450 1A1 (Cyp1a1) indukciójában figyelték meg, melyet a TCDD-kitettség okozott, mely közvetlenül kapcsolódik az AhR-útvonal aktivációjához.[70][71][72] Más AhR-ligandumok által indukált metabolikus gének keresése a DRE-k jelenléte miatt I-es és II-es fázisú metabolikus enzimekből álló „AhR-gén-csoportot” mutatott ki, ide tartozó enzimek a CYP1A1, a CYP1A2, a CYP1B1, az NQO1, az ALDH3A1, az UGT1A2 és a GSTA1.[73] Feltehetően a gerincesekben ennek célja a széles körben való vegyületészlelés, melyet a számos szubsztrát jelez, melyekhez az AhR kötődni tud, megkönnyítve biológiai átalakulásukat és ürülésüket. Az AhR jelezheti mérgező vegyületek jelenlétét az ételben, ilyen ételek elkerülését okozva.[74]
Az AhR-aktiváció fontos lehet az immunválaszban és a gyulladásgátlásban[63] az interleukin-22 erősítésével[75] és a Th17-válasz csökkentésével.[76] Az AHR-gyengítés általában a veleszületett immunitás génjeinek expresszióját csökkenti a THP-1 sejtekben.[77]
Toxikus válasz
[szerkesztés]Az adaptív válasz kiterjesztései az AhR-aktiváció által kiváltott toxikus válaszok. Ennek oka két különböző AhR-jelzési mód. Az első az adaptív válasz mellékhatása, ekkor az anyagcsereenzimek indukciója mérgező metabolitok termelését okozza. Például a benzo[a]pirén, egy AhR-ligandum indukálja saját metabolizmusát és mérgező metabolittá való bioaktivációját a CYP1A1 és CYP1B1 indukciójával egyes szövetekben.[78] A másik mérgezési útvonal az AhR-géncsoporton túli globális géntranszkripció változása révén történik. Ezek a sejtfolyamatok és -funkciók negatív változását okozzák.[79] Mikrocsoport-elemzéssel lehetett ezt legjobban megérteni és jellemezni.[60][80][81][82]
A xenobiotikumbontó enzimek segítik az anyagcserefolyamatot a vegyületek átalakításával és exkréciójával. A legerősebb CYP1A1-indukáló a 2,3,7,8-tetraklórdibenzo-p-dioxin (TCDD). Ezenkívül a TCDD számos biokémiai és toxikus hatást okoz, például teratogenezist, immunszupressziót és tumorpromóciót. A legtöbb TCDD és PAH-k okozta hatást az AhR mediálja, mely erősen kapcsolódik ezekhez.[40]
Fehérje-fehérje kölcsönhatások
[szerkesztés]A fent említetteken kívül az alábbi fehérjékkel is kölcsönhatásba lép az AhR:
Jegyzetek
[szerkesztés]- ↑ Esser C. The Aryl Hydrocarbon Receptor in Immunity: Tools and Potential, Suppression and Regulation of Immune Responses, Methods in Molecular Biology, 239–57. o.. DOI: 10.1007/978-1-4939-3139-2_16 (2016). ISBN 978-1-4939-3138-5
- ↑ Kawajiri K, Fujii-Kuriyama Y (2017. május 1.). „The aryl hydrocarbon receptor: a multifunctional chemical sensor for host defense and homeostatic maintenance”. Experimental Animals 66 (2), 75–89. o. DOI:10.1538/expanim.16-0092. PMID 27980293. PMC 5411294.
- ↑ Gutiérrez-Vázquez C, Quintana FJ (2018. január 1.). „Regulation of the Immune Response by the Aryl Hydrocarbon Receptor”. Immunity 48 (1), 19–33. o. DOI:10.1016/j.immuni.2017.12.012. PMID 29343438. PMC 5777317.
- ↑ Burbach KM, Poland A, Bradfield CA (1992. szeptember 1.). „Cloning of the Ah-receptor cDNA reveals a distinctive ligand-activated transcription factor”. Proceedings of the National Academy of Sciences of the United States of America 89 (17), 8185–8189. o. DOI:10.1073/pnas.89.17.8185. PMID 1325649. PMC 49882.
- ↑ Fukunaga BN, Probst MR, Reisz-Porszasz S, Hankinson O (1995. december 1.). „Identification of functional domains of the aryl hydrocarbon receptor”. The Journal of Biological Chemistry 270 (49), 29270–29278. o. DOI:10.1074/jbc.270.49.29270. PMID 7493958.
- ↑ Jones S (2004). „An overview of the basic helix-loop-helix proteins”. Genome Biology 5 (6), 226. o. DOI:10.1186/gb-2004-5-6-226. PMID 15186484. PMC 463060.
- ↑ Ema M, Sogawa K, Watanabe N, Chujoh Y, Matsushita N, Gotoh O, Funae Y, Fujii-Kuriyama Y (1992. április 1.). „cDNA cloning and structure of mouse putative Ah receptor”. Biochemical and Biophysical Research Communications 184 (1), 246–253. o. DOI:10.1016/0006-291X(92)91185-S. PMID 1314586.
- ↑ a b Coumailleau P, Poellinger L, Gustafsson JA, Whitelaw ML (1995. október 1.). „Definition of a minimal domain of the dioxin receptor that is associated with Hsp90 and maintains wild type ligand binding affinity and specificity”. The Journal of Biological Chemistry 270 (42), 25291–25300. o. DOI:10.1074/jbc.270.42.25291. PMID 7559670.
- ↑ Goryo K, Suzuki A, Del Carpio CA, Siizaki K, Kuriyama E, Mikami Y, Kinoshita K, Yasumoto K, Rannug A, Miyamoto A, Fujii-Kuriyama Y, Sogawa K (2007. március 1.). „Identification of amino acid residues in the Ah receptor involved in ligand binding”. Biochemical and Biophysical Research Communications 354 (2), 396–402. o. DOI:10.1016/j.bbrc.2006.12.227. PMID 17227672.
- ↑ Kumar MB, Ramadoss P, Reen RK, Vanden Heuvel JP, Perdew GH (2001. november 1.). „The Q-rich subdomain of the human Ah receptor transactivation domain is required for dioxin-mediated transcriptional activity”. The Journal of Biological Chemistry 276 (45), 42302–42310. o. DOI:10.1074/jbc.M104798200. PMID 11551916.
- ↑ Denison MS, Pandini A, Nagy SR, Baldwin EP, Bonati L (2002. szeptember 1.). „Ligand binding and activation of the Ah receptor”. Chemico-Biological Interactions 141 (1–2), 3–24. o. DOI:10.1016/S0009-2797(02)00063-7. PMID 12213382.
- ↑ a b c Denison MS, Nagy SR (2003). „Activation of the aryl hydrocarbon receptor by structurally diverse exogenous and endogenous chemicals”. Annual Review of Pharmacology and Toxicology 43, 309–334. o. DOI:10.1146/annurev.pharmtox.43.100901.135828. PMID 12540743.
- ↑ Baker JR, Sakoff JA, McCluskey A (2020. május 1.). „The aryl hydrocarbon receptor (AhR) as a breast cancer drug target”. Medicinal Research Reviews 40 (3), 972–1001. o. DOI:10.1002/med.21645. PMID 31721255.
- ↑ Adachi J, Mori Y, Matsui S, Takigami H, Fujino J, Kitagawa H, Miller CA, Kato T, Saeki K, Matsuda T (2001. augusztus 1.). „Indirubin and indigo are potent aryl hydrocarbon receptor ligands present in human urine”. The Journal of Biological Chemistry 276 (34), 31475–31478. o. DOI:10.1074/jbc.C100238200. PMID 11425848.
- ↑ Sinal CJ, Bend JR (1997. október 1.). „Aryl hydrocarbon receptor-dependent induction of cyp1a1 by bilirubin in mouse hepatoma hepa 1c1c7 cells”. Molecular Pharmacology 52 (4), 590–599. o. DOI:10.1124/mol.52.4.590. PMID 9380021.
- ↑ Seidel SD, Winters GM, Rogers WJ, Ziccardi MH, Li V, Keser B, Denison MS (2001). „Activation of the Ah receptor signaling pathway by prostaglandins”. Journal of Biochemical and Molecular Toxicology 15 (4), 187–196. o. DOI:10.1002/jbt.16. PMID 11673847.
- ↑ McMillan BJ, Bradfield CA (2007. január 1.). „The aryl hydrocarbon receptor is activated by modified low-density lipoprotein”. Proceedings of the National Academy of Sciences of the United States of America 104 (4), 1412–1417. o. DOI:10.1073/pnas.0607296104. PMID 17227852. PMC 1783125.
- ↑ Savouret JF, Antenos M, Quesne M, Xu J, Milgrom E, Casper RF (2001. február 1.). „7-ketocholesterol is an endogenous modulator for the arylhydrocarbon receptor”. The Journal of Biological Chemistry 276 (5), 3054–3059. o. DOI:10.1074/jbc.M005988200. PMID 11042205.
- ↑ Safe S (2017. november 1.). „Carbidopa: a selective Ah receptor modulator (SAhRM)”. The Biochemical Journal 474 (22), 3763–3765. o. DOI:10.1042/BCJ20170728. PMID 29109131.
- ↑ Cheng Y, Jin UH, Davidson LA, Chapkin RS, Jayaraman A, Tamamis P, Orr A, Allred C, Denison MS, Soshilov A, Weaver E, Safe S (2017. február 1.). „Editor's Highlight: Microbial-Derived 1,4-Dihydroxy-2-naphthoic Acid and Related Compounds as Aryl Hydrocarbon Receptor Agonists/Antagonists: Structure-Activity Relationships and Receptor Modeling”. Toxicological Sciences 155 (2), 458–473. o. DOI:10.1093/toxsci/kfw230. PMID 27837168. PMC 5291215.
- ↑ Yin XF, Chen J, Mao W, Wang YH, Chen MH (2012. május 1.). „A selective aryl hydrocarbon receptor modulator 3,3'-Diindolylmethane inhibits gastric cancer cell growth”. Journal of Experimental & Clinical Cancer Research 31 (1), 46. o. DOI:10.1186/1756-9966-31-46. PMID 22592002. PMC 3403951.
- ↑ Wincent E, Shirani H, Bergman J, Rannug U, Janosik T (2009. február 1.). „Synthesis and biological evaluation of fused thio- and selenopyrans as new indolocarbazole analogues with aryl hydrocarbon receptor affinity”. Bioorganic & Medicinal Chemistry 17 (4), 1648–1653. o. DOI:10.1016/j.bmc.2008.12.072. PMID 19186062.
- ↑ Denison MS, Pandini A, Nagy SR, Baldwin EP, Bonati L (2002. szeptember 1.). „Ligand binding and activation of the Ah receptor”. Chemico-Biological Interactions 141 (1–2), 3–24. o. DOI:10.1016/S0009-2797(02)00063-7. PMID 12213382.
- ↑ Denis M, Cuthill S, Wikström AC, Poellinger L, Gustafsson JA (1988. szeptember 1.). „Association of the dioxin receptor with the Mr 90,000 heat shock protein: a structural kinship with the glucocorticoid receptor”. Biochemical and Biophysical Research Communications 155 (2), 801–807. o. DOI:10.1016/S0006-291X(88)80566-7. PMID 2844180.
- ↑ Perdew GH (1988. szeptember 1.). „Association of the Ah receptor with the 90-kDa heat shock protein”. The Journal of Biological Chemistry 263 (27), 13802–13805. o. DOI:10.1016/S0021-9258(18)68314-0. PMID 2843537.
- ↑ Cox MB, Miller CA (2004. március 1.). „Cooperation of heat shock protein 90 and p23 in aryl hydrocarbon receptor signaling”. Cell Stress & Chaperones 9 (1), 4–20. o. DOI:10.1379/460.1. PMID 15270073. PMC 1065305.
- ↑ a b Kazlauskas A, Poellinger L, Pongratz I (1999. május 1.). „Evidence that the co-chaperone p23 regulates ligand responsiveness of the dioxin (Aryl hydrocarbon) receptor”. The Journal of Biological Chemistry 274 (19), 13519–13524. o. DOI:10.1074/jbc.274.19.13519. PMID 10224120.
- ↑ Kazlauskas A, Sundström S, Poellinger L, Pongratz I (2001. április 1.). „The hsp90 chaperone complex regulates intracellular localization of the dioxin receptor”. Molecular and Cellular Biology 21 (7), 2594–2607. o. DOI:10.1128/MCB.21.7.2594-2607.2001. PMID 11259606. PMC 86890.
- ↑ a b Shetty PV, Bhagwat BY, Chan WK (2003. március 1.). „P23 enhances the formation of the aryl hydrocarbon receptor-DNA complex”. Biochemical Pharmacology 65 (6), 941–948. o. DOI:10.1016/S0006-2952(02)01650-7. PMID 12623125.
- ↑ Meyer BK, Pray-Grant MG, Vanden Heuvel JP, Perdew GH (1998. február 1.). „Hepatitis B virus X-associated protein 2 is a subunit of the unliganded aryl hydrocarbon receptor core complex and exhibits transcriptional enhancer activity”. Molecular and Cellular Biology 18 (2), 978–988. o. DOI:10.1128/MCB.18.2.978. PMID 9447995. PMC 108810.
- ↑ Ma Q, Whitlock JP (1997. április 1.). „A novel cytoplasmic protein that interacts with the Ah receptor, contains tetratricopeptide repeat motifs, and augments the transcriptional response to 2,3,7,8-tetrachlorodibenzo-p-dioxin”. The Journal of Biological Chemistry 272 (14), 8878–8884. o. DOI:10.1074/jbc.272.14.8878. PMID 9083006.
- ↑ a b Zhou Q, Lavorgna A, Bowman M, Hiscott J, Harhaj EW (2015. június 1.). „Aryl Hydrocarbon Receptor Interacting Protein Targets IRF7 to Suppress Antiviral Signaling and the Induction of Type I Interferon”. The Journal of Biological Chemistry 290 (23), 14729–14739. o. DOI:10.1074/jbc.M114.633065. PMID 25911105. PMC 4505538.
- ↑ Carver LA, Bradfield CA (1997. április 1.). „Ligand-dependent interaction of the aryl hydrocarbon receptor with a novel immunophilin homolog in vivo”. The Journal of Biological Chemistry 272 (17), 11452–11456. o. DOI:10.1074/jbc.272.17.11452. PMID 9111057.
- ↑ Carver LA, Jackiw V, Bradfield CA (1994. december 1.). „The 90-kDa heat shock protein is essential for Ah receptor signaling in a yeast expression system”. The Journal of Biological Chemistry 269 (48), 30109–30112. o. DOI:10.1016/S0021-9258(18)43782-9. PMID 7982913.
- ↑ Pongratz I, Mason GG, Poellinger L (1992. július 1.). „Dual roles of the 90-kDa heat shock protein hsp90 in modulating functional activities of the dioxin receptor. Evidence that the dioxin receptor functionally belongs to a subclass of nuclear receptors which require hsp90 both for ligand binding activity and repression of intrinsic DNA binding activity”. The Journal of Biological Chemistry 267 (19), 13728–13734. o. DOI:10.1016/S0021-9258(18)42274-0. PMID 1320028.
- ↑ a b c Whitelaw M, Pongratz I, Wilhelmsson A, Gustafsson JA, Poellinger L (1993. április 1.). „Ligand-dependent recruitment of the Arnt coregulator determines DNA recognition by the dioxin receptor”. Molecular and Cellular Biology 13 (4), 2504–2514. o. DOI:10.1128/MCB.13.4.2504. PMID 8384309. PMC 359572.
- ↑ Carver LA, LaPres JJ, Jain S, Dunham EE, Bradfield CA (1998. december 1.). „Characterization of the Ah receptor-associated protein, ARA9”. The Journal of Biological Chemistry 273 (50), 33580–33587. o. DOI:10.1074/jbc.273.50.33580. PMID 9837941.
- ↑ Petrulis JR, Hord NG, Perdew GH (2000. december 1.). „Subcellular localization of the aryl hydrocarbon receptor is modulated by the immunophilin homolog hepatitis B virus X-associated protein 2”. The Journal of Biological Chemistry 275 (48), 37448–37453. o. DOI:10.1074/jbc.M006873200. PMID 10986286.
- ↑ Petrulis JR, Kusnadi A, Ramadoss P, Hollingshead B, Perdew GH (2003. január 1.). „The hsp90 Co-chaperone XAP2 alters importin beta recognition of the bipartite nuclear localization signal of the Ah receptor and represses transcriptional activity”. The Journal of Biological Chemistry 278 (4), 2677–2685. o. DOI:10.1074/jbc.M209331200. PMID 12431985.
- ↑ a b Mimura J, Fujii-Kuriyama Y (2003. február 1.). „Functional role of AhR in the expression of toxic effects by TCDD”. Biochimica et Biophysica Acta (BBA) - General Subjects 1619 (3), 263–268. o. DOI:10.1016/S0304-4165(02)00485-3. PMID 12573486.
- ↑ Puga A, Tomlinson CR, Xia Y (2005. január 1.). „Ah receptor signals cross-talk with multiple developmental pathways”. Biochemical Pharmacology 69 (2), 199–207. o. DOI:10.1016/j.bcp.2004.06.043. PMID 15627472.
- ↑ Puga A, Ma C, Marlowe JL (2009. február 1.). „The aryl hydrocarbon receptor cross-talks with multiple signal transduction pathways”. Biochemical Pharmacology 77 (4), 713–722. o. DOI:10.1016/j.bcp.2008.08.031. PMID 18817753. PMC 2657192.
- ↑ Ikuta T, Eguchi H, Tachibana T, Yoneda Y, Kawajiri K (1998. január 1.). „Nuclear localization and export signals of the human aryl hydrocarbon receptor”. The Journal of Biological Chemistry 273 (5), 2895–2904. o. DOI:10.1074/jbc.273.5.2895. PMID 9446600.
- ↑ Pollenz RS, Barbour ER (2000. augusztus 1.). „Analysis of the complex relationship between nuclear export and aryl hydrocarbon receptor-mediated gene regulation”. Molecular and Cellular Biology 20 (16), 6095–6104. o. DOI:10.1128/MCB.20.16.6095-6104.2000. PMID 10913191. PMC 86085.
- ↑ Hoffman EC, Reyes H, Chu FF, Sander F, Conley LH, Brooks BA, Hankinson O (1991. május 1.). „Cloning of a factor required for activity of the Ah (dioxin) receptor”. Science 252 (5008), 954–958. o. DOI:10.1126/science.1852076. PMID 1852076.
- ↑ a b Probst MR, Reisz-Porszasz S, Agbunag RV, Ong MS, Hankinson O (1993. szeptember 1.). „Role of the aryl hydrocarbon receptor nuclear translocator protein in aryl hydrocarbon (dioxin) receptor action”. Molecular Pharmacology 44 (3), 511–518. o. PMID 8396713.
- ↑ Reyes H, Reisz-Porszasz S, Hankinson O (1992. május 1.). „Identification of the Ah receptor nuclear translocator protein (Arnt) as a component of the DNA binding form of the Ah receptor”. Science 256 (5060), 1193–1195. o. DOI:10.1126/science.256.5060.1193. PMID 1317062.
- ↑ Dolwick KM, Swanson HI, Bradfield CA (1993. szeptember 1.). „In vitro analysis of Ah receptor domains involved in ligand-activated DNA recognition”. Proceedings of the National Academy of Sciences of the United States of America 90 (18), 8566–8570. o. DOI:10.1073/pnas.90.18.8566. PMID 8397410. PMC 47398.
- ↑ Shen ES, Whitlock JP (1992. április 1.). „Protein-DNA interactions at a dioxin-responsive enhancer. Mutational analysis of the DNA-binding site for the liganded Ah receptor”. The Journal of Biological Chemistry 267 (10), 6815–6819. o. DOI:10.1016/S0021-9258(19)50499-9. PMID 1313023.
- ↑ Lusska A, Shen E, Whitlock JP (1993. március 1.). „Protein-DNA interactions at a dioxin-responsive enhancer. Analysis of six bona fide DNA-binding sites for the liganded Ah receptor”. The Journal of Biological Chemistry 268 (9), 6575–6580. o. DOI:10.1016/S0021-9258(18)53289-0. PMID 8384216.
- ↑ Yao EF, Denison MS (1992. június 1.). „DNA sequence determinants for binding of transformed Ah receptor to a dioxin-responsive enhancer”. Biochemistry 31 (21), 5060–5067. o. DOI:10.1021/bi00136a019. PMID 1318077.
- ↑ Wharton KA, Franks RG, Kasai Y, Crews ST (1994. december 1.). „Control of CNS midline transcription by asymmetric E-box-like elements: similarity to xenobiotic responsive regulation”. Development 120 (12), 3563–3569. o. DOI:10.1242/dev.120.12.3563. PMID 7821222.
- ↑ Bacsi SG, Reisz-Porszasz S, Hankinson O (1995. március 1.). „Orientation of the heterodimeric aryl hydrocarbon (dioxin) receptor complex on its asymmetric DNA recognition sequence”. Molecular Pharmacology 47 (3), 432–438. o. PMID 7700240.
- ↑ Swanson HI, Chan WK, Bradfield CA (1995. november 1.). „DNA binding specificities and pairing rules of the Ah receptor, ARNT, and SIM proteins”. The Journal of Biological Chemistry 270 (44), 26292–26302. o. DOI:10.1074/jbc.270.44.26292. PMID 7592839.
- ↑ Boutros PC, Moffat ID, Franc MA, Tijet N, Tuomisto J, Pohjanvirta R, Okey AB (2004. augusztus 1.). „Dioxin-responsive AHRE-II gene battery: identification by phylogenetic footprinting”. Biochemical and Biophysical Research Communications 321 (3), 707–715. o. DOI:10.1016/j.bbrc.2004.06.177. PMID 15358164.
- ↑ Sogawa K, Numayama-Tsuruta K, Takahashi T, Matsushita N, Miura C, Nikawa J, Gotoh O, Kikuchi Y, Fujii-Kuriyama Y (2004. június 1.). „A novel induction mechanism of the rat CYP1A2 gene mediated by Ah receptor-Arnt heterodimer”. Biochemical and Biophysical Research Communications 318 (3), 746–755. o. DOI:10.1016/j.bbrc.2004.04.090. PMID 15144902.
- ↑ Hahn ME, Karchner SI, Evans BR, Franks DG, Merson RR, Lapseritis JM (2006. szeptember 1.). „Unexpected diversity of aryl hydrocarbon receptors in non-mammalian vertebrates: insights from comparative genomics”. Journal of Experimental Zoology Part A: Comparative Experimental Biology 305 (9), 693–706. o. DOI:10.1002/jez.a.323. PMID 16902966.
- ↑ Duncan DM, Burgess EA, Duncan I (1998. május 1.). „Control of distal antennal identity and tarsal development in Drosophila by spineless-aristapedia, a homolog of the mammalian dioxin receptor”. Genes & Development 12 (9), 1290–1303. o. DOI:10.1101/gad.12.9.1290. PMID 9573046. PMC 316766.
- ↑ Emmons RB, Duncan D, Estes PA, Kiefel P, Mosher JT, Sonnenfeld M, Ward MP, Duncan I, Crews ST (1999. szeptember 1.). „The spineless-aristapedia and tango bHLH-PAS proteins interact to control antennal and tarsal development in Drosophila”. Development 126 (17), 3937–3945. o. DOI:10.1242/dev.126.17.3937. PMID 10433921.
- ↑ a b Tijet N, Boutros PC, Moffat ID, Okey AB, Tuomisto J, Pohjanvirta R (2006. január 1.). „Aryl hydrocarbon receptor regulates distinct dioxin-dependent and dioxin-independent gene batteries”. Molecular Pharmacology 69 (1), 140–153. o. DOI:10.1124/mol.105.018705. PMID 16214954.
- ↑ Gasiewicz TA, Singh KP, Casado FL (2010. március 1.). „The aryl hydrocarbon receptor has an important role in the regulation of hematopoiesis: implications for benzene-induced hematopoietic toxicity”. Chemico-Biological Interactions 184 (1–2), 246–251. o. DOI:10.1016/j.cbi.2009.10.019. PMID 19896476. PMC 2846208.
- ↑ Kiss EA, Vonarbourg C, Kopfmann S, Hobeika E, Finke D, Esser C, Diefenbach A (2011. december 1.). „Natural aryl hydrocarbon receptor ligands control organogenesis of intestinal lymphoid follicles”. Science 334 (6062), 1561–1565. o. DOI:10.1126/science.1214914. PMID 22033518.
- ↑ a b Li Y, Innocentin S, Withers DR, Roberts NA, Gallagher AR, Grigorieva EF, Wilhelm C, Veldhoen M (2011. október 1.). „Exogenous stimuli maintain intraepithelial lymphocytes via aryl hydrocarbon receptor activation”. Cell 147 (3), 629–640. o. DOI:10.1016/j.cell.2011.09.025. PMID 21999944.
- ↑ Quintana FJ, Basso AS, Iglesias AH, Korn T, Farez MF, Bettelli E, Caccamo M, Oukka M, Weiner HL (2008. május 1.). „Control of T(reg) and T(H)17 cell differentiation by the aryl hydrocarbon receptor”. Nature 453 (7191), 65–71. o. DOI:10.1038/nature06880. PMID 18362915.
- ↑ Akahoshi E, Yoshimura S, Ishihara-Sugano M (2006. szeptember 1.). „Over-expression of AhR (aryl hydrocarbon receptor) induces neural differentiation of Neuro2a cells: neurotoxicology study”. Environmental Health 5, 24. o. DOI:10.1186/1476-069X-5-24. PMID 16956419. PMC 1570454.
- ↑ Walisser JA, Glover E, Pande K, Liss AL, Bradfield CA (2005. december 1.). „Aryl hydrocarbon receptor-dependent liver development and hepatotoxicity are mediated by different cell types”. Proceedings of the National Academy of Sciences of the United States of America 102 (49), 17858–17863. o. DOI:10.1073/pnas.0504757102. PMID 16301529. PMC 1308889.
- ↑ Boitano AE, Wang J, Romeo R, Bouchez LC, Parker AE, Sutton SE, Walker JR, Flaveny CA, Perdew GH, Denison MS, Schultz PG, Cooke MP (2010. szeptember 1.). „Aryl hydrocarbon receptor antagonists promote the expansion of human hematopoietic stem cells”. Science 329 (5997), 1345–1348. o. DOI:10.1126/science.1191536. PMID 20688981. PMC 3033342.
- ↑ Lindsey S, Papoutsakis ET (2011. február 1.). „The aryl hydrocarbon receptor (AHR) transcription factor regulates megakaryocytic polyploidization”. British Journal of Haematology 152 (4), 469–484. o. DOI:10.1111/j.1365-2141.2010.08548.x. PMID 21226706. PMC 3408620.
- ↑ Merchak A, Gaultier A (2020. december 1.). „Microbial metabolites and immune regulation: New targets for major depressive disorder”. Brain, Behavior, & Immunity - Health 9, 100169. o. DOI:10.1016/j.bbih.2020.100169. PMID 34589904. PMC 8474524.
- ↑ Israel DI, Whitlock JP (1983. szeptember 1.). „Induction of mRNA specific for cytochrome P1-450 in wild type and variant mouse hepatoma cells”. The Journal of Biological Chemistry 258 (17), 10390–10394. o. DOI:10.1016/S0021-9258(17)44469-3. PMID 6885786.
- ↑ Israel DI, Whitlock JP (1984. május 1.). „Regulation of cytochrome P1-450 gene transcription by 2,3,7, 8-tetrachlorodibenzo-p-dioxin in wild type and variant mouse hepatoma cells”. The Journal of Biological Chemistry 259 (9), 5400–5402. o. DOI:10.1016/S0021-9258(18)91022-7. PMID 6715350.
- ↑ Ko HP, Okino ST, Ma Q, Whitlock JP (1996. január 1.). „Dioxin-induced CYP1A1 transcription in vivo: the aromatic hydrocarbon receptor mediates transactivation, enhancer-promoter communication, and changes in chromatin structure”. Molecular and Cellular Biology 16 (1), 430–436. o. DOI:10.1128/MCB.16.1.430. PMID 8524325. PMC 231019.
- ↑ Nebert DW, Roe AL, Dieter MZ, Solis WA, Yang Y, Dalton TP (2000. január 1.). „Role of the aromatic hydrocarbon receptor and [Ah] gene battery in the oxidative stress response, cell cycle control, and apoptosis”. Biochemical Pharmacology 59 (1), 65–85. o. DOI:10.1016/S0006-2952(99)00310-X. PMID 10605936.
- ↑ Lensu S, Tuomisto JT, Tuomisto J, Viluksela M, Niittynen M, Pohjanvirta R (2011. június 1.). „Immediate and highly sensitive aversion response to a novel food item linked to AH receptor stimulation”. Toxicology Letters 203 (3), 252–257. o. DOI:10.1016/j.toxlet.2011.03.025. PMID 21458548.
- ↑ Monteleone I, Rizzo A, Sarra M, Sica G, Sileri P, Biancone L, MacDonald TT, Pallone F, Monteleone G (2011. július 1.). „Aryl hydrocarbon receptor-induced signals up-regulate IL-22 production and inhibit inflammation in the gastrointestinal tract”. Gastroenterology 141 (1), 237–48, 248.e1. o. DOI:10.1053/j.gastro.2011.04.007. PMID 21600206.
- ↑ Wei P, Hu GH, Kang HY, Yao HB, Kou W, Liu H, Zhang C, Hong SL (2014. május 1.). „An aryl hydrocarbon receptor ligand acts on dendritic cells and T cells to suppress the Th17 response in allergic rhinitis patients”. Laboratory Investigation; A Journal of Technical Methods and Pathology 94 (5), 528–535. o. DOI:10.1038/labinvest.2014.8. PMID 24514067.
- ↑ Memari B, Bouttier M, Dimitrov V, Ouellette M, Behr MA, Fritz JH, White JH (2015. november 1.). „Engagement of the Aryl Hydrocarbon Receptor in Mycobacterium tuberculosis-Infected Macrophages Has Pleiotropic Effects on Innate Immune Signaling”. Journal of Immunology 195 (9), 4479–4491. o. DOI:10.4049/jimmunol.1501141. PMID 26416282.
- ↑ Harrigan JA, Vezina CM, McGarrigle BP, Ersing N, Box HC, Maccubbin AE, Olson JR (2004. február 1.). „DNA adduct formation in precision-cut rat liver and lung slices exposed to benzo[a]pyrene”. Toxicological Sciences 77 (2), 307–314. o. DOI:10.1093/toxsci/kfh030. PMID 14691214.
- ↑ Lindén J, Lensu S, Tuomisto J, Pohjanvirta R (2010. október 1.). „Dioxins, the aryl hydrocarbon receptor and the central regulation of energy balance”. Frontiers in Neuroendocrinology 31 (4), 452–478. o. DOI:10.1016/j.yfrne.2010.07.002. PMID 20624415.
- ↑ Martinez JM, Afshari CA, Bushel PR, Masuda A, Takahashi T, Walker NJ (2002. október 1.). „Differential toxicogenomic responses to 2,3,7,8-tetrachlorodibenzo-p-dioxin in malignant and nonmalignant human airway epithelial cells”. Toxicological Sciences 69 (2), 409–423. o. DOI:10.1093/toxsci/69.2.409. PMID 12377990.
- ↑ Vezina CM, Walker NJ, Olson JR (2004. november 1.). „Subchronic exposure to TCDD, PeCDF, PCB126, and PCB153: effect on hepatic gene expression”. Environmental Health Perspectives 112 (16), 1636–1644. o. DOI:10.1289/ehp.7253. PMID 15598615. PMC 1247661.
- ↑ Ovando BJ, Vezina CM, McGarrigle BP, Olson JR (2006. december 1.). „Hepatic gene downregulation following acute and subchronic exposure to 2,3,7,8-tetrachlorodibenzo-p-dioxin”. Toxicological Sciences 94 (2), 428–438. o. DOI:10.1093/toxsci/kfl111. PMID 16984957.
- ↑ Hogenesch JB, Chan WK, Jackiw VH, Brown RC, Gu YZ, Pray-Grant M, Perdew GH, Bradfield CA (1997. március 1.). „Characterization of a subset of the basic-helix-loop-helix-PAS superfamily that interacts with components of the dioxin signaling pathway”. The Journal of Biological Chemistry 272 (13), 8581–8593. o. DOI:10.1074/jbc.272.13.8581. PMID 9079689.
- ↑ Tian Y, Ke S, Chen M, Sheng T (2003. november 1.). „Interactions between the aryl hydrocarbon receptor and P-TEFb. Sequential recruitment of transcription factors and differential phosphorylation of C-terminal domain of RNA polymerase II at cyp1a1 promoter”. The Journal of Biological Chemistry 278 (45), 44041–44048. o. DOI:10.1074/jbc.M306443200. PMID 12917420.
- ↑ Wormke M, Stoner M, Saville B, Walker K, Abdelrahim M, Burghardt R, Safe S (2003. március 1.). „The aryl hydrocarbon receptor mediates degradation of estrogen receptor alpha through activation of proteasomes”. Molecular and Cellular Biology 23 (6), 1843–1855. o. DOI:10.1128/MCB.23.6.1843-1855.2003. PMID 12612060. PMC 149455.
- ↑ Klinge CM, Kaur K, Swanson HI (2000. január 1.). „The aryl hydrocarbon receptor interacts with estrogen receptor alpha and orphan receptors COUP-TFI and ERRalpha1”. Archives of Biochemistry and Biophysics 373 (1), 163–174. o. DOI:10.1006/abbi.1999.1552. PMID 10620335.
- ↑ Beischlag TV, Wang S, Rose DW, Torchia J, Reisz-Porszasz S, Muhammad K, Nelson WE, Probst MR, Rosenfeld MG, Hankinson O (2002. június 1.). „Recruitment of the NCoA/SRC-1/p160 family of transcriptional coactivators by the aryl hydrocarbon receptor/aryl hydrocarbon receptor nuclear translocator complex”. Molecular and Cellular Biology 22 (12), 4319–4333. o. DOI:10.1128/MCB.22.12.4319-4333.2002. PMID 12024042. PMC 133867.
- ↑ Antenos M, Casper RF, Brown TJ (2002. november 1.). „Interaction with Nedd8, a ubiquitin-like protein, enhances the transcriptional activity of the aryl hydrocarbon receptor”. The Journal of Biological Chemistry 277 (46), 44028–44034. o. DOI:10.1074/jbc.M202413200. PMID 12215427.
- ↑ Kumar MB, Tarpey RW, Perdew GH (1999. augusztus 1.). „Differential recruitment of coactivator RIP140 by Ah and estrogen receptors. Absence of a role for LXXLL motifs”. The Journal of Biological Chemistry 274 (32), 22155–22164. o. DOI:10.1074/jbc.274.32.22155. PMID 10428779.
- ↑ Kim DW, Gazourian L, Quadri SA, Romieu-Mourez R, Sherr DH, Sonenshein GE (2000. november 1.). „The RelA NF-kappaB subunit and the aryl hydrocarbon receptor (AhR) cooperate to transactivate the c-myc promoter in mammary cells”. Oncogene 19 (48), 5498–5506. o. DOI:10.1038/sj.onc.1203945. PMID 11114727.
- ↑ Ruby CE, Leid M, Kerkvliet NI (2002. szeptember 1.). „2,3,7,8-Tetrachlorodibenzo-p-dioxin suppresses tumor necrosis factor-alpha and anti-CD40-induced activation of NF-kappaB/Rel in dendritic cells: p50 homodimer activation is not affected”. Molecular Pharmacology 62 (3), 722–728. o. DOI:10.1124/mol.62.3.722. PMID 12181450.
- ↑ Vogel CF, Sciullo E, Li W, Wong P, Lazennec G, Matsumura F (2007. december 1.). „RelB, a new partner of aryl hydrocarbon receptor-mediated transcription”. Molecular Endocrinology 21 (12), 2941–2955. o. DOI:10.1210/me.2007-0211. PMID 17823304. PMC 2346533.
- ↑ Ge NL, Elferink CJ (1998. augusztus 1.). „A direct interaction between the aryl hydrocarbon receptor and retinoblastoma protein. Linking dioxin signaling to the cell cycle”. The Journal of Biological Chemistry 273 (35), 22708–22713. o. DOI:10.1074/jbc.273.35.22708. PMID 9712901.
Fordítás
[szerkesztés]- Ez a szócikk részben vagy egészben az Aryl hydrocarbon receptor című angol Wikipédia-szócikk ezen változatának fordításán alapul. Az eredeti cikk szerkesztőit annak laptörténete sorolja fel. Ez a jelzés csupán a megfogalmazás eredetét és a szerzői jogokat jelzi, nem szolgál a cikkben szereplő információk forrásmegjelöléseként.
További információk
[szerkesztés]- Aryl+hydrocarbon+receptor a U.S. National Library of Medicine Medical Subject Headings (MeSH) honlapján
- Humán AHR genombeli helye és AHR géninformációs lap a UCSC Genome Browserben.
- Humán ARNT genombeli helye és ARNT géninformációs lap a UCSC Genome Browserben.
