Tiocianát
| Tiocianát | |||

| |||
| IUPAC-név | tiocianát | ||
| Más nevek | szulfocianát, tiocianid, rodanid, szulfocianid | ||
| Kémiai azonosítók | |||
|---|---|---|---|
| PubChem | 9322 | ||
| |||
| Kémiai és fizikai tulajdonságok | |||
| Kémiai képlet | CNS- | ||
| Moláris tömeg | 58,0824 g/mol | ||
| Ha másként nem jelöljük, az adatok az anyag standardállapotára (100 kPa) és 25 °C-os hőmérsékletre vonatkoznak. | |||
A tiocianát (vagy régebbi nevén rodanid) az [SCN]− anionnak, a tiociánsav konjugált bázisának a neve. Közönséges származékai közé tartozik a színtelen kálium-tiocianát és nátrium-tiocianát só. Ugyancsak tiocianátoknak nevezik az SCN funkciós csoportot tartalmazó szerves vegyületeket is. A higany(II)-tiocianátot korábban a pirotechnikában használták.
A tiocianát az [OCN]− cianátionnal analóg, a benne szereplő oxigént kénatom helyettesíti. Az [SCN]− pszeudohalogén, reakciói hasonlóságot mutatnak a halogenidionokéval. A tiocianát régebbi neve rodanid volt (a görög rózsa szóból eredően), mivel a vassal vörös színű komplexeket képez. Tiocianát elemi kén vagy tioszulfát cianiddal végbemenő reakciójában keletkezik:
- 8 CN− + S8 → 8 SCN−
- CN− + S2O2−3 → SCN− + SO2−3
A második reakciót a rodanáz néven ismert szulfotranszferáz enzim katalizálja, ami szerepet játszhat a cianid testben végbemenő méregtelenítési folyamatában.
Szerkezet, kötés és koordinációs kémia
[szerkesztés]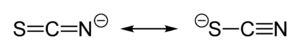
A tiocianát negatív töltése körülbelül egyformán oszlik el a kén és nitrogén között. Ennek következtében a tiocianátion mind a kén, mind a nitrogénatom felőli oldala nukleofilként reagálhat, azaz ambidentát ligandum. Az [SCN]− két (M−SCN−M) vagy akár három fématom között is (>SCN− or −SCN<) hidat képezhet. A kísérleti tapasztalatok alapján általában megállapítható, hogy az a osztályú fémionok (hard savak) inkább a tiocianát N atomjához kapcsolódnak, míg a b osztályú fémionok (soft savak) inkább a tiocianát S-atomjához kötődve képeznek tiocianát komplexeket. Esetenként egyéb tényezők, például kinetikai és oldhatósági viszonyok is szerepet játszhatnak, és kötési izoméria léphet fel (például [Co(NH3)5(NCS)]Cl2 és [Co(NH3)5(SCN)]Cl2.[1]
Szerves tiocianátok
[szerkesztés]A tiocianátion szerves és átmenetifém származékainak kötési izomerjei is létezhetnek. A tiocianátokban a szerves csoport (vagy fémion) a kénhez kapcsolódik: az R−S−C≡N vegyületben a S−C egyes kötés és C≡N hármas kötés található.[2] Az izotiocianátokban a szubsztituens a nitrégénhez kapcsolódik, az R−N=C=S vegyületben S=C és C=N kettős kötés van:
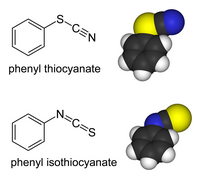
A szerves tiocianátok a Riemschneider tiokarbamát szintézis során tiokarbamáttá hidrolizálnak.
A vas(III) kimutatása
[szerkesztés]Ha vas (III)-iont (Fe3+) tartalmazó oldathoz [SCN]−-t adunk, vérvörös oldat keletkezik a [Fe(NCS)(H2O)5]2+ képződése miatt.

A tiocianát biokémiája a gyógyászatban
[szerkesztés]A tiocianátról[3] ismert, hogy fontos része a hipotiocianit laktoperoxidáz által történő bioszintézisének .[4][5][6] Emiatt az emberi testben a tiocianát teljes hiányának[7] vagy csökkent mennyiségének[8] (például cisztás fibrózis) nagy jelentősége van az emberi test védelmi rendszerében.[9][10]
Fordítás
[szerkesztés]Ez a szócikk részben vagy egészben a Thiocyanate című angol Wikipédia-szócikk ezen változatának fordításán alapul. Az eredeti cikk szerkesztőit annak laptörténete sorolja fel. Ez a jelzés csupán a megfogalmazás eredetét és a szerzői jogokat jelzi, nem szolgál a cikkben szereplő információk forrásmegjelöléseként.
Hivatkozások
[szerkesztés]- ↑ Greenwood, Norman N.; Earnshaw, A.. Chemistry of the Elements, 2nd, Oxford: Butterworth-Heinemann, p. 326. o. (1997. március 1.). ISBN 0080379419
- ↑ Guy, R. G. "Syntheses and Preparative Applications of Thiocyanates" in "Chemistry of Cyanates and Their Derivatives," vol II. Patai, S., (Editor), John Wiley, 1977. New York
- ↑ Pedemonte N, Caci E, Sondo E, Caputo A, Rhoden K, Pfeffer U, Di Candia M, Bandettini R, Ravazzolo R, Zegarra-Moran O, Galietta LJ (2007. April). „Thiocyanate transport in resting and IL-4-stimulated human bronchial epithelial cells: role of pendrin and anion channels”. J. Immunol. 178 (8), 5144–53. o. PMID 17404297.
- ↑ Conner GE, Wijkstrom-Frei C, Randell SH, Fernandez VE, Salathe M (2007. January). „The lactoperoxidase system links anion transport to host defense in cystic fibrosis”. FEBS Lett. 581 (2), 271–8. o. DOI:10.1016/j.febslet.2006.12.025. PMID 17204267. PMC 1851694.
- ↑ White WE, Pruitt KM, Mansson-Rahemtulla B (1983. February). „Peroxidase-thiocyanate-peroxide antibacterial system does not damage DNA”. Antimicrob. Agents Chemother. 23 (2), 267–72. o. PMID 6340603. PMC 186035.
- ↑ Thomas EL, Aune TM (1978. May). „Lactoperoxidase, peroxide, thiocyanate antimicrobial system: correlation of sulfhydryl oxidation with antimicrobial action”. Infect. Immun. 20 (2), 456–63. o. PMID 352945. PMC 421877.
- ↑ Childers M, Eckel G, Himmel A, Caldwell J (2007). „A new model of cystic fibrosis pathology: lack of transport of glutathione and its thiocyanate conjugates”. Med. Hypotheses 68 (1), 101–12. o. DOI:10.1016/j.mehy.2006.06.020. PMID 16934416.
- ↑ Minarowski Ł, Sands D, Minarowska A, Karwowska A, Sulewska A, Gacko M, Chyczewska E (2008). „Thiocyanate concentration in saliva of cystic fibrosis patients”. Folia Histochem. Cytobiol. 46 (2), 245–6. o. DOI:10.2478/v10042-008-0037-0. PMID 18519245.
- ↑ Moskwa P, Lorentzen D, Excoffon KJ, Zabner J, McCray PB, Nauseef WM, Dupuy C, Bánfi B (2007. January). „A novel host defense system of airways is defective in cystic fibrosis”. Am. J. Respir. Crit. Care Med. 175 (2), 174–83. o. DOI:10.1164/rccm.200607-1029OC. PMID 17082494. PMC 2720149.
- ↑ Xu Y, Szép S, Lu Z (2009. December). „The antioxidant role of thiocyanate in the pathogenesis of cystic fibrosis and other inflammation-related diseases”. Proc. Natl. Acad. Sci. U.S.A. 106 (48), 20515–9. o. DOI:10.1073/pnas.0911412106. PMID 19918082. PMC 2777967.
