Higany(II)-tiocianát
Megjelenés
| Ehhez a szócikkhez további forrásmegjelölések, lábjegyzetek szükségesek az ellenőrizhetőség érdekében. Emiatt nem tudjuk közvetlenül ellenőrizni, hogy a szócikkben szereplő állítások helytállóak-e. Segíts a szócikk fejlesztésében további megbízható források hozzáadásával. |
| Higany(II)-tiocianát | |||
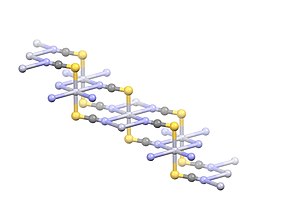 A higany(II)-tiocianát kristályszerkezete | |||
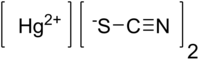
| |||
| Más nevek | higany(II)-rodanid,[1] higany(II)-szulfocianát | ||
| Kémiai azonosítók | |||
|---|---|---|---|
| CAS-szám | 592-85-8 | ||
| PubChem | 11615 | ||
| EINECS-szám | 209-773-0 | ||
| |||
| |||
| UNII | 3JNH1DM7IF | ||
| Kémiai és fizikai tulajdonságok | |||
| Kémiai képlet | Hg(SCN)2 | ||
| Moláris tömeg | 316,755 g/mol | ||
| Megjelenés | fehér por | ||
| Szag | szagtalan | ||
| Sűrűség | 3,71 g/cm3 (szilárd) | ||
| Olvadáspont | 165 °C (bomlik) | ||
| Oldhatóság (vízben) | 0,069 g/100 ml | ||
| Oldhatóság | jól oldódik alkoholban, sósavban, salétromsavban, konyhasó oldatában[1] | ||
| Mágneses szuszceptibilitás | −96,5·10−6 cm3/mol | ||
| Veszélyek | |||
| EU osztályozás | |||
| Főbb veszélyek | erősen mérgező | ||
| NFPA 704 | |||
| LD50 | 46 mg/kg (patkány, szájon át) | ||
| Ha másként nem jelöljük, az adatok az anyag standardállapotára (100 kPa) és 25 °C-os hőmérsékletre vonatkoznak. | |||
A higany(II)-tiocianát szerves vegyület, higanysó, a Hg2+ és a tiocianát anion koordinációs komplexe. Meggyújtva kígyóhoz vagy száraz faághoz hasonlítható termék keletkezik, fokozatosan növekedve, hosszabbodva. Ezt a jelenséget a fáraó kígyójának is nevezik.[2]
Előállítása
[szerkesztés]Általában kálium-tiocianátból és higany(II)-nitrátból állítják elő:[forrás?]
- 2 KCNS(aq) + Hg(NO3)2(aq) = Hg(CNS)2(s) + 2 KNO3(aq)
A higany(II)-tiocianát csapadékként kiválik, mert vízben oldhatatlan.
Fizikai tulajdonságai
[szerkesztés]Vízben oldhatatlan.
Kémiai tulajdonságai
[szerkesztés]Éghető, levegőn meggyújtva higany-szulfidra, szén-diszulfidra és C3N4 képletű szén-nitridre bomlik, melyek a levegő oxigénjének hatására (részben legalábbis) továbbalakulnak, a szén-diszulfid például szén-dioxiddá és kén-dioxiddá ég el.[3][4][5]
Veszélyei
[szerkesztés]A higany(II)-tiocianát ugyanúgy mérgező, mint a legtöbb higanysó.
Jegyzetek
[szerkesztés]- ↑ a b Römpp vegyészeti lexikon: Második kötet F–K. Szerk. Otto-Albrecht Neumüller–a magyar kiad. főszerk. Polinszky Károly. A 7. német kiadás alapján készült kiegészített magyar kiadás. Budapest: Műszaki Könyvkiadó. 1982. 480. o. ISBN 963 10 3813 0
- ↑ Davis, T. L. (1940). „Pyrotechnic Snakes”. Journal of Chemical Education 17 (6), 268–270. o. DOI:10.1021/ed017p268.
- ↑ Dürer verseny – kémia 9-12. osztályosok – döntő: 2020. február 7-9. megoldások
- ↑ http://vegyszer.chem.elte.hu/video/chemlab/elemek/Hg/hg-rodanid.html
- ↑ Miller, T.S., d'Aleo, A., Suter, T., Aliev, A.E., Sella, A. and McMillan, P.F. (2017). „Pharaoh's Serpents: New Insights into a Classic Carbon Nitride Material”. Zeitschrift für anorganische und allgemeine Chemie 643 (21), 1572-1580. o. DOI:10.1002/zaac.201700268.

