Szerves kémiai nómenklatúra
Ez a szócikk az IUPAC által kiadott szerves kémiai nevezéktant ismerteti. E nevezéktan a klasszikus vegyértékkötésekre épül, és nem veszi figyelembe az elektronkonfigurációt.
A nevezéktan alapja: alapvegyületekből nevezéktani műveletekkel levezetni a vegyület szerkezetét. Az alapvegyületek egyenes láncú nyílt vegyületek, gyűrűrendszerek[1] vagy a nómenklatúrában felsorolt (gyakori, triviális nevű) vegyületek. A művelet a legtöbb esetben a hidrogénatomok helyettesítése másik atommal vagy atomcsoporttal, ezért szubsztitúciós nómenklatúrának is nevezik. A nevezéktan megadja az alapvegyületeket és a lehetséges műveleteket.
Az alapvegyületeknek két típusuk van. Az egyik atomokból (pontosabban: egycentrumos hidridekből[2]) a már említett nevezéktani műveletekkel keletkezik. A másik típusban triviális nevű vegyületek vannak, melyekben kivételesen elágazás is lehet. Az alapvegyületből következik az elnevezés minden más része: a műveletek, az atomok számozása, a név elemeinek sorrendje, stb. Az alapvegyület kiválasztása – bár vannak rá ajánlások – többféleképpen lehetséges, így egy vegyületnek többféle szabályos IUPAC-neve lehet.
A nevezéktan elsődleges célja, hogy minden vegyületnek olyan neve legyen, mely egyértelműen azonosítja a vegyületet. További fontos cél a lehetőségek szerinti egyszerűség, valamint a korábbi, gyakorlatban már elterjedt nevek beépítése a rendszerbe.
A nevezéktannak nem célja, hogy minden vegyületnek egyetlen szabványos („ajánlott”) neve legyen.
Példa a nevezéktan használatára
[szerkesztés]Ugyanazon vegyület nevének előállítása kétféle nevezéktannal.
| Alapvegyület | Művelet | Vegyület |
|---|---|---|
 |
szubsztitúció |
 |
 |
addíció (oxigéné) |
 |
Vegyérték
[szerkesztés]Az atom összes kémiai kötéseinek száma, mellyel az alapvegyületbeli atomhoz vagy hidrogénatomhoz kapcsolódik. A nevezéktan az alábbi vegyértékeket tekinti standardnak:
| Vegyérték | Elem |
|---|---|
| 4 | C Si Ge Sn Pb |
| 3 | B N P As Sb Bi |
| 2 | O S Se Te Po |
| 1 | F Cl Br I At |
A vegyületek nevében a nem szabványos vegyértéket λn alakban lehet megadni, ha az szükséges. Pl.: a H3C–SH5 szerkezeti képletű vegyületben a kén vegyértéke 6. A vegyérték feltüntetése: metil-λ6-szulfán. Ritkán használják.
Kettős kötések
[szerkesztés]A szénatomok közötti kettős kötést a vegyületnév töve utáni -én utótaggal jelezzük. Két kettős kötés esetén az utótag -dién, három esetén -trién stb. Pl. az etán névtöve et, a kettős kötést tartalmazó vegyület IUPAC-neve etén.
A kettős kötés helyét a névtő és az -én utótag közötti számmal adjuk meg. Pl. a but-2-én(en) a 2-es és 3-as szénatom közötti kettős kötést jelenti. Mindig a kisebb számú szénatomot adjuk meg.
Többgyűrűs vegyületekben előfordul, hogy a kettős kötés nem szomszédos számú szénatomok között van. Ilyenkor a kisebbik szám után zárójelben adjuk meg a nagyobbat. Pl.: ...2(10)-én a 2-es és 10-es szénatom közötti kettős kötést jelent.
Az -én utótag a szubtrakció műveletének egyik használata.
Egyszerűbb vegyületekben a kettős kötés helyét jelző számot a vegyület neve előtt tüntetjük fel. Pl. a but-2-én és 2-butén azonos vegyület.
Kettős kötések gyűrűkben
[szerkesztés]Telítetlen vegyületen olyan vegyületet értünk, melyben van két szomszédos szénatom, melyek között kettős vagy hármas kötés van. E fejezetben a kettős kötésekről lesz szó. (A hármas kötés gyűrűkben nagyon ritka.)
A gyűrűs vegyületek két csoportját vették az alapvegyületek közé. Az egyik csoport a telített, a másik a teljesen telítetlen gyűrűk. Az előbbi egyszerűbb, viszont az utóbbiba tartoznak a gyakorlati szempontból nagyon fontos aromás vegyületek.
Teljesen telítetlen gyűrűn olyan gyűrűt értünk, amely a lehető legnagyobb számú nem szomszédos kettős kötést tartalmazza.[4]
A nem teljesen telítetlen gyűrűk elnevezésében kiindulhatunk a telített alapgyűrűből, és a névben jelezzük, hol vannak kettős kötések. A másik lehetőség, hogy a teljesen telítetlen alapvegyületből indulunk, és jelezzük a telített atomokat.
A gyűrűkben nagyon ritka a szomszédos kettős kötés. Ha mégis előfordul, a névben a megfelelő gyűrűatomnál δn alakban jelezhetjük, ahol n az atomból induló kettős kötések száma.
Példa:

Az ábrán egy biciklusos, kondenzált gyűrűs[5] vegyület látható. A bal gyűrű tienol, a jobb oldali tiofén. A kondenzált gyűrű neve …tieno[…]tiofén. A prefix mondja meg a két kénatom helyét a kondenzált gyűrűben, a szögletes zárójelbeli kifejezés pedig a két gyűrű csatlakozási helyét a két gyűrűben.
A kondenzált gyűrűket a jobb felső gyűrűtől kezdődően, az óramutató járásával azonos irányban számozzuk (miután a molekulát a megfelelő helyzetbe forgattuk; az ábra már ezt a helyzetet mutatja). A közös szénatomok nem kapnak számot. Az atomok sorszámait a külső kék számok jelzik.
A két kénatom a 2-es és 5-ös pozícióban van, a vegyület neve tehát 2,5-tieno[…]tiofén.
A jobb oldali kénatomnál a 2-es szám után jelezhetjük, hogy 4 vegyértékű: 2λ4, ill. hogy két kettős kötést tartalmaz: 2δ2. Ha mindkettőt meg akarjuk adni: 2λ4δ2. Az 5-ös pozícióbeli kén teljesen hasonló.
A csatlakozó atompár megadásához a tienol atomjait megszámozzuk az izolált heterogyűrűs vegyület számozási szabályai szerint, azaz a kénnel kezdve. Ezt mutatják a gyűrűbeli piros számok. (A molekula szimmetrikus, és a számozás iránya a csatlakozási hely szempontjából is mindegy.) A gyűrű a 3-as és 4-es szénatommal csatlakozik a másikhoz.
A tiofénnél a csatlakozási élt adjuk meg. Itt is az izolált heterogyűrűs vegyület számozási szabályai szerint számozunk. Az 1,2 szénatom adja az a élt, a 2,3 a b-t, a 3,4 a csatlakozó c élet. A két gyűrű csatlakozó éle így lesz 3,4-c.
A kondenzált gyűrűs nómenklatúráról külön szócikk szól.
A második gyűrű csatlakozását is megadhatjuk a csatlakozó atomokkal; ez esetben [3,4:4,3] alakot kapunk. A két gyűrű csatlakozási élének megadására más lehetőség is van a nevezéktanban (áthidalt gyűrűs nómenklatúra). A szögletes zárójelen belüli központozásból kiderül, melyik változatot használtuk.
Nevezéktani műveletek
[szerkesztés]
Szubsztitúció
[szerkesztés]| Képlet | Előtag | Utótag | |
|---|---|---|---|
| Kationok | -onio -onia |
-ónium | |
| Karbonsav | –COOH | Karboxi | -karbonsav |
| –(C)OOH | -sav | ||
| Szulfonsav | –SO3H | Szulfo | -szulfonsav |
| Sók | –COOM | Fém...acetát | |
| –COOR | Fém...oát | ||
| Észterek | –COOR | R-oxikarbonil | R...acetát |
| –(C)OOR | - | R...oát | |
| Savhalogenidek | –CO–halogén | Haloformil | acetil-halid |
| –(C)O–halogén | - | -oil-halid | |
| Amidok | –CO–NH2 | Karbamoil | -acetamid |
| –(C)O–NH2 | - | -amid | |
| Aminidok | –C(=NH)–NH2 | Amidino | -acetamidin |
| –(C)(=NH)–NH2 | - | -amidin | |
| Nitrilek | –CN | Ciano | -acetonitril |
| –(C)N | - | -nitril | |
| Aldehidek | –CHO | Formil | -acetaldehid |
| –(C)HO | Oxo | -al | |
| Ketonok | >(C)=O | Oxo | -on |
| Alkoholok | –OH | Hidroxi | -ol |
| Fenolok | –OH | Hidroxi | -ol |
| Tiolok | –SH | Merkapto | -tiol |
| Hidro- peroxidok |
–O–OH | Hidroperoxi | - |
| Aminok | –NH2 | Amino | -amin |
| Iminek | =NH | Imino | -imin |
| Éterek | –OR | R-oxi | - |
| Szulfidok | –SR | R-tio | - |
| Peroxidok | –O–OR | R-dioxi | - |
Egy vagy több hidrogén helyettesítése másik atommal vagy atomcsoporttal. A helyettesítés tényét a vegyület nevében elő- vagy utótag jelzi (jobb oldali táblázat), mely többszörözhető.
A táblázatban a (C) azt jelzi, hogy a szénatom nem számít bele az atomok számozásába. Az M „vegyjel” fématomot, az R szénláncot jelöl. A hal helyére fluor, klór, bróm vagy jód helyettesítendő. Pl. az acetil-klorid másik neve etanoil-klorid. Az acet a megfelelő karbonsavmaradékkal helyettesíthető.
Példa: fenil-oxirán (lásd fenn). További példák:
|
|
|
A helyettesítést jelző utótag: -ol. | ||||
|
|
 Propánkarbonsav |
A butánsav C-je nem számít az atomok számába. A propánkarbonsav C-je beleszámít a szénatomok számába. Na-sója a nátrium-butanoát, másik néven nátrium-propánkarboxilát. |
Helyettesítés
[szerkesztés]Atomcsoport vagy hidrogéntől különböző atom (legtöbbször szén) helyettesítése másik elemmel.[6] „a”-nómenklatúrának is nevezik, mert a helyettesítést jelző előtagok[7] a-ra végződnek.
 |
 |
A nitrogén „a”-prefixe aza. A kondenzált gyűrűhármas 4-es és 5-ös szénatomját cserélte nitrogénre. A kondenzált gyűrű teljesen telítetlen, de van egy telített szénatomja. A 9H ennek helyét adja meg. A jobb oldali vegyület másik neve: 9H-pirido[3',2':4,5]ciklopenta[1,2-b]piridin. |
A helyettesítés másik esete az oxigén vagy oxigéntartalmú csoport helyettesítése:
 |
 |
A helyettesítést a tio o-ja jelzi. |
A heterogyűrűs vegyületek elnevezési szabályait a Hantzsch–Widman-nevezéktan szócikk ismerteti.
Addíció
[szerkesztés]| Név | Atom vagy csoport |
|---|---|
| Oxid | =O |
| Szulfid | >S |
| Szulfoxid | >SO |
| Szulfon | >SO2 |
| Szelenid | Se |
| Tellurid | Te |
| Imid | =NH |
| Azid | –N3 |
| Alkohol | –OH |
| Éter | –O– |
| Keton | >CO |
| Hidroperoxid | –O–OH |
| Cianid | –CN |
| Izocianid | –NC |
| Fluorid | –F |
| Klorid | –Cl |
| Bromid | –Br |
| Jodid | –I |
A vegyületet komponensekből állítjuk össze formálisan úgy, hogy a komponensek valamennyi atomját felhasználjuk.
Az additív nómenklatúra leggyakoribb előtagja a hidro-. Részlegesen telítetlen gyűrű telített atomjait jelezhetjük vele:
 |
 |
A tetrahidro- előtag négy H-atom hozzáadását jelenti. |
A homo- előtag egy metiléncsoportot ad a vegyülethez.[10]
Példa: a műveletet additív utótaggal jelöljük:
 |
 |
Az -ium utótag egy H+ hozzáadását jelenti. |
Az addíció harmadik formája egy vagy több helyettesítő előtag hozzáadása egy osztályhoz. A helyettesítő előtag lehet egy alapvegyület, erre példa a sztirol-oxid (lásd fenn).
A helyettesítő előtag másik formája a mára már elavult gyök nómenklatúra. Ha egy tag többször szerepel, többszöröző előtaggal adható meg.
Példák az osztálynevek használatára:
 |
Az etil az etánból képzett gyök. Az alkohol az –OH osztályneve. | |
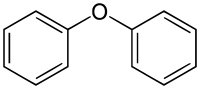 |
A fenil a benzolból képzett gyök. Az –O– az éter osztályneve. A kétszer szereplő fenilt a di- többszöröző előtaggal adjuk meg. |
Osztály megadása nélkül az addíció használható szubsztituens előtagok összeadására vagy többszörözésére. Pl.: pentil + oxi → pentiloxi, fenil + fenil → bifenil.
Az addíció használata általában nem preferált, bár vannak esetek, amikor leegyszerűsíti a nevet.
Konjunkció
[szerkesztés]Vegyületek összekapcsolása oly módon, hogy mindegyikből elhagyunk egy-egy, két-két stb. hidrogénatomot. A vegyületek ezen hidrogénatomok helyén kapcsolódnak össze.
A vegyület nevében a műveletnek nincsenek elő- és utótagjai: azt a komponensek egymás mellé írása jelzi.
Rendszerint olyankor használják, amikor a vegyület egy gyűrű(rendszer)ből és egy szénláncból áll, és mindkét komponens zárja a láncot. E kettőn kívül legfeljebb a szénlánchoz kapcsolódó helyettesítőcsoportok vannak a vegyületben, melyek helyét görög betűkkel jelzik.
Példa:
 |
+ |
 |
|
 |
Az 5-hidroxiindolecetsav(en) másik szabályos neve 2-(5-hidroxi-1H-indol-3-il)ecetsav. Itt a konjunkciót két művelettel helyettesítettük: szubtrakcióval eltávolítottunk egy hidrogént az első vegyületből ( 2-(5-hidroxi-1H-indol-3-il) ), majd az így kapott atomcsoportot szubsztitúcióval kapcsoltuk az ecetsavhoz. A szubsztitúció távolította el a hidrogént az ecetsavból.
Másik példa a vinil-acetilén. Gyűrű és oldallánc összekapcsolásakor ez a megoldás a támogatott. Példa: sztirol-oxid.
Két azonos vegyület összekapcsolásakor használhatjuk a többszöröző előtagokat:

Szubtrakció
[szerkesztés]Egy elem, ion vagy atomcsoport eltávolítása.
A leggyakoribb használat a hidrogént eltávolító -il utótag. Pl.: metán → metil. Ugyancsak gyakori a két hidrogént eltávolító, kettős kötést létrehozó -én, ill. a négy hidrogént eltávolító -in utótag.
Példa:
 But-1-én-3-in |
 |
A vinil-acetilén(en) név két lépésben keletkezett. Az etilénből (CH2=CH2) szubtrakcióval eltávolítottunk egy hidrogénatomot, így kaptuk a nevezéktanbeli vinil(en) triviális nevet. A vinilcsoportot szubsztitúcióval kapcsoltuk az ugyancsak szabályos triviális nevű acetilénhez. A vegyület másik neve a nevezéktanban but-1-én-3-in. Az 1-én az 1-es és 2-es szénatomról eltávolít egy-egy hidrogént, és kettős kötést hoz létre közöttük. A 3-in a 3-as és 4-es szénatomról távolít el 2-2 hidrogént, hármas kötést eredményezve. |
Példák előtagra: dehidro-, deoxo, nor- (CH2– eltávolítása[10]).
 |
|
 |
Bár az aszkorbinsav név az IUPAC-nómenklatúrában nem szabályos (a név Szent-Györgyi Alberttől, a C-vitamin előállítójától származik), a példa jól mutatja a szubtrakció alkalmazását triviális nevű vegyületen. (Az aszkorbinsav szabványos nemzetközi gyógyszerszabadnév.) |
Gyűrűképzés
[szerkesztés]A ciklo- előtag a nyílt láncú vegyület két végén levő atom közötti kötést hoz létre egy-egy hidrogén eltávolításával. Például:
 |
 |
A szeko- előtaggal a gyűrűhasítás is megengedett művelet, ez azonban csak bonyolult vegyületeknél fordul elő.[11]
Többszörözés
[szerkesztés]Ha egy vegyületben egy atomcsoport többször fordul elő, a többszöröző előtagok használatával a név leegyszerűsíthető. Atomcsoport többszörözésére gyakran a bisz-, trisz- stb. előtagot használjuk.
Vegyületnév előállításának lépései
[szerkesztés]Az IUPAC nevezéktan lehetővé teszi, hogy egy vegyületnek többféle szabályos neve legyen, így a létrehozónak van egy kis mozgástere a felhasználástól függő név kiválasztásában.
- A nómenklatúra kiválasztása
- Az utótag vagy osztály kiválasztása. Csak egyféle típus választható ki: ez lesz az alapcsoport. Az összes többi szubsztituenset előtagként kell megadni.
- Az alapvegyület (alaplánc vagy preferált gyűrű(rendszer)) kiválasztása, beleértve a tőle nem elválasztható előtagokat.
- Az alapcsoport és az alapvegyület nevének meghatározása.
- Az előtagok és infixek (néven belüli módosító tagok) meghatározása (a többszöröző tagokat is beleértve). A struktúrák számának meghatározása amilyen részletességgel lehetséges.
- A fennmaradó előtagok nevének meghatározása. A teljes vegyület atomjainak számozása.
- Az előtagok összegyűjtése és abc-rendezése.
Jegyzetek
[szerkesztés]- ↑ A gyűrűrendszer állhat több gyűrűből, ha azoknak legalább egy közös pontjuk van, vagy két gyűrű atomjai között közvetlen (közbenső atom nélküli) kötés van (pl. bifenil. Az utóbbi esetben is megkívánjuk, hogy az így keletkező gyűrűlánc ne legyen elágazó.
- ↑ Az egycentrumos hidrid egy atom a hozzá kapcsolódó hidrogénatommal, és szükség esetén a vegyérték jelzésével. R-2.1
- ↑ A 2-es szénatom megadása redundáns, de ez az ajánlott név.
- ↑ A nómenklatúrabeli maximum number of noncumulative double bonds kifejezés pontosabb, de bonyolultabb, mint az itt használt teljesen telítetlen.
- ↑ A két gyűrűnek két közös szénatomja van.
- ↑ A „szubsztitúció” nómenklatúrabeli neve substitution, a helyettesítésé replacement.
- ↑ "a" Prefixes Used in Replacement Nomenclature
- ↑ Nomenclature Systems/Rule D-1.5 Additive Nomenclature
- ↑ Some Functional Class Names Used in Radicofunctional Nomenclature
- ↑ a b Nomenclature of Steroids/Rule 2S-7 Ring Contraction or Expansion
- ↑ Nomenclature of Steroids/Rule 2S-8 Ring Fission
Források
[szerkesztés]- IUPAC Nomenclature of Organic Chemistry
- Nomenclature Systems
- Characteristic groups cited only as prefixes in substitutive nomenclature
- General Principles (prioritás az atomok számozásakor)
Vegyületek a Chemspider adatbázisból:



