Rubídium-permanganát
| rubídium-permanganát | |
| |
| rubídium ion | |
| |
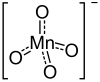
| permanganátion | |
| IUPAC-név | rubídium-permanganát |
| Más nevek | rubídium-tetraoxomanganát (VII) rubídium-manganát (VII) |
| Kémiai azonosítók | |
| CAS-szám | 13465-49-1 |
| Kémiai és fizikai tulajdonságok | |
| Kémiai képlet | RbMnO4 |
| Moláris tömeg | 204,404 g/mol−1 |
| Megjelenés | lila színű, tűs, oktaéderes kristályok[1] |
| Sűrűség | 3,325 g·cm−3[2] |
| Olvadáspont | 295 °C (bomlik) |
| Oldhatóság (vízben) | rosszul oldódik |
| Veszélyek | |
| Főbb veszélyek | nincs adat |
| Rokon vegyületek | |
| Azonos kation | rubídium-oxid rubídium-hidroxid |
| Az infoboxban SI-mértékegységek szerepelnek. Ahol lehetséges, az adatok standardállapotra (100 kPa) és 25 °C-os hőmérsékletre vonatkoznak. Az ezektől való eltérést egyértelműen jelezzük. | |
A rubídium-permanganát a permangánsav rubídiumsója képlete RbMnO4. A permangánsavat izolált állapotban nem állították elő. A rubídium-permanganátban a mangán oxidációs száma +7.
Előállítása
[szerkesztés]Kálium-permanganát és rubídium-klorid reakciójával lehet előállítani:[3][4]
Tulajdonságai
[szerkesztés]Vízben rosszul oldódik, oldhatósága nő a hőmérséklet növekedésével: 7 °C-on 1 liter vízben 6,03 g oldódik, 19 °C-on 10,6 g oldódik és 60 °C-on 46,8 g oldódik.[5][6] Kristályai ortorombosak[7] tércsoport: Pnma.[8] Rács paraméterei:a = 765 pm, b = 955 pm és c = 574 pm, elemi cellája négy atomot tartalmaz. Kristályai izomorfak a cézium-permanganát és az ammónium-permanganát kristályaival.[9]
A kálium-permanganáttal analóg módon bomlik: előbb rubídium-manganát(VI)-ra, mangán-dioxidra, rubídium-oxidra és oxigénre bomlik, majd a rubídium-manganát(VI) bomlik tovább bomlik mangán-dioxidra, rubídium-oxidra és oxigénre. A bomlás 200 °C és 300 °C között megy végbe, a bomlásban a rubídium-permanganát tömegének 8% alakul át oxigénné:[10]
Felhasználása
[szerkesztés]Kvalitatív elemzésben perklorátionok kimutatására használják. A köztitermékként keletkező rubídium-nitrát és kálium-permanganát a perklorátionokkal RbClO4·RbMnO4 vegyes kristályokat alkotnak.[11]
Fordítás
[szerkesztés]Ez a szócikk részben vagy egészben a Rubidiumpermanganat című német Wikipédia-szócikk fordításán alapul. Az eredeti cikk szerkesztőit annak laptörténete sorolja fel. Ez a jelzés csupán a megfogalmazás eredetét és a szerzői jogokat jelzi, nem szolgál a cikkben szereplő információk forrásmegjelöléseként.
Források
[szerkesztés]- ↑ R. Hoppe – D. Fischer – J. Schneider: Zur Kenntnis von Oxyden A[MO4]: Über LiMnO4, KMnO4, RbMnO4, CsMnO4 sowie RbIO4 und CsIO4. (– Was heißt eigentlich “Die Kristallstruktur von …”? –). 625 (németül) 1999. 1521–3749. o. = Zeitschrift für anorganische und allgemeine Chemie, 7. doi:10.1002/(SICI)1521-3749(199907)625:7<1135::AID-ZAAC1135>3.0.CO;2-L
- ↑ Dale L. Perry, Sidney L. Phillips: Handbook of inorganic compounds. CRC Press, 1995, ISBN 978-0-8493-8671-8, S. 336 (korlátozott előnézet a Google Könyvekben).
- ↑ M. W. Beck, M. E. Brown: "Thermal Analysis of Antimony/Potassium Permanganate Pyrotechnic Compositions" in Thermochimica Acta 1983, 65, S. 197-212. Volltext Archiválva 2013. október 29-i dátummal a Wayback Machine-ben (PDF; 906 kB)
- ↑ P. J. Herley, E. G. Prout: "The Thermal Decomposition of Rubidium Permanganate" in J. Phys. Chem., 1960, 64(5), S. 675–677. doi:10.1021/j100834a503
- ↑ Aterton Seidell: "Solubilities of Organic Compounds Vol. I", 1940 S. 1438. Volltext
- ↑ A. M. Patterson: "Solubilities of Permanganates of the Alkali Metals" in J. Am. Chem. Soc. 1906, 28(12), S. 1734–1736. doi:10.1021/ja01978a009
- ↑ W. Muthmann: "Beiträge zur Volumtheorie der krystallisirten Körper" in Zeitschrift für Krystallographie und Mineralogie 1894, 22, S. 530. (Volltext)
- ↑ A. A. Tyunyaev, G. D. Nipan, T. N. Kol’tsova, A. S. Loktev, V. A. Ketsko, A. G. Dedov, I. I. Moiseev: "Polymorphic Mn/W/Na(K,Rb,Cs)/SiO2 catalysts for oxidative coupling of methane" in Russian Journal of Inorganic Chemistry 2009, 54(5), S. 664-667. doi:10.1134/S0036023609050039
- ↑ A. Müller, B. Krebs: "Röntgenographische Untersuchung einiger Permanganate" in Naturwissenschaften 1965, 52(17), S. 494. doi:10.1007/BF00646573
- ↑ Z. Gontarz, B. Pisarska: "Thermal decomposition stages of potassium, rubidium and caesium permanganates" in Journal of Thermal Analysis and Calorimetry 1990, 36(6), S. 2113-2117. doi:10.1007/BF01914135
- ↑ E. Gerdes: "Qualitative anorganische Analyse: ein Begleiter für Theorie und Praxis", Springer Verlag 2001, 2. Auflage, S. 139. ISBN 9783540678755. (korlátozott előnézet a Google Könyvekben).




