Oxalil-klorid
| Oxalil-klorid | |||
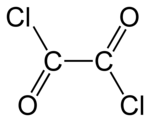 Oxalil-klorid | |||
 |
| ||
| IUPAC-név | Oxalil-diklorid | ||
| Más nevek | Oxálsav-klorid | ||
| Kémiai azonosítók | |||
|---|---|---|---|
| CAS-szám | 79-37-8 | ||
| |||
| Kémiai és fizikai tulajdonságok | |||
| Kémiai képlet | C2O2Cl2 | ||
| Moláris tömeg | 126,93 g/mol | ||
| Megjelenés | színtelen folyadék | ||
| Sűrűség | 1,4785 g/cm³ (folyadék) | ||
| Olvadáspont | −16 °C | ||
| Forráspont | 63–64 °C | ||
| Oldhatóság (vízben) | hidrolizál | ||
| Törésmutató (nD) | 1,429 | ||
| Veszélyek | |||
| EU osztályozás | Mérgező (T)[1] | ||
| NFPA 704 | |||
| R mondatok | R14, R23, R29, R34, R37[1] | ||
| S mondatok | S26, S36/37/39, S45[1] | ||
| Rokon vegyületek | |||
| Rokon vegyületek | Oxálsav dinátrium-oxalát kalcium-oxalát difenil-oxalát | ||
| Ha másként nem jelöljük, az adatok az anyag standardállapotára (100 kPa) és 25 °C-os hőmérsékletre vonatkoznak. | |||
Az oxalil-klorid színtelen, levegőn füstölgő folyadék az oxálsavból vezethető le, ha OH-csoportjait klór atomokkal helyettesítjük. A szerves kémiában felhasználják klórozószerként, alkoholokkal, fenolokkal, enolokkal reakcióba víve, oxálsav észtereket állítanak elő belőle. Katalizátor jelenlétében aromás vegyületekkel szubsztitúciós reakcióba lép. Apoláris oldószerekben (benzol, toluol) oldódik, de, ha az oldószer tartalmaz hidroxil-csoportot, az oxalil-klorid reakcióba lép vele, hidrogén-klorid gáz és oxálsav észter képződése közben.
Kémiai tulajdonságai
[szerkesztés]Reakciója vízzel
[szerkesztés]Ha az oxalil-klorid vízzel érintkezik, azonnal oxálsavra és hidrogén-kloridra hidrolizál. A folyadék a levegő nedvességtartalmával is reakcióba lép, ezért füstölög.
Észterképzés
[szerkesztés]Az oxalil-klorid a többi savkloridhoz hasonlóan, -OH csoportot tartalmazó szerves vegyülettel észtert képez. Ezek a reakciók viszonylag gyorsan és hevesen lejátszódnak, hidrogén-klorid fejlődése közben. Ez az előállítási módja például a difenil-oxalátnak (Cyalume), amit az eldobható fényrudakban használnak a hidrogén-peroxid mellett, mivel a két vegyület reakciójakor a kemolumineszcencia nevű jelenség játszódik le.
Karbonsav klórozás
[szerkesztés]Ha a vegyület karbonsavval lép reakcióba, az adott sav kloridja keletkezik.
Reakciója ammóniával
[szerkesztés]Ha ammónia-gázzal lép reakcióba a vegyületből oxálsavamid lesz.
(ha dietil-aminnal reagáltatjuk N,N-dietil-oxálsavamid keletkezik)
Reakciója aromás szénhidrogénekkel
[szerkesztés]Minden halogénezett karbonsav és alkán reakcióba lép aromás szénhidrogénekkel katalizátor jelenlétében. Az oxalil-klorid esetében halogénezett karbonsavról beszélünk, és ha halogénezett karbonsav lép reakcióba aromás vegyülettel katalizátor (pl. AlCl3) jelenlétében, akkor Friedel–Crafts acilezésről beszélhetünk.(Ha halogénezett alkán reagál aromás szénhidrogénnal, azt Friedel–Crafts alkilezésnek nevezzük. Ezek a Friedel–Crafts-reakciók). A reakció pl. benzollal:
Előállítása
[szerkesztés]Az oxalil-kloridot oxálsavból és foszfor-pentakloridból állítják elő, hidrogén-klorid és foszforil-klorid melléktermék képződése közben.
Jegyzetek
[szerkesztés]- ↑ a b c A 79-37-8 CAS-számhoz tartozó bejegyzés az IFA GESTIS adatbázisából. A hozzáférés dátuma: 2011. 01. 30. (JavaScript szükséges) (angolul)
Fordítás
[szerkesztés]- Ez a szócikk részben vagy egészben az Oxalyl chloride című angol Wikipédia-szócikk fordításán alapul. Az eredeti cikk szerkesztőit annak laptörténete sorolja fel. Ez a jelzés csupán a megfogalmazás eredetét és a szerzői jogokat jelzi, nem szolgál a cikkben szereplő információk forrásmegjelöléseként.
Források
[szerkesztés]- Antus Sándor - Mátyus Péter: Szerves Kémia II.







