Mellékvese

(A feji irány balra, a farki jobbra, a hasi irány lent, a háti fent található. 1: rekeszizom, 3: aorta, 14: bal mellékvese, 16: gyomor, 17: máj, 18: bal vese)


A mellékvese a gerincesek (Vertebrata) páros belső elválasztású mirigye, melyen megkülönböztetünk kéreg- és velőállományt.
A mellékvesekéreg fő funkciója szteroid hormonok termelése. Az emberi mellékvesekéreg által termelt szteroidok:
- Mineralokortikoidok (aldoszteron, dezoxikortikoszteron): A szervezet só- és vízháztartását szabályozzák. A nátriumion megőrzését és felvételét, következményes víz- és kloridion-visszatartást, valamint a káliumion és a hidrogénion kiürítését okozzák.
- Glükokortikoidok (kortizol, kortikoszteron): Jelentős a szerepük a stresszválasz kialakulásában és fennmaradásában, támogatják a lebontó (katabolikus) anyagcsere-folyamatokat, fokozzák a katekolaminok hatását, szabályozzák a só- és vízháztartást és a vérnyomást, csökkentik a csontképződést és a sejtközötti tér fehérjéinek termelődését, gátolják az immunrendszert és a gyulladásos választ, valamint nélkülözhetetlenek a tüdő kifejlődésében.
- Androgének (férfi nemi hormonok: dehidroepiandroszteron, dehidroepiandroszteron-szulfát): A magzati fejlődés során a méhlepényben ösztrogénekké (női nemi hormonokká) alakulva segítik a terhesség fennmaradását és az anyai emlő proliferációját. Gyermekkorban az elsődleges és másodlagos nemi jellegek kialakulásában vesznek részt.
A mellékvesevelő a szimpatikus idegrendszer része; katekolaminokat (adrenalint és noradrenalint) termel, és juttat a vérkeringésbe, melyek hozzájárulnak a készenléti reakció eseményeihez.
Halakban a egységes mellékvese nem alakul ki. A kéregnek megfelelő interrenális szerv a két vese között (vagy fölöttük) található; a velővel homológ szuprarenális szervek pedig a szimpatikus dúclánc dúcai mellett, szelvényesen helyezkednek el.
Nevezéktan
[szerkesztés]A mellékvese elnevezése latinul glandula suprarenalis vagy glandula adrenalis, görögül επινεφρίδια (epinefridia), angolul adrenal gland vagy suprarenal gland. A latin glandula suprarenalis és a görög epinefridia jelentése „vese fölötti mirigy”, a glandula adrenalis jelentése „a vesénél lévő mirigy”.
Az orvosi nyelvben a magyar vagy a latin kifejezést használjuk. Utóbbi birtokos esetben: „glandulae suprarenalis” (pl. a mellékvese kérge = cortex glandulae suprarenalis) A „glandula” szót bizonyos esetekben elhagyjuk (pl. alsó mellékvese-ütőér = arteria suprarenalis inferior). A görög elnevezést szóösszetételekben használjuk.
Az adrenalin (más néven epinefrin) illetve a noradrenalin (norepinefrin) hormonok neve is a latin, illetve görög elnevezésből származik.
Az emberi mellékvese fejlődéstana
[szerkesztés]
A kéregállomány a középső csíralemez származéka: mezodermális eredetű. Az embrionális élet 5. hetében a mesenterium melletti hasüregi coelomahám osztódó sejtjeinek egy része bevándorol a környező mesenchymába. Ezek a sejtek alakítják ki a fötális mellékvesekérget (primitív cortex). Később újabb coelomahámsejtek vándorolnak a mélybe, melyek körülveszik a fötális kéreg hámtelepét, és kialakítják a maradandó mellékvesekérget (permanens cortex). A terhesség végére a magzati mellékvese mérete megfelel a felnőtt ember mellékveséjéének. Születés után a fötális kéreg nagy része azonban hónapok alatt visszafejlődik, a legkülső részéből pedig a zona reticularis származik. A maradandó kéregből fejlődik ki a zona glomerulosa és a zona fasciculata. A mellékvesekéreg végleges szerkezete a pubertáskorban alakul ki.
A velőállomány a külső csíralemez származéka: ektodermális eredetű. A dúclécből sympathicoblast sejtek vándorolnak a mellékvesetelep közepébe, és kialakítják a mellékvesevelőt. (A sympathicoblastokból alakulnak ki az autonóm idegrendszer szimpatikus részének idegsejtjei is.) A mellékvesevelő chromaffin sejtjei tulajdonképpen módosult szimpatikus posztganglionáris idegsejtek.
Az emberi mellékvese anatómiája
[szerkesztés]

A mellékvese páros szerv. A jobb mellékvese háromszögletű, a bal félhold alakú, lelapult szerv. Tömegük egyenként 4-5 gramm egy felnőtt emberben. Felszínük enyhén dudoros. A mellékvesén megkülönböztetünk külső kéregállományt (cortex) és belső velőállományt (medulla). A kéreg felnőtt emberben a szerv 90%-át alkotja, tömött tapintatú, színe kénsárga (okkersárga) a raktározott koleszterinszármazékok miatt. A velő lágyabb állományú, színe világosabb, barnássárga. A szervet kívülről sejtdús kötőszöveti tok (capsula fibrosa) borítja be. A kötőszövetes tokból kötőszövetes sövények (septa fibrosa) nyúlnak a mellékvese állományába, melyben erek és idegek futnak. A tok szerepe a szerv állományának egybentartása, védelme.
A mellékvese retroperitonealis helyzetű szerv, a 11-12. háti csigolya magasságában. A vese felső pólusán helyezkedik el, annak zsíros tokján (capsula adiposa) belül. A zsíros tok stabilan rögzíti a benne található szerveket.
Az emberi mellékvese vérerei, nyirokerei és idegei
[szerkesztés]

Artériák
[szerkesztés]A mellékvese három verőérből kap vért:
- A főverőér hasi szakaszának; aorta abdominalis páros ága az alsó rekeszütőér (arteria phrenica inferior). Ebből ágazik le a felső mellékvese-ütőér (arteria suprarenalis superior). (Az a. phrenica inferior látja el vérrel a rekeszizom alsó részét is.)
- A középső mellékvese-ütőér (arteria suprarenalis media) közvetlenül a hasi aortából ágazik le bal- és jobboldalt.
- A hasi aorta páros ága az arteria renalis (veseütőér) is. Mielőtt ez a verőér belépne a vesébe, leadja az alsó mellékvese-ütőeret (arteria suprarenalis inferior).
A három verőér ágai a mellékvese kötőszövetes tokjában közös érfonatot képeznek. Innen kisebb artéria ágak (arteriolák) lépnek a mellékvese kéregállományába, a felszínre merőlegesen, és ott tág - kapilláris falszerkezettel nem rendelkező - sinusoid hajszálerekké (sinusokká) alakulnak. A kéregből a szteroid hormonokkal feldúsult vér a velőállományba jut. A velő vérellátása tehát egyrészt a kéregből érkező sinusok felől történik, másrészt viszont a kötőszövetes sövényeken keresztül jövő arteriolák felől, közvetlenül. A mellékvesevelő kapillárisai is sinusoid jellegűek.
Vénák
[szerkesztés]A mellékvesevelőből a hormonokkal feldúsult vér a sinusokból venulákba, majd ezekből egy központi vénába kerül (vena centralis). A centrális véna a mellékvese kapuján (hilus) keresztül hagyja el a szervet, majd vagy a vena renalis-on (vesegyűjtőér) keresztül vagy közvetlenül a vena cava inferior-ba vezeti a vért. A vena cava inferior (alsó nagy véna) a jobb szívfélbe nyílik, ahonnan a vénás vér a kisvérkörbe kerül. A tüdőkből a vér a bal szívfélbe jut, majd innen az aortába pumpálódik. A nagyvérkörön keresztül a mellékvesekéreg és -velő hormonjai eljutnak a célszervekhez, és kifejtik élettani hatásukat.
Nyirokelvezetés
[szerkesztés]A mellékveséből (és általában a hátsó hasfali szervekből például a veséből) az elsődleges nyirokutakon keresztül a nyirok az aorta körüli ágyéki nyirokcsomókba (nodi lymphoidei lumbales) vezetődik. Ezekből a másodlagos nyirokerek a truncus lumbalis-on keresztül vagy közvetlenül a cisterna chyli-be vezetik a nyirkot. A cisterna chyli-ből a nyirok a ductus thoracicus-ba jut, ami a bal oldali vénás szögletben (angulus venosus) a bal vena brachiocephalica-ba nyílik, ahol keveredik a vénás vérrel. A kétoldali vena brachiocephalica a vena cava superior-ba (felső nagy véna) egyesül, mely a jobb pitvarba nyílik.
Beidegzés
[szerkesztés]A mellékvesevelő chromaffin sejtjein preganglionáris szimpatikus rostok végződnek. Ezek a háti (thoracalis) gerincvelő Th10–12 szakaszának oldalszarvaiban elhelyezkedő intermediolaterális magokat (nucleus intermediolateralis) képező idegsejtek axonjai. A gerincvelőből az elülső gyökereken keresztül lépnek ki, csatlakoznak a gerincvelői idegekhez, majd mint fehér myelinhüvelyű összekötő ágak (rami communicantes albi), elhagyják azokat, és belépnek a szimpatikus határláncba (truncus sympathicus). Itt áthaladnak, de nem kapcsolódnak át az 5–9. mellkasi dúcokon, hanem csatlakoznak a gerincoszlop oldalán futó nagy zsigeri ideghez (nervus sphlanchnicus major). Ez az ideg a rekeszizmot a páratlan gyűjtőérrel (vena azygos, jobb oldalon), illetve a fél páratlan gyűjtőérrel (vena hemiazygos, bal oldalon) együtt lépi át a belső (crus mediale) és közbülső szár (crus intermediale) között, így a retroperitoneumba kerül, ahol leszállva ismét elágazik, a plexus coeliacus-tól (hasüregi fonat, plexus solaris, napfonat) kezdődően. A mellékvesevelőt ellátó rostok a mellékvesefonatba (plexus suprarenalis) futnak, belépnek a mellékvesébe, és átkapcsolódnak a mellékvesevelő chromaffin sejtjeire. Az ingerületátvivő neurotranszmitter az acetilkolin, mely a chromaffin sejtek nikotinos acetilkolin-receptorához kapcsolódik. A plexus suprarenalis-ban a plexus coeliacus-ból származó posztganglionáris rostok is jelen vannak.
A szimpatikus idegrendszer és így a mellékvesevelő legfőbb agyi szabályozórendszerei a limbikus rendszer és a hipotalamusz.
Az emberi mellékvese szöveti szerkezete
[szerkesztés]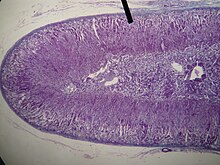

A mellékvesekéreg (cortex) állománya szövettanilag három, a felszínnel párhuzamos rétegre osztható. Ezek kívülről befelé:
- Zona glomerulosa (glomerulosus = gomolyagos). Vékony réteg, közvetlenül a kötőszövetes tok alatt. Sejtjei fészkekbe rendeződnek. A sejtcsoportokat sinusoid kapillárisok veszik körül.
- Zona fasciculata (fasciculatus = köteges). A sokszögű sejtek a felszínre merőleges gerendákat képeznek. A gerendák között, velük párhuzamosan futnak a sinusok.
- Zona reticularis (reticularis = hálózatos). Hálózatos sejtkötegekből áll, melyek között sinusok futnak.
A kéreg sejtjei szteroid hormonokat termelnek. Ennek megfelelően a sejtplazmában koleszterinészterekből álló lipidcseppek, fejlett sima felszínű endoplazmatikus retikulum (sER), és tubuláris mitokondriumok találhatók. (A zona reticularis sejtjeiben megjelenhet "kopási pigment" (lipofuscin) is.
A mellékvesevelő (medulla) állományát hálózatos gerendákba rendeződött ún. chromaffin sejtek alkotják. A gerendák között találhatók meg a sinusok. A chomaffin sejtekben membránnal határolt váladékszemcsék találhatók, melyek a hormonokat raktározzák, majd a sejten kívülre ürítik. A chromaffin granulumok tartalma: adrenalin vagy noradrenalin, chromograninok (vivőfehérjék), ATP, leu- és met-enkefalin, dopamin-béta-hidroxiláz. A sejtek 75-80%-a adrenalint, 20-25%-uk noradrenalint szekretál.
Chromaffin sejtek találhatók még a szimpatikus dúcok közelében is, ún. paraganglionokat alkotva (pl. paraganglion aorticum az aorta eredésének közelében; Zuckerkandl-féle szerv az aortaoszlásnál).
A chromaffin sejt elnevezése onnan ered, hogy ha ezeket a sejteket krómsó-oldattal kezeljük, a bennük található hormon tartamú granulumok barnára színeződnek, ugyanis a katekolaminokat a krómsók oxidálják, színes terméket eredményezve.
Az emberi mellékvesekéreg élettana
[szerkesztés]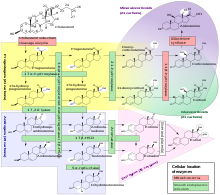
A mellékvesekéreg mindhárom rétege a koleszterin többlépcsős átalakításával szteroidhormonokat termel, melyeket a mirigysejtek nem képesek jelentős mennyiségben felhalmozni, raktározni, hanem folyamatosan ürítik őket a szinuszoid kapillárisokban áramló vérbe. A legkülső zona glomerulosa mineralokortikoidokat szintetizál, melyek a szervezet só-víz háztartását szabályozzák. A középső zona fasciculata elsősorban glukokortikoidokat (pl. kortizol) termel, melyek sokrétű feladatai között szerepel pl. az anyagcsere, a gyulladásos folyamatok és az immunrendszer szabályozása. A belső zona reticularis főként androgéneket szintetizál, melyek a nemi jellegek kialakulását befolyásolják. Valamilyen mértékű kortizol-, androgén-, sőt, kis mértékű ösztrogéntermelés azonban mind a zona fasciculata-ban, mind a zona reticularis-ban megfigyelhető. Megjegyzendő, hogy a szervezet valamennyi szövete közül a mellékvesekéreg aszkorbinsav- (C-vitamin-) tartalma a legmagasabb, ennek oka azonban egyelőre ismeretlen.
Az ACTH szerepe
[szerkesztés]
A mellékvesekéreg fennmaradását, hormontermelését és véráramlását egyaránt serkenti az adrenokortikotrop hormon (ACTH), melyet az agyalapi mirigy elülső lebenye (adenohypophysis) termel, a napszaktól függően (cirkadián periodicitás, diurnális ritmus): ébredéskor a legnagyobb mértékben, majd az ébrenlét során folyamatosan csökkenve, és alvás alatt újra növekedve. Az ACTH-termelést a hipotalamusz paraventrikuláris magjának kissejtes neuronjai által szecernált kortikotropin releasing hormon (CRH) tartja fenn, amit az ugyanezen sejtek által termelt antidiuretikus hormon (ADH = arginin-vazopresszin, AVP) tovább fokoz. ACTH hiányában a zona fasciculata és zona reticularis hormontermelése csökken, és maga a szövet is elsorvad (atrophia), míg tartósan magas ACTH-koncentráció esetén a mellékvesekéreg sejtjeinek száma és mérete is megnő (hypreplasia és hypertrophia), hormontermelésük pedig fokozódik.
Az ACTH egy 39 aminosavból álló peptid, amely a mellékvesekéreg hormontermelő sejtjeinek sejthártyáján elhelyezkedő ACTH-receptorhoz kötődve, stimuláló Gs-fehérje közvetítésével aktiválja az adenilát-cikláz enzimet, ami a sejten belüli adenozin-trifoszfátból (ATP) ciklikus adenozin-monofoszfátot (cAMP) termel. A cAMP fő funkciója a proteinkináz A (PKA) aktiválása, mely a sejten belüli célfehérjéket foszforiláció révén szabályozza, bizonyos szerin illetve treonin aminosavakhoz ATP-ből származó foszforilcsoportot kapcsolva, s így a célfehérjék szerkezetét és funkcióját megváltoztatva.
Az ACTH hatásai:
- a zona fasciculata és a zona reticularis szövetének fenntartása;
- a szteroidhormonok szintézisének fokozása: a lipoprotein-felvétel növelése, a koleszterin szintézisének gyorsítása, a koleszterinészter hidrolízisének fokozása, a koleszterin-pregnenolon átalakulás gyorsítása; bizonyos fehérjék szintézisének fokozása [LDL-receptorok (LDL: low density lipoprotein, alacsony sűrűségű lipoprotein), szteroidgenezist akutan reguláló fehérje (StAR), citokróm P-450 oxidáló enzimek, adrenodoxin, adrenodoxin-reduktáz];
- az aszkorbinsav véráramba ürítésének előidézése;
- a mellékvesekéreg véráramlásának fokozása (vasodilatatio, értágítás).
A mellékvesekéreg működését az ACTH-on kívül egyéb hormonok és más tényezők is befolyásolják. A zona glomerulosa hormontermelését az angiotenzin II serkenti.
Zona glomerulosa
[szerkesztés]

A zona glomerulosa mineralokortikoid hormont, pontosabban aldoszteront és 11-dezoxikortikoszteront termel.
Zona fasciculata
[szerkesztés]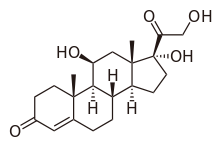
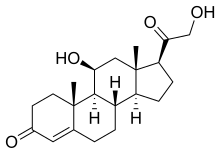

A zona fasciculata főként glükokortikoidokat: kortizolt (naponta átlagosan 20 mg-ot) és kortikoszteront (3 mg-ot) termel. A kortikoszteron glukokortikoid jellegű hatása csupán 30-36%-a a kortizolénak. A hormontermelés az ACTH szabályozásához kötött, annak a nap során változó mennyiségét néhány perces késéssel követi. A csúcskoncentráció ébredéskor mérhető, majd az ébrenlét alatt folyamatosan csökken, mélypontját az elalvást követő 1-4. órában éri el, végül még az alvás ideje alatt újra növekszik. Stressz hatására (sérülés, vérzés, fertőzés, extrém hideg vagy meleg, jelentős fizikai vagy pszichés megterhelés) tovább fokozódik a CRH, ACTH és glukokortikoidok elválasztása, ami segíti a stresszválasz kifejlődését (raktározott tápanyagok felszabadítása, vérkeringés fenntartása), de korlátozza is annak mértékét (citokin-felszabadulás gátlása; lázas, elesett állapot kivédése).
A képződött és vérbe került hormonok több mint 90%-ban transzkortin (kortikoszteroid-kötő globulin, CBG) szállítófehérjéhez kötődnek, de kisebb affinitással albuminhoz is képesek kapcsolódni, amely utóbbinak leginkább akkor van jelentősége, amikor a glukokortikoid-termelés mértéke meghaladja a rendelkezésre álló transzkortin mennyiségét. A célsejtekhez szállított hormonok diffúzióval jutnak be a sejtplazmába.
A glukokortikoidok a célsejtekben bizonyos hatásaikat gyorsan kifejtik, de a legismertebbek csupán órák alatt fejlődnek ki, a génátírás szabályozásán keresztül. A kortikoszteroid-receptorok a nukleáris receptor-szupercsalád tagjai. A II. típusú receptor (glukokortikoid-receptor) affinitása a glukokortikoidokhoz a legmagasabb, míg az I. típusú receptor (mineralokortikoid-receptor) hasonló affinitással köti a mineralo- és glukokortikoidokat is. A mineralokortikoidok legtöbb célsejtjében ezért egy enzim, a 11béta-hidroxiszteroid-dehidrogenáz gyorsan inaktiválja a glukokortikoidokat, mielőtt mineralokortikoid jellegű hatást fejtenének ki. Az immunszuppresszív és gyulladáscsökkentő hatások egy jelentős részének az alapja az, hogy a ligandot kötött glukokortikoidreceptor inaktiválja az NF-kappaB transzkripciós faktort, mely egyébként a legtöbb immunfolyamat kifejlődésében szerepelne. Az NF-kappaB gátlásának másik módja az I-kappaB gátlófehérje szintézisének indukciója.
A glukokortikoidok hatásai:
- Negatív visszacsatolás a hipotalamusz-hipofízis rendszer felé: a kortizol gátolja a CRH és ACTH felszabadulását, valamint csökkenti az ACTH-termelő kortikotrop sejt CRH iránti érzékenységét.
- A katabolikus hormonok (katekolaminok, glukagon, növekedési hormon) hatásának felerősítése és meghosszabbítása (permisszív hatás):
- a májban fokozzák a glükóz termelését (glukoneogenezis),
- a vázizomzatban fokozzák a glikogén és az izomfehérjék lebontását és csökkentik az aminosavak beépülését,
- a zsírszövetben fokozzák a trigliceridek lebontását (lipolízis) és egyúttal csökkentik a termelésüket (lipogenezis) is,
- mind a vázizomzatban mind a zsírszövetben inzulinrezisztenciát alakítanak ki, csökkentik a glukózfelvételt és -felhasználást, így növelik a vércukorszintet (hyperglycaemia).
- Ezeknek a változások az éhezéshez való alkalmazkodást garantálják.
- Vérkeringés fenntartása:
- biztosítják a mellékvesevelő hormontermelését és a noradrenalin szív-érrendszerre kifejtett hatását (szívösszehúzódások erejének fokozása, erek szűkítése, vérnyomás növelése),
- gátolják az értágító hatású prosztanoidok termelődését,
- szükségesek az angiotenzinogén szintéziséhez, viszont csökkentik az erek angiotenzin II iránti érzékenységét is. (Az angiotenzinogénből angiotenzin I, ebből pedig angiotenzin II keletkezik, mely érszűkítő, vérnyomásnövelő, aldoszteron- és ADH-szekréciót fokozó, nátriumvisszatartó és szomjúságérzést kiváltó hatással bír. Lásd: renin-angiotenzin rendszer.)
- Só- és vízürítés fokozása:
- csökkentik a hipotalamuszban az ADH termelődését (ez a hormon vízvisszatartó hatással rendelkezik),
- biztosítják a pitvari natriuretikus peptid (ANP) szintézisét (ez fokozza a vesében a nátrium- és vízürítést),
- fenntartják a vesében a szűrletképződést (glomerulus-filtráció, GFR).
- A bélen keresztüli kalciumfelszívódás csökkentése és a vesén keresztüli kalciumürítés fokozása.
- A kötő- és támasztószövetek képződésének gátlása:
- csökkentik a csontképződést,
- gyermekeknél mind a túl alacsony, mind a túl magas glukokortikoid-szint gátolja a csontok hossznövekedését,
- gátolják a kötőszöveti fibroblaszt sejtekben a sejtközötti állomány fehérjéinek (pl. kollagének) termelődését,
- gátolják a sebgyógyulást (citokinek szekréciójának csökkentése, makrofágok vándorlásának mérséklése).
- Az immunrendszer és a gyulladásos reakciók gátlása:
- csökkentik a citokinek termelődését, felszabadulását és hatásosságát, valamint csökkentik a gyulladásos mediátorok és szövetdestrukciós enzimek szintézisét és az akut fázis-fehérjék keletkezését is (bár az utóbbiak szintézisének megindulásában is szerepelnek),
- gátolják az immunsejtek működését, vándorlását és osztódását,
- gátolják az antigénprezentálást,
- elősegítik az immunkompetens sejtek előalakjainak pusztulását (apoptózis);
- a keringő limfocitákat a nyirokszervekbe (csontvelő, lép, nyirokcsomók) irányítják.
- A magatartás befolyásolása.
- Nélkülözhetetlenek a tüdő fejlődésében és a surfactant termelődésében.
Zona reticularis
[szerkesztés]

A zona reticularis aktivitása is ACTH-szabályozáshoz kötött. Ez a réteg mindkét nem esetében elsősorban androgéneket (férfi nemi hormon hatású szteroidokat) termel: dehidroepiandroszteront (DHEA) és dehidroepiandroszteron-szulfátot (DHEAS), amelyek a perifériás szövetekben tovább alakulhatnak nagyobb aktivitású androgénekké (tesztoszteron, 5-alfa-dihidrotesztoszteron) vagy ösztrogénekké, és a nemi jellegek kialakulásért felelnek.
5-6 éves korban a megnövekedett CRH- és ACTH-felszabadulás következtében fokozódik a mellékvesekéreg androgéntermelése (adrenarche), amely a hónalj- és szeméremszőrzet növekedésében nyilvánul meg. Az androgéntermelés mértéke a pubertás életszakasztól 40-50 éves korig a legmagasabb, ezután pedig folyamatosan csökken.
A magzati mellékvesekéreg működése
[szerkesztés]A magzati mellékvese és máj, a méhlepény (placenta), valamint az anyai mellékvese hormontermelése összejátszik egymással, ún. maternofötoplacentáris endokrin egységet alkotva.
A magzati mellékvesekéreg belső zónája (a szerv 85%-át kitevő fötális kéreg) nagy mennyiségű androgént (elsősorban dehidroepiandroszteron-szulfátot, DHEAS-t) termel, melyhez a szükséges koleszterint a magzati májban a prolaktin hormon által serkentve intenzíven termelődő LDL (low density lipoprotein) biztosítja. A DHEAS egy részéből a magzati májban 16alfa-hidroxi-dehidroepiandroszteron-szulfát (16-OH-DHEAS) képződik. Ezután a magzati és az anyai mellékvese által termelt androgének a méhlepény trophoblast sejtejeiben anabolikus hatású ösztrogénekké alakulnak (a DHEAS és DHEA ösztradiollá és ösztronná, a 16-OH-DHEAS ösztriollá), melyeknek kevesebb mint 15%-a a magzatba kerül, a többségük viszont az anyai keringésbe jut. A terhesség végén naponta termelődő 100 mg ösztrogén 80%-a magzati előanyagokból képződik. (A placentában nincs sem 17alfa-hidroxiláz, sem szteroid-17,20-liáz enzim, melyek az androgén-előanyagok termelődését katalizálnák, tehát ösztrogéntermelés csak a mellékvese-androgének felhasználásával történhet.)
Az anyai szervezetben a méhlepény által termelt progeszteron és ösztrogének együttes hatására a méh növekszik, és nyugalomban marad (nincsenek méhösszehúzódások), valamint az emlőszövet növekedése is fokozódik, miközben tejelválasztása gátlódik. A méhlepény által termelt progeszteron a magzati mellékvesekéreg kortizol- (glukokortikoid-) termeléséhez is nélkülözhetetlen, mivel a magzatban hiányos a 3β-hidroxiszteroid-dehidrogenáz/Δ5,4-izomeráz enzim szintézise, mely a pregnenolon-progeszteron átalakulást katalizálná.
A mellékvesekéreg által termelt glukokortikoidok nélkülözhetetlenek a tüdő méhen belüli fejlődéséhez, és a születés körüli időszakban a II. típusú pneumociták surfactant-termeléséhez is. (A surfactant egy felületaktív anyag, amelynek hiánya a léghólyagocskák összeeséséhez, és így légzési elégtelenséghez vezetne.)
A születés előtt a magzati mellékvese androgéntermelése csökken, miközben kortizoltermelése növekszik. A kortizol tovább fokozza a méhlepény ösztogénszintézisét, ami serkenti a méhen belüli prosztaglandin-termelést is. Mind az ösztrogének, mind a prosztaglandinok fontos szerepet játszanak a szülés megindításában:
- az ösztrogének növelik a méhnyakcsatorna képlékenységét, és fokozzák a méhizomzat oxitocin-érzékenységét;
- a prosztaglandinok pedig ugyancsak növelik a méhnyakcsatorna képlékenységét, és méhösszehúzódásokat váltanak ki.
A születés után az újszülött keringésének és kiválasztásának fenntartásában fontos szerepe van az aldoszteronnak. Az aldoszteron, az adrenalin és a noradrenalin a zavartalan alkalmazkodáshoz (adaptáció) is szükséges.
A születés után az androgéntermelő fötális kéreg hónapok alatt visszafejlődik (csupán a legkülső rétege marad fenn, mint zona reticularis), és az első 5-6 életévben az egész szerv androgéntermelése minimális mértékben zajlik.
Itt jegyezzük meg, hogy várandósság során az anyai mellékvesekérgeben jelentősen fokozódik az aldoszteron- (mineralokortikoid-) és kortizoltermelés, de a vérben ezek a hormonok javarészt kötött állapotban vannak, s az aktív hormonszint csak kisebb mértékben emelkedik.
Az emberi mellékvesevelő élettana
[szerkesztés]


A mellékvesevelő chromaffin sejtjeinek 20–25%-ában noradrenalin termelődik, 75–80%-ukban viszont a képződött noradrenalin továbbalakul adrenalinná. Ez biokémiailag metiláció révén történik, melyet egy enzim, a fenil-etanolamin-N-metiltranszferáz katalizál. Ennek az enzimnek a génje csak magas glukokortikoid-koncentráció esetén íródik át; ezt a feltételt a mellékvesekéregben termelődő, és a szinuszoid kapillárisok útján közvetlenül a velőbe áramló hormon biztosítja. A termelődött katecholaminok a chromaffin granulumokban tárolódnak, és a sejteket beidegző preganglionáris szimpatikus rostokon érkező ingerület hatására ürülnek a vérbe. A preganglionáris axonvégződésekből ugyanis acetilkolin szabadul fel, amely a chromaffin sejtek membránjában található nikotinos acetilkolin-receptor-ioncsatornához kötődik, amely kinyílik, az elektrokémiai gradiensnek megfelelően nátriumion áramlik a sejtbe, depolarizációt kiváltva. A depolarizáció hatására kinyílnak a feszültségfüggő kalciumion-csatornák, kalciumbeáramlást okozva, amely mint kalciumjel, a kontraktilis fehérjék aktivációján keresztül a chromaffin granulumok exocitózisát váltja ki. (A chromaffin sejteken nincs feszültségfüggő nátriumion-csatorna, így akciós potenciál nem jön létre.)
A katecholaminok felszabadulása a készenléti reakció része:
- növelik a szívfrekvenciát (pulzusszámot) és a szívösszehúzódások erejét (pozitív chronotrop, dromotrop, inotrop hatás);
- tágítják a működő vázizmokat ellátó ereket és a szívkoszorúereket (vasodilatator hatás);
- nagy koncentráció esetén növelik a teljes perifériás érellenállást (vasoconstrictor hatás) és így az artériás középnyomást (kivéve vérvesztés esetén, amikor az artériás középnyomás csökken);
- a tüdőben tágítják a hörgőket (bronchodilatator hatás);
- serkentik a májban a glikogenolízist és a glukoneogenzist, gátolják a hasnyálmirigyben az inzulinfelszabadulást, valamint fokozzák a zsírszövetben a lipolízist, így növekszik a glükóz-, szabad zsírsav- és glicerinfelszabadulás;
- sűrű, viszkózus nyál elválasztását okozzák;
- serkentik a gyomor sósavelválasztását;
- gátolják a tápcsatorna motoros működését;
- tágítják a pupillákat (mydriasis);
- piloerekciót (lúdbőr, felborzolt szőrzet) okoznak;
- az adrenalin fokozza a vérlemezkék aktiválódását.
A készenléti reakciót kiválhatja veszélyérzet és pszichés stressz (félelem, szorongás, aggódás), fizikai munka, fájdalom, sérülés, vérvesztés vagy extrém hideg, de a dohányzás is fokozza az adrenalinelválasztást. Nyugalomban, hanyatt fekve a vérplazma adrenalin-koncentrációja 20-50 pg/ml, noradrenalin-koncentrációja pedig 100-350 pg/ml. Nehéz fizikai munka hatására az előbbi 400 pg/ml fölé, utóbbi 2000 pg/ml fölé dúsulhat. Az adrenalin teljes mennyisége a mellékvesevelő terméke, míg a noradrenalin legnagyobb része nem innen, hanem a szimpatikus posztganglionáris axonokból származik.
Az emberi mellékvese kórtana
[szerkesztés]Hyperplasiák és daganatok
[szerkesztés]

A mellékvesekéreg-hiperplázia mindkét mellékvese kéregállományának túltengését, a mirigysejtek számának gyarapodását jelenti. Lehet diffúz, egyenletes kiszélesedéssel vagy noduláris, 0,5–2 cm átmérőjű, tok nélküli göböket képezve. A mellékvesekéreg-adenoma egyoldali, kerekded, tokkal rendelkező, jóindulatú daganat. A mellékvesekéreg-rák (carcinoma) rosszindulatú tumor, mely nagy méretűre nő, környezetébe hatol (invazív), és távoli áttéteket ad.
A mellékvesekéreg-hyperplasiák, -adenomák és -carcinomák lehetnek készhormon-termelőek, de funkcionálisan inaktívak is. A hormontúltermelődéssel járó állapotokat lejjebb részletezzük. A mellékvese nem hormontermelő daganatai közül a leggyakoribb a vérképző sejtekből és zsírszövetből álló myelolipoma.
A mellékvesevelő daganatai közül a phaeochromocytoma felnőtt kori, hormontermelő, differenciáltabb tumor, mely rendszerint jóindulatú, de rosszindulatú is lehet. Tokkal rendelkező, lebenyezett, sárgásbarna színű daganat, sokszögletű vagy orsó alakú, fészkeket vagy kötegeket alkotó tumorsejtekkel és dúsan erezett kötőszöveti vázzal. A katekolamin-túltermelés következményeit lejjebb részletezzük. A neuroblastoma rendszerint 5 éven aluliakat érintő, differenciálatlanabb, rosszindulatú daganat, mely a környezetébe (pl. vesébe, vénákba) terjedhet, és áttéteket is adhat (nyirokcsomóba, májba, tüdőbe, csontba, bőrbe). Általában tokkal rendelkező, szürkés színű, velős jellegű tumor, mely rozettákat képező, gyér sejtplazmájú, kis, ovoid, hiperkróm magvú daganatsejtekből és az idegszövetre is jellemző kötőszöveti vázból (neuropil) épül fel. A ganglioneuroblastoma ganglionsejteket és idegeket tartalmaz, a neuroblastoma kedvező prognózisú formájának felel meg, mely kiérik és ezzel gyógyul. A kiérett formát ganglioneuromának nevezzük. A neuroblastoma fibrózist vagy meszesedést hátrahagyva vissza is fejlődhet.
Mellékvesekéreg-alulműködés
[szerkesztés]Heveny mellékvesekéreg-elégtelenség (mellékvese-krízis)
[szerkesztés]
Heveny mellékvesekéreg-elégtelenség előfordulhat Waterhouse-Friderichsen-szindrómában, amely elsősorban gyermekkori bakteriális szepszisek (Neisseria meningitidis, Streptococcus pneumoniae, Haemophilus influenzae, Pseudomonas fajok) következménye, és szeptikus sokkal, disszeminált intravaszkuláris koagulapátiával (DIC), emiatt bőrbevérzésekkel (purpura) valamint a mellékvesék vérzéses infarktusával jár. A DIC feltételezhetően nem az egyetlen oka a mellékvese-elhalásnak, hanem emellett endotoxin okozta vagy túlérzékenységi érgyulladást (vasculitis) is feltételeznek oki tényezőként.
Más okból fellépő DIC valamint véralvadásgátló (antikoaguláns) kezelés is okozhat mellékvesevérzést. Újszülöttek mellékvesevérzése pedig elhúzódó születés során is előfordulhat a trauma és oxigénhiány (hypoxia) következtében.
Fertőzés vagy egyéb stressz hatására a lejjebb részletezett primer Addison-kór akut mellékvesekéreg-elégtelenségbe torkollhat. Ugyancsak okozhatja a nagy dózisú kokortikoszteroid-kezelés hirtelen felfüggesztése is.
Idült mellékvesekéreg-elégtelenség
[szerkesztés]Primer idült mellékvesekéreg-elégtelenség: Addison-kór
[szerkesztés]
Az Addison-kór (bronz-kór) primer idült mellékvesekéreg-elégtelenség, amely leggyakrabban autoimmun eredetű, de mindkét mellékvesét érintő gümőkór, amyloidosis, daganatáttét (tüdőrák, emlőrák), gombás fertőzés (Histoplasma capsulatum, Coccidioides immitis) miatt is kialakulhat. Autoimmun Addison-kórban a mellékvesekéreg sorvadt, fibrotikus, és a limfocitás beszűrtség mellett csak elszórtan láthatóak benne mirigysejt-szigetek. Az Addison-kór tünetei akkor válnak feltűnővé, amikor a mellékvesekéreg szövetének már kevesebb, mint 10%-a működőképes.
Ritka elváltozásról van szó (1 millió emberből 5-öt érint), főként fiatal-, középkorban jelentkezik. Tünetei az apátia, gyengeség, hiperpigmentáció (bőr elszíneződése) a tenyereken és a testhajlatokban, alacsony vérnyomás, izomgyengeség. Hormonvizsgálatok során reggel mért alacsony kortizol-szint és jelentősen magas ACTH-szint figyelhető meg. A betegség kezelése a hiányzó hormonok pótlásával lehetséges.
A mineralokortikoidok hiánya miatt egyrészt csökken a vér nátrium- és víztartalma, másrészt növekszik a kálium- és hirdogénion-tartalma. Az előbbiek következtében hipotóniás dehidráció (kiszáradás) alakul ki, a vér hipozmotikussá válik, ezért a víz felgyülemlik a sejtekben, a vérnyomás csökken (hypotensio), keringési és veseelégtelenség jön létre. Az emelkedett káliumszint (hyperkalaemia) a szívműködés károsodásához, keringési elégtelenséghez vezet, az emelkedett hidrogénionszint pedig acidózist jelent.
A glukokortikoidok hiánya miatt csökken a glükózképzés (glukoneogenezis) és elapadnak a máj és vázizomzat glikogénraktárai, melyek következtében, elsősorban terhelés során, csökken a vércukorszint (hypoglycaemia), és fokozódik az inzulinérzékenység. A katekolaminok csökkent hatásossága a szív- és keringési elégtelenség, vérnyomáscsökkenés fokozódásához vezet. Az ADH termelése emelkedik, ami a vízvisszatartás irányában hat, de a nátriumvesztésre nincs hatással, így hyponatraemia alakulhat ki. Csökken a fertőzésekkel szembeni ellenállóképesség is.
Az androgénhiány miatt gyérül a nők hónalj- és szeméremszőrzete, amenorrhoea alakulhat ki, valamint csökken a libidó is.
A betegség egyéb tünetei: általános gyengeség (adynamia), izomgyengeség, étvágytalanság, hányás, hasmenés, fogyás, ájulás, súlyos esetben kóma és halál. Primer mellékvesekéreg-elégtelenségben az ACTH-termelés kompenzatorikusan megnövekszik. Az ACTH-val együtt szekretálódó, és annak bomlásakor is képződő melanocyta-stimuláló hormon (MSH), valamint nagy koncentrációban maga az ACTH is a bőr és a nyálkahártyák bronzszínű pigmentációját váltja ki.
Szekunder és tercier mellékvesekéreg-elégtelenség
[szerkesztés]Szekunder mellékvesekéreg-elégtelenségben az ACTH-szekréció elégtelen, tercier elégtelenségben pedig a CRH-termelés szenved zavart. Az utóbbi hosszan tartó glukokortikoid-kezelés hirtelen abbahagyása miatt is kialakulhat. Szekunder és tercier formában a mineralokortikoidok termelése nem szenved zavart, és a kortizolszekréció sem szűnik meg teljesen.
Mellékvesekéreg-túlműködés
[szerkesztés]Mineralokortikoid-túltermelés, Conn-szindróma
[szerkesztés]
A hyperaldosteronismus az aldoszteron túltermelését jelenti. A Conn-szindrómát hormontermelő daganat vagy hiperplázia miatti primer hyperaldosteronismus okozza. Az aldoszteron-termelő adenoma 2 cm alatti, szoliter, gyakran a felszín alatt elhelyezkedő képlet, melynek szöveti szerkezete a zona fasciculata-ra hasonlít. Leggyakrabban 30-40 év közötti nőkben alakul ki. A Conn-szindrómát magas vérnyomás (hypertonia), nátrium- és vízvisszatartás, káliumvesztés (hypokalaemia) és alkalózis jellemzi. A vese vizelet-koncentráló képessége csökken (hypostenuria). A kezdeti magas nátriumszintet (hypernatraemia) a vese a fokozódó ürítéssel kompenzálja. A hypokalaemia miatt izomgyengeség, érzés- és látászavarok, szívizom-károsodás, esetleg tetania alakul ki.
A szekunder hiperaldoszteronizmus egy kompenzációs jelenség. Ha az egyébként ép vesében csökken a véráramlás (pl. vérvesztés, kiszáradás, májcirrhosis, nefrósis-szindróma, pangásos szívelégtelenség, nephrosclerosis, veseartériák szűkülete), aktiválódik a renin-angiotenzin rendszer, amely fokozott aldoszteronszekréciót vált ki. Az ADH-elválasztás is fokozódik, és a vízvisszatartás révén együttesen igyekeznek helyreállítani a keringő vértérfogatot.
Glukokortikoid-túltermelés: Cushing-szindróma
[szerkesztés]A primer, adrenális Cushing-szindróma oka glukokortikoid-termelő daganat vagy hiperplázia. Elhízás alakul ki, mely az arcra (ami ettől kikerekekedik: holdvilágarc), vállra, hátra és hasra lokalizálódik (cushingoid alkat), mindeközben viszont mobilizálódik is a raktározott zsír, és a szabad zsírsavak bomlástermékei ketózist és ketonaemiát okoznak. Fokozódik a fehérjék lebomlása is, és a nitrogénegyensúly negatívvá válik. Izomgyengeség alakul ki. A májban fokozódik a glikogén- és glukóztermelés, ami magas vércukorszinthez, ez pedig fokozott inzulintermelődéshez vezet (szteroid-diabétesz), ami később inzulinhiányba és valódi cukorbetegségbe mehet át (metaszteroid diabétesz). A diabétesz velejárói az olthatatlan szomjúság (polydipsia), bő vizelés (polyuria) és glükózvizelés (glucosuria). Magas vérnyomás jön létre. A vörösvértestszám magas (polycythaemia). A bőrön az elasztikus elemek pusztulása miatt livid (lila), vöröses striák jelennek meg (leginkább a hason és a farpofákon), valamint a bőr erei szakadékonyakká válnak, ami bevérzésekhez vezet. Csontritkulás (osteoporosis) alakul ki. Nőknél a havi vérzés elmarad (amenorrhoea), és a virilismus egyéb tünetei jöhetnek létre. Tudatzavar is fellép. A kortizol-túltermelés következtében csökken az agyalapi mirigy ACTH-képzése, így az egyébként ép mellékvesekéreg-területek sorvadnak, színük elhalványodik (lipiddepléció).
Iatrogén Cushing-szindrómát okozhat a kortikoszteroid-kezelés is, a fent leírt eltérésekkel.
Cusing-szindróma kialakulhat az agyalapi mirigy szabályozási zavara okozta ACTH-túltermelés miatt is. A Cushing-kór az agyfüggelékmirigy béta-sejtjeinek daganata következtében alakul ki. Paraneopláziás Cushing-szindrómában valamilyen nem endokrin jellegű daganat (pl. kissejtes tüdőrák) termel ACTH-t. CRH-termelő daganatok is léteznek, mely szintén ACTH-túltermelődéshez vezet.
Nemi hormonokat termelő mellékvesekéreg-daganatok
[szerkesztés]Androgéntermelő jó- vagy rosszindulatú daganatok nőkben virilizmushoz vezetnek: amenorrhoea, az emlők sorvadása, a csikló megnagyobbodása, fokozott szőrnövekedés (hirsutismus), a hang mélyülése és acne alakul ki. Várandós nőt érintő androgén-túltermelés a leánymagzat pszeudohermafroditizmusát okozhatja.
Ösztrogéntermelő daganat férfiakban gynecomastiát (az emlőmirigyek megnagyobbodását) és heresorvadást okoz.
A szteroidszintézist érintő enzimhibák
[szerkesztés]A szteroidtermelés zavarai egyes enzimek hibáiból fakadnak. Autoszomális recesszív öröklődésmenetűek. A hibás enzimtől függ, hogy mely szteroidhormonok termelése szenved zavart.
Adrenogenitális szindrómák
[szerkesztés]

A veleszületett adrenogenitális szindrómákban (veleszületett mellékvese-hiperplázia, congenitalis adrenalis hyperplasia, CAH) a kortizoltermelésben szerepet játszó 21-, 11β- vagy 17α-hidroxiláz enzim zavara áll fenn, így csökken a kortizolképzés. Kompenzatorikusan fokozódik az ACTH-termelés, ami jelentős mellékvese-hiperpláziához és az előbbi két formában az androgének túltermeléséhez is vezet. A 21-hidroxiláz enzim defektusa a leggyakoribb, 90%-ban ez okozza a tünetegyüttest.
Androgén-túltermeléskor a leánymagzatban részlegesen fiúnak megfelelő nemi fejlődés történhet (női álkevertneműség = pseudohermaphroditismus femineus: a belső nemi szervek zavartalan kialakulása mellett a külső nemi szervek valamilyen mértékben férfias irányban fejlődnek: pl. megnagyobbodott csikló, fuzionált szeméremajkak), majd születés után a test egy ideig erőteljesen növekszik (az epifízis-porckorongok záródásáig), de végül alacsony növés alakul ki. Korai virilisatio következik be, oligomenorrhoea (ritka havi vérzés), meddőség, hirsutismus (férfias szőrzet), pattanásosság (acne), mély hang és fejlett izomzat fejlődik ki. Fiúkban korai nemi érés (pubertas praecox), oligospermia (kis mennyiségű spermium az ejakulátumban) jelentkezik.
A 11β-hidroxiláz hiányakor az androgénekén kívül a 11-dezoxikortikoszteron (mineralokortikoid) túlzott képződése is jellemző, aldoszteron- és kortizolhiány mellett. Fokozott a nátriumvisszatartás, magas vérnyomás alakul ki, és káliumvesztés is fennáll a fenti tünetek mellett.
A 21-hidroxiláz hiányakor a kortizolhiányon túl mindkét mineralokortikoid termelése is károsodhat, emiatt alacsony nátriumszint (hyponatraemia), magas káliumszint (hyperkalaemia), acidózis, alacsony vérnyomás (hypotonia), keringési elégtelenség alakulhat ki, mely napokon belül az újszülött halálát okozhatja. Ez a betegség sóvesztő formája, de emellett egyszerű virilizáló forma is előfordulhat, valamint akár tünetmentes is lehet a betegség.
A 17α-hidroxiláz hiányakor a 11-dezoxikortikoszteron túltermelődik, kortizol- és androgénhiány mellett. A nátriumvisszatartás, magas vérnyomás és káliumvesztés erre az enzimdefektusra is jellemző. A fiúmagzatok külső nemi szervei leányosak maradnak, de a herék kifejlődnek; a leányoknál a méhen belüli fejlődés nem szenved zavart, de később nem indul meg náluk a peteérés és a menstruáció. Mivel termelődik kortikoszteron, nem alakul ki glukokortikoid-hiány.
Egyéb enzimdefektusok
[szerkesztés]Az oldallánchasító enzim defektusakor a koleszterin nem képes pregnenolonná alakulni, ami minden szteroid szintézisének az első lépése, ezért semmilyen szteroidhormon nem termelődik. Ezt a betegséget sóvesztés és korai halál jellemzi.
A 3béta-hidroxiszteroid-dehidrogenáz hiányakor a mineralo-, a glukokortikoidok és az androgének szintézise is zavart szenved. Sóvesztés és nőies fenotípus jellemző.
Mellékvesevelő-alulműködés
[szerkesztés]A mellékvesevelő alulműködése a kéreg alulműködésével együtt fordulhat elő pl. tuberkulózisban, vagy ritkábban izoláltan is. Mivel a velő által termelt katekolaminok inzulinantagonista hatásúak, kiesésük inzulintúlsúlyhoz és alacsony vércukorszinthez (hypoglycaemia) vezet. A készenléti reakcióban viszont a mellékvesevelő nélkülözhető, a szimpatikus idegrendszer további részei képesek a helyettesítésére.
Mellékvesevelő-túlműködés
[szerkesztés]A mellékvesevelő túlműködését katekolamin-termelő daganat, phaeochromocytoma okozhatja. Az adrenalin-termelő daganat rohamokban fellépő magas vérnyomást okoz fejfájással; a noradrenalin-termelő tumor tartós magas vérnyomást okoz, inkább mellkasi fájdalommal. A szívfrekvencia is magas (tachycardia), s cardiomiopathia, angina pectoris vagy szívinfarktus is kialakulhat. A beteg sápadt, a végtagjai hűvösek és cianotikusak a perifériás érszűkület következtében. Az inzulinszekréció csökken, és fokozódik a glukoneogenezis, így a vércukorszint magas. A lipolízis is fokozódik. A rohamok a mellékvese nyomásával vagy hisztamin adásával is provokálhatók. A phaeochromocytomák egyéb hormonokat is termelhetnek.
Források
[szerkesztés]- Ádám György, Fehér Ottó: Összehasonlító élettan. Tankönyvkiadó, Budapest, 1975. ISBN 963-17-0694-X
- Fonyó Attila: Az orvosi élettan tankönyve. 3. kiadás. Medicina Könyvkiadó, Budapest, 2006. ISBN 963-242-845-5
- Hajdu Ferenc: Vezérfonal a neuroanatómiához. 3. kiadás. Semmelweis Kiadó, Budapest, 2004. ISBN 963-9214-41-8
- Kopper László, Schaff Zsuzsa (szerk.): Patológia. 2., jav. kiadás. Medicina Könyvkiadó, Budapest, 2006. ISBN 963-226-075-9
- Papp Zoltán (szerk.): A szülészet-nőgyógyászat tankönyve. Semmelweis Kiadó, Budapest, 2007. ISBN 978-963-9656-17-8
- Röhlich Pál: Szövettan. 2. kiadás. Semmelweis Egyetem Képzéskutató, Oktatástechnológiai és Dokumentációs Központ, Budapest, 2002. ISBN 963-9129-38-0
- T. W. Sadler: Langman orvosi embryologia. 7. kiadás. Ford.: Hadházy Csaba, Lévai Géza. Medicina Könyvkiadó, Budapest, 2006. ISBN 963-242-035-7
- Szentágothai János, Réthelyi Miklós: Funkcionális anatómia. 8. kiadás, Medicina Könyvkiadó, Budapest, 2002. ISBN 963-242-564-2
- Szollár Lajos (szerk.): Kórélettan. 5. kiadás. Semmelweis Kiadó, Budapest, 2005. ISBN 963-9214-83-3

