Hidrogén-szelenid
| hidrogén-szelenid | |||
 A hidrogén-szelenid szerkezeti képlete |
 A hidrogén-szelenid kalottamodellje | ||
| IUPAC-név | hidrogén-szelenid | ||
| Más nevek | szelán szelén-hidrid | ||
| Kémiai azonosítók | |||
|---|---|---|---|
| CAS-szám | 7783-07-5 | ||
| PubChem | 533 | ||
| ChemSpider | 518 | ||
| KEGG | C01528 | ||
| ChEBI | 16503 | ||
| RTECS szám | X1050000 | ||
| |||
| |||
| InChIKey | SPVXKVOXSXTJOY-UHFFFAOYSA-N | ||
| Kémiai és fizikai tulajdonságok | |||
| Kémiai képlet | H2Se | ||
| Moláris tömeg | 80,99 g/mol | ||
| Megjelenés | színtelen gáz | ||
| Szag | torma | ||
| Sűrűség | 3,553 g/cm³ | ||
| Olvadáspont | -65,73 °C | ||
| Forráspont | -41,25 °C | ||
| Oldhatóság (vízben) | 0,70 g/100 ml | ||
| Oldhatóság | oldódik a következő anyagokban: CS2, foszgén | ||
| Savasság (pKa) | 3,89 | ||
| Kristályszerkezet | |||
| Molekulaforma | V alakú | ||
| Veszélyek | |||
| MSDS | ICSC 0284 | ||
| EU osztályozás | Tűzveszélyes (F+) Toxikus (T) Környezetre veszélyes (N) | ||
| EU Index | 034-002-00-8 | ||
| NFPA 704 | |||
| R mondatok | R23/25, R33, R50/53 | ||
| S mondatok | (S1/2), S20/21, S28, S45, S60, S61 | ||
| Lobbanáspont | gyúlékony gáz | ||
| Rokon vegyületek | |||
| Azonos kation | H2O H2S H2Te H2Po | ||
| Azonos anion | Na2Se Ag2Se | ||
| Rokon vegyületek | arzin | ||
| Ha másként nem jelöljük, az adatok az anyag standardállapotára (100 kPa) és 25 °C-os hőmérsékletre vonatkoznak. | |||
A hidrogén-szelenid szervetlen vegyület, képlete H2Se, a legegyszerűbb (és az egyetlen észlelt) szelén-hidrid. Standard körülmények között színtelen, gyúlékony gáz. A szelénvegyületek közül a legmérgezőbb,[1] egészségügyi határértéke (8 órás átlag) az USA-ban 0,05 ppm,[2][3] az EU-ban a foglalkozási expozíciós határértéke (OEL) nyolc órás idővel súlyozott átlaga (TWA) legfeljebb 0,02 ppm lehet.[4] Erősen irritáló szaga kis koncentrációban rothadt tormára, nagyobb töménységben záptojásra emlékeztet.
Szerkezete és tulajdonságai
[szerkesztés]A H−Se−H kötésszög 91 fokos, így molekulája V alakú. E szerkezettel összhangban három IR aktív rezgési sávja van: 2358, 2345 és 1034 cm−1.
Tulajdonságai a H2S-hez hasonlóak, bár savasabb nála: első pKa = 3,89, második pKa = 11,0 (25 °C-on). Vízben oldódik.
Szintézise
[szerkesztés]Az iparban elemi szelén és hidrogén egyesítésével állítják elő 300 °C felett.[5] Laboratóriumban Al2Se3 és víz reakciójával állítják elő, ebben a reakcióban a hidrogén-szelenid mellett alumínium-hidroxid keletkezik. Hasonló reakció a FeSe savas hidrolízise.[6]
- Al2Se3 + 6 H2O ⇌ 2 Al(OH)3 + 3 H2Se
Több más, vizes oldatban in situ történő előállítási módszere is ismert bór-hidrid, Marsh-próba vagy Devarda-féle ötvözet felhasználásával. A Sonoda-eljárásban víz, CO és szelén reakciójával állítják elő trietil-amin jelenlétében.[7] Gázpalackokban hozzák kereskedelmi forgalomba.
Reakciói
[szerkesztés]A hidrogén-szelenid és vízben oldott kén-dioxid reakciójakor víz, szelén és kén keletkezik:
- 2 H2Se + SO2 ⇌ 2 H2O + Se + S
Bomlását felhasználják nagy tisztaságú szelénfém előállítására.
Felhasználási lehetőségei
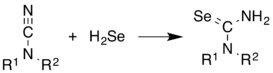
[szerkesztés]Gyakran használják szeléntartalmú vegyületek szintézisénél. Az alábbi példa szelenokarbamid előállítása ciánamidból:[8]
A H2Se gázt félvezetők gyártásánál szelénnel történő dópolásra használják .
Veszélyei
[szerkesztés]A hidrogén-szelenid a legmérgezőbb szelénvegyület,[1] sokkal mérgezőbb, mint a hidrogén-szulfid. Egészségügyi határértéke 0,05 ppm. 0,3 ppm felett irritáló hatású, ami a fő jele annak, hogy az ember hidrogén-szelenidnek van kitéve. 1,5 ppm-nél az irritáció már elviselhetetlen.[3] Nagyobb koncentrációnak való – akár egy percnél rövidebb ideig tartó – kitettség esetén megtámadja a szemet és a nyálkahártyákat, ami megfázásszerű tüneteket okoz néhány nappal később. Németországban a víz hidrogén-szelenid tartalma maximum 0,008 mg/l, az USA-ban az EPA ajánlása szerint maximum 0,01 mg/l lehet.[5][9]
Bár nagyon mérgező, haláleset nem köthető hozzá. Valószínűsítik, hogy ennek oka az, hogy a gáz hajlamos vörös szelénné oxidálódni a nyálkahártyákban, az elemi szelén pedig a szelenideknél jóval kevésbé mérgező.[2]
Hivatkozások
[szerkesztés]- ↑ a b http://www.epa.gov/ttnatw01/hlthef/selenium.html, US Environmental Protection Agency, Air Toxins website
- ↑ a b http://www.cdc.gov/niosh/idlh/7783075.html, Documentation of Immediately Dangerous to Life or Health Concentrations: Hydrogen Selenide, The National Institute for Occupational Safety and Health
- ↑ a b http://www.cdc.gov/niosh/docs/81-123/pdfs/0336.pdf Occupational Health Guideline for Hydrogen Selenide, The National Institute for Occupational Safety and Health, 1978
- ↑ Archivált másolat. [2016. március 4-i dátummal az eredetiből archiválva]. (Hozzáférés: 2014. március 28.)
- ↑ a b Bernd E. Langner "Selenium and Selenium Compounds" in Ullmann's Encyclopedia of Industrial Chemistry, 2005, Wiley-VCH, Weinheim. doi:10.1002/14356007.a23_525.
- ↑ Féher, F. In "Handbook of Preparative Inorganic Chemistry"; Brauer, E., Ed.; Academic: New York, 1963; 1, p 418.
- ↑ Sonoda, N.; Kondo K.; Nagano, K.; Kambe, N.; Morimoto, F. Angewandte Chemie, International Edition English 1980, vol. 19, page 308
- ↑ V.I. Cohen "A Convenient Synthesis of Mono-, N,N′-Di-, and Trisubstituted Selenoureas from Methyl Carbamimidothioates (S-Methylpseudothioureas)" Synthesis, 1980, 60-3 (1980).
- ↑ http://www.osha.gov/dts/chemicalsampling/data/CH_246700.html Archiválva 2012. május 16-i dátummal a Wayback Machine-ben, OSHA GENERAL INDUSTRY PEL: 0.05 ppm, 0.2 mg/m3 ,OSHA CONSTRUCTION INDUSTRY PEL: 0.05 ppm, 0.2 mg/m3 TWA
Fordítás
[szerkesztés]Ez a szócikk részben vagy egészben a Hydrogen selenide című angol Wikipédia-szócikk ezen változatának fordításán alapul. Az eredeti cikk szerkesztőit annak laptörténete sorolja fel. Ez a jelzés csupán a megfogalmazás eredetét és a szerzői jogokat jelzi, nem szolgál a cikkben szereplő információk forrásmegjelöléseként.