B-limfocita

A B-sejtek vagy B-limfociták az adaptív immunrendszer nyiroksejtjei, melyek alapvető szerepet játszanak a humorális immunválaszban.[1][2] A B-sejtek a sejtfelszínükön fajlagos antigén felismerést biztosító receptorral rendelkeznek (B-sejt receptor, angolul: B-cell receptor, BCR). Egyetlen B-sejt klón csak egy konkrét antigén felismerésére képes, mely ellen plazmasejtté érve specifikus ellenanyagokat termel. A B-sejtek emellett az antigének T-sejteknek való bemutatásában is fontos szerepet játszanak. A primer immunválasz során egy részük memória B-sejtté alakul, ezzel részt vesznek az immunológiai memória fenntartásában is. A B-sejtek emlősökben a csontvelőben fejlődnek ki, míg madarakban az ún. Fabricius-tömlőből (latinul: Bursa Fabricii), utóbbi alapján nevezték el őket B, mint "Bursa eredetű" limfocitáknak.[3] A B-sejtek normális aránya a vérben az életkortól,[4] nemtől és rassztól függően változó,[5] a kaukázusi emberrasszban durván az összes limfocita 5-15 százaléka B-sejt az egészséges felnőttek perifériás vérében,[6] melyeken belül további alcsoportok azonosíthatók, amik eltérő jellemzőkkel és funkciókkal rendelkeznek. A B-sejtek számos betegségben fontos szerepet játszanak, és arányuk a különböző kórképekben jelentősen változhat, egyes immunhiányokban csökkenhet,[7] míg a B-sejtekből kiinduló leukémiák esetén jelentősen emelkedhet,[8] de autoimmun betegségekben is eltérhet a normálistól.
Felosztásuk, emberi B-sejt alcsoportok
[szerkesztés]A B-sejtek jelen ismereteink szerint számos alcsoportra oszthatók, melyek eltérő módon fejlődnek ki a szervezetben és különböző funkciókat látnak el. Az ezekkel kapcsolatos kutatások döntő többsége egér kísérletekből származik, ezek ember megfelelőiről sokkal kevesebb ismeret áll rendelkezésre. Minden B-sejten megtalálható a CD19 molekula, mely tehát a B-sejtek általános markere,[9] az egyes alcsoportokat pedig a rájuk jellemző molekuláris mintázat (immunfenotípus) alapján lehet elkülöníteni.[2]
| A fontosabb B-sejt típusok | ||
|---|---|---|
| Típus | Immunfenotípusa emberben | Funkció |
| B1 B-sejt | Vitatott, feltehetően CD20(+)CD27(+)CD43(+)CD70(-) és CD5(+) vagy CD5(-)[10] | Polispecifikus, IgM izotípusú természetes autoantitestek termelése. |
| B2 B-sejt | Érési stádiumtól és alcsoporttól függ, többségük CD5(-)[11][12] | A hagyományos (konvencionális) B-sejtek, hacsak külön nem jelölik, általában ezt a csoportot értik B-sejt alatt. |
| Follikuláris B-sejt | Sejtfelszíni IgM és/vagy IgD(+), CD20(+)CD21(+)CD23(+)CD5(-) | Nyiroktüszőkben található B2 B-sejt. |
| Marginális zóna B-sejt | Emberben vitatott | Az egér lép marginális zónájában leírt, speciális B2 B-sejtek, melyek a tokos baktériumok elleni korai immunválaszban játszanak szerepet, emberben kérdéses a létezésük.[13][14] |
| Memória B-sejt | CD27(+), azon belül további alcsoportok[15] | Az immunológiai memória fenntartása.[16] |
| Plazmasejt | CD19(+)CD38(+)CD138(+)CD20(-)CD56(-)[17][18] | Differenciált, antitestet termelő B-sejt. |
| Regulatórikus B-sejt | CD19(+)CD25(+)CD27(+)[19] | Az immunfunkciók természetes csökkentése IL-10, IL-35 és TGFβ termelésén keresztül.[20] |
A B-sejtek fejlődése, B-sejt előalakok
[szerkesztés]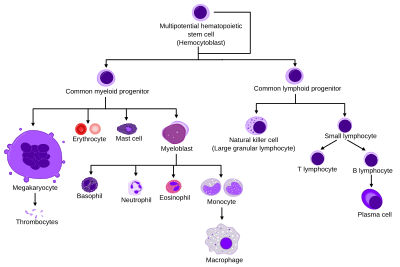
A B-sejtek a csontvelőben található hemopoetikus őssejtekből (HSC, hematopoietic stem cell) alakulnak ki. A csontvelői mikrokörnyezet, az ottani stromasejtek által termelt citokinek, kemokinek, sejtfelszíni molekulák szabályozzák, hogy a hemopoetikus őssejt milyen irányba fejlődjön tovább, a sejtben pedig az egyes irányokba történő elköteleződést különböző transzkripciós faktorok szabályozzák. Egérben az Flt3 és az IL-7 citokineknek van központi szerepe a B-sejt irányú fejlődésében, emberben azonban az IL-7 nem szükséges a B-sejtek fejlődéséhez.[21] A HSC-k limfoid irányú differenciációjában az Ikaros,[22] a PU.1[23] és a TCF3 (más néven E2A)[24] transzkripciós faktoroknak van meghatározó szerepe. A PU.1 nagyfokú expressziója mieloid irányú elköteleződést eredményez, míg ha a sejt csak alacsony szinten expresszálja, akkor elsősorban B-limfocita irányba fejlődik tovább és elveszíti a mieloid irányú differenciáció képességét.[25] Miután a sejt elköteleződött a limfoid irányba, ún. közös limoid progenitor (CLP) alakul ki belőle, melyből T, NK, B, vagy limfoid dendritikus sejt fejlődhet ki. A B-sejt irányú fejlődést az E2A, az EBF és a PAX5 transzkripciós faktorok vezérlik a sejtben.[26]
Az egyes B-sejt előalakok fejlődése során, még a csontvelőben az immunglobulin géneket érintő szomatikus génátrendeződés következtében egyedi, az adott B-sejtre jellemző B-sejt receptor jön létre. Ezekben a folyamatokban kulcsfontosságú szerep jut a Rag-1 és Rag-2 (rekombinációt aktiváló gén),[27] illetve a TdT (terminális dezoxinukleotidil transzferáz) enzimeknek.[28] Elsőként a 14. kromoszómán kódolódó immunglobulin nehéz lánca rendezőzik át, a genomban számos V (variable), D (diversity) és J (joining) gén szegmens található, ezek kombinációiból jöhet létre az immunglobulin nehéz láncának variábilis régiója, ami az antigén-kötő helyet tartalmazza. A sejtben véletlenszerűen kiválasztódik és egymás mellé rendeződik egy-egy V, D, és J szegmens (VDJ rekombináció), melyek megmaradnak, a többi szegmens a sejtben véglegesen törlődik a genomból. A létrejött VDJ szakasz együtt íródik át a nehéz lánc konstans régióját kódoló Cμ (IgM) és Cδ (IgD) szegmensekkel RNS-sé, majd arról fehérje képződik. Ezt követően a sejt megjeleníti a felszínén az átrendezett nehéz láncot és egy ún. pót könnyű láncot tartalmazó pre-B-sejt receptort (pre-BCR).[29] Ha a nehézlánc átrendezése sikeres volt, akkor a pre-B-sejt receptoron keresztül a környező sejtektől túlélési jelet kap, és megkezdi a könnyű lánc átrendezését is, ami hasonló elvek alapján történik, azzal a különbséggel, hogy a variábilis régiót kódoló részből hiányzik a D szegmens, illetve a konstans régió is eltér, a sejtben vagy kappa (κ) vagy lambda (λ) konstans régiójú könnyű lánc íródhat át. A génátrendeződés eredményeként egy teljesen random antigént felismerni képes B-sejt receptor jön létre a sejtben, és ugyanezt az antigént fogja felismerni a később ebből a B-sejtből kialakult plazmasejt által szekretált ellenanyag is. A VDJ génátrendeződés felfedezéséért 1987-ben Tonegava Szuszumu orvosi Nobel-díjat kapott.[30][31]
Funkciók
[szerkesztés]Az antigén felismerése
[szerkesztés]A csontvelőből ún. érett, naiv B-sejtek kerülnek a vérkeringésbe. Érettek, mert a csontvelőben zajló, még antigéntől független érésen már átestek, a felszínén génátrendeződés következtében minden egyes csontvelőből kikerülő B-sejten egyedi antigénfelismerő B-sejt receptor foglal helyet, és naivak, mert még nem találkoztak a receptoruk által felismerhető antigénnel. A vérkeringésből ezek a sejtek a másodlagos nyirokszervekbe vándorolnak (pl. nyirokcsomók, lép). A másodlagos nyirokszervek az általuk szűrt területről érkező antigének dúsítása miatt növelik az esélyét annak, hogy a B-sejtek antigénnel találkozzanak (pl. a nyirokcsomók az általuk drenált területről érkező nyirkot, a lép a vérkeringést szűri). Amennyiben a B-sejt nem találkozik általa felismerhető antigénnel, rövid időn belül apoptózist szenved.
Mivel a B-sejt receptor (BCR) voltaképp egy sejtfelszíni immunglobulin molekula, a B-sejtek a T-limfocitáktól eltérően változatlan, natív formában ismerik fel az antigént, nincs szükség arra, hogy antigén prezentáló sejt (angolul: antigen presenting cell, APC) azt felvegye, feldolgozza, és az MHC II molekulán keresztül bemutassa, mint ahogy a T-sejtek esetén az szükséges.[1]
B-sejt aktiváció, klonalitás
[szerkesztés]
A B-sejtek a keringésből a másodlagos nyirokszervekbe kerülnek, amiken belül az ún. B-sejt zónákba vándorolnak. Ezt a folyamatot különböző, B-sejteket vonzó kemokinek vezérlik, amiket a B-sejt zóna kialakításáért felelős sejtek termelnek (pl. follikuláris dendritikus sejt a nyirokcsomókban).[32] Ezen sejtek körül gyűlnek össze a B-sejtek, kialakítva a nyiroktüszőket. Itt kerülnek kapcsolatba az antigénekkel is. Egyrészt az érkező vérrel vagy nyirokkal szolubilis antigének (pl. a szétesett kórokozókból származó fehérjék) jutnak be a B-sejt zónákba, másrészt az egész kórokozókat az FDC-k (follikuláris dendritikus sejt) képesek megkötni és helyben tartani a B-sejteknek. Ez nem valódi antigén bemutatás, hiszen az FDC ebben az esetben nem dolgozza fel az antigént, pusztán natív formában lehorgonyozza a sejtfelszínén és elérhetővé teszi a B-sejtek számára. Egyetlen B-sejt csak egy konkrét antigént ismerhet fel. Amennyiben a B-sejt receptor képes megkötni az antigént, megtörténik a B-sejt aktiváció, a B-sejt osztódásnak indul. Ennek következményeként az eredeti B-sejttel azonos antigénfelismerésű utódsejtek, ún. klónok keletkeznek, melyek ugyanolyan BCR-rel rendelkeznek. Ezt a folyamatot nevezik klonális szelekciónak, melynek lényege, hogy a sokféle B-sejtből kiválasztódnak és felszaporodnak azok, melyek antigént ismertek fel. Azok a B-sejtek, amik nem ismertek fel antigént, visszakerülnek a véráramba és más nyirokszervekbe vándorolnak antigént keresve, majd amennyiben nem találnak, elpusztulnak.
A nyiroktüszőkben osztódó és érő B-sejtek fénymikroszkóppal jól elkülöníthető zónákat hoznak létre. Az ún. centrum germinativum reakció során a tüsző belsejében található sötét zónában foglalnak helyet az antigénfelismerést követően osztódó B-sejtek, melyeket centroblasztoknak neveznek, és itt zajlik az úgynevezett affinitás érés is. Ezt a világos zóna veszi körül, itt az osztódott B-sejtek, az ún. centrociták antigénfüggő érése (pl. izotípus váltás) történik, melyhez azonban a helper T-sejtek is szükségesek. A B-sejtekben az antigénstimulust követően az immunglobulin molekulák variábilis régióját kódoló génekben új mutációk jelennek meg (ún. szomatikus hipermutáció). Ez sok esetben hátrányos, mivel csökkenti a B-sejt receptor antigénkötő erősségét, ebben az esetben a sejtek elpusztulnak. Az előnyös mutációk azonban szelekciós előnyt jelentenek, és ezek a sejtek fennmaradnak.[33] Utóbbi folyamatok növelik a termelt antitestek antigénkötő erősségét, illetve biztosítják, hogy ugyanazt az antigént felismerő, de eltérő izotípusú és ezáltal különböző funkciókat betöltő antitestek is termelődjenek.[1]
Helper T-sejtek szerepe a B-sejt aktivációban
[szerkesztés]Az antigén természetétől függően a B-sejtek aktivációja többféleképpen is végbemehet. Alapvetően T-sejt függő és T-sejt független aktiváció jöhet létre.
T-dependens antigének
[szerkesztés]
A T-sejt dependens aktiváció a fehérje természetű antigénekre jellemző. Fehérjék esetén az antitest termelés kiváltásához szükség van a T-sejtek egyidejű aktivációjára és a B-sejtekkel való kölcsönhatásuk kialakulásához is. A fehérjéket azon túl, hogy a B-sejt receptor natív formában megköti, az antigénprezentáló sejtek (APC) fel is veszik a környezetükben, feldolgozzák, és MHC II molekulán keresztül bemutatják a CD4 pozitív helper T-sejteknek (TH). A nyiroktüszőben korábban antigénstimuluson átesett B-sejtek a T/B zónák határára vándorolnak. Ezt a folyamatot a T-sejt zónában termelődő kemokinek (pl. a CCL19 és CCL21) irányítják a B-sejtek felszínén található kemokin receptorokon (pl. CCR7) keresztül.[34][35] TH-sejtek magában a nyiroktüszőkben is találhatók (ún. follikuláris T-helper sejtek, TFH).[36] Ezt követően létrejön a T-B kölcsönhatás, mely során a B-sejtek MHC II molekulán keresztül bemutatják az általuk is felismert antigént a helper T-sejteknek. A T-sejtek ennek hatására aktiválódnak, új kostimulációs molekulákat kezdenek megjeleníteni a felszínükön, mely folyamat szükséges a T-sejt függő B-sejt aktivációhoz. Ilyen molekula pl. a CD40 ligand (CD40L, más néven CD154), melyet a B-sejtek CD40-je köt meg és mindkét sejtben erősíti az aktivációs jelet. Emellett a T-sejtek citokineket is termelnek, melyek a B-sejtek aktivációján kívül voltaképp megszabják, hogy a B-sejtekben lezajló izotípus váltás során a kezdeti IgM helyett plazmasejtként majd milyen izotípusú antitestet termeljenek. A T-B kölcsönhatás a fentieken kívül szükséges az antigént felismerő memória B-sejtek kialakulásához is.
A T- és B-sejtek egymást stimuláló reakciója nélkülözhetetlen az izotípus váltás és az affinitás érés létrejöttében. Jól ismert veleszületett immunhiányos állapot az ún. hiper-IgM szindróma, melynek hátterében leggyakrabban a CD40 vagy a CD40L mutációja áll.[37] A genetikai hiba eredményeként nem tud lezajlani a B-sejtekben az izotípus váltás, ezért azok kizárólag IgM izotípusú ellenanyagokat képesek termelni, ám azt ebből kifolyólag nagy mennyiségben. Mivel a különböző izotípusú ellenanyagok különböző funkciókat töltenek be, a kieső típusú antitestek miatt a kórállapot immunhiányhoz vezet.
T-independens antigének
[szerkesztés]Bizonyos antigének T-sejt független B-sejt aktivációt képesek csak előidézni. A T-independens B-sejt aktivációnak két típusát különböztetik meg, az azokat előidéző ágensek az ún. TI-1 és a TI-2 antigének. A T-dependens antigénekkel ellentétben ezek nem fehérje természetűek, hanem például poliszacharidok, nukleinsavak, de ide sorolható a Gram-negatív baktériumok sejtfalában található lipopoliszcaharid (LPS) is. Ezek ugyan képesek lehetnek önmagukban is aktiválni a B-sejteket, azonban mivel az affinitás érés, az izotípus váltás és a memória B-sejtek létrehozása is zömmel T-dependens folyamatok, az ezek ellen kialakuló válasz kevésbé hatékony. Ugyanakkor újabb kutatások alapján ezen antigének ellen megjelennek T-sejttől függetlenül is memória B-sejtek, melyek azonban eltérnek a T-sejt függő módon kialakuló memória B-sejtektől.[38] A TI-1 antigének, mint amilyen például az LPS, nem-specifikus módon poliklonális B-sejt aktivációt képesek előidézni. TI-2 antigének (pl. bakteriális poliszacharid láncok) jellemzően repetitív elemeket tartalmaznak, amik képesek keresztbe kötni a B-sejtek felszínén található B-sejt receptorokat. Utóbbi folyamat elsősorban a poliszacharid tokkal rendelkező kórokozókkal (pl. Streptococcus pneumoniae, Hemophilus influenzae, Neisseria meningitidis) szembeni immunválaszra jellemző. Ezen antigének elleni immunválasz jobb megértése segíthet az ellenük kialakított védőoltások hatékonyságának növelésében. Mivel önmagában a bakteriális poliszacharidokkal való oltás nem járna effektív immunológiai memória kialakulásával, ezért a védőoltásokban azokat nem önmagukban, hanem különböző fehérjékhez kötve alkalmazzák (konjugált vakcina).[39]
Antitest termelés
[szerkesztés]
Az aktivációt és sejtosztódásokat követően a B-sejtek jelentős része plazmasejtté alakul. Plazmasejtként nagy mennyiségben kezd termelni és szekretálni ellenanyagot. A termelt ellenanyag ugyanazt azt antigént fogja megkötni, amit a sejt korábban a B-sejt receptorral is felismert. A termelt ellenanyag izotípusa attól függ, hogy a sejt átesett-e korábban izotípus váltáson, annak hiányában alapból IgM-et termelnek. Az izotípus váltás időigényes folyamat és a helper T-sejtek közreműködése is szükséges hozzá. Az aktivált B-sejtek egy része azonban nem plazmasejtté, hanem helper T-sejtek segítségével memória B-sejté alakul. Ezek hosszú élettartamú sejtek, melyek az antigénnel való ismételt találkozás (másodlagos immunválasz) esetén aktiválódnak, újból osztódnak és antitest termelő plazmasejtekké alakulnak. Mivel ezek korábban már átestek az affinitás érésen és az izotípus váltáson, a másodlagos immunválasz sokkal gyorsabb és hatékonyabb.[16] Ezen a mechanizmuson alapul az aktív immunizálás védőoltások segítségével.
B-sejt receptor jelátvitel
[szerkesztés]
A B-sejt receptor (BCR) szerkezetét tekintve egy sejtmembránba ágyazott immunglobulin molekula, amely, akárcsak a plazmasejtek által kiválasztott ellenanyagok, egyedi antigén felismeréssel rendelkezik. A sejtmembránban helyet foglaló receptorhoz a citoplazmában számos egyéb jelátvivő molekula kapcsolódik. Az immunglobulinnak önmagában nincsen enzimatikus aktivitása, az antigénkötést követően azonban a hozzá kapcsolódó kinázok aktiválódnak és különböző fehérjék foszforilációjával egy sor jelátviteli utat indítanak be a sejtben, mely végső soron annak aktivációját idézi elő.[40] Ebben a kezdeti lépésben a CD79a (más néven Igα) és CD79b (Igβ) molekulának van döntő szerepe, melyek az immunglobulinhoz kapcsoltan vannak jelen és ITAM (immunreceptor tirozin-alapú aktivációs mintázat, angolul: immunoreceptor tyrosine-based activation motif) doménekkel rendelkeznek.[41] Antigénkötés esetén a BCR komplex konformációja megváltozik, aminek hatására a LYN tirozin-kináz foszforilálja ezeket az ITAM doméneket. A foszforilált ITAM-okhoz az SH2 doménekkel rendelkező jelátvivő molekulák tudnak kapcsolódni, pl. a SYK vagy FYN, melyek maguk is tirozin-kináz aktivitással rendelkeznek. A jelátvitel további szakaszában döntő jelentőségű a SYK (angolul: spleen tyrosine kinase) és a BTK (Bruton tirozin-kináz), utóbbi mutációja esetén nem fejlődnek ki érett B-sejtek a betegben és súlyos antitest-hiánnyal járó, ún. X-hez kötött agammaglobulinémia (XLA) alakul ki.[42]
B-sejtek szerepe betegségekben
[szerkesztés]Immunhiányos állapotok
[szerkesztés]B-sejtes daganatok
[szerkesztés]Autoimmun betegségek
[szerkesztés]Ajánlott irodalom
[szerkesztés]- Gergely János, Erdei Anna (szerk.): Immunbiológia (3. kiadás), Medicina Könyvkiadó Rt., 2006. Budapest, ISBN 963-242-932-X
Jegyzetek
[szerkesztés]- ↑ a b c Ollila J, Vihinen M. (2005. March). „B cells.” (angol nyelven). Int J Biochem Cell Biol. 37 (3), 518-23. o. DOI:10.1016/j.biocel.2004.09.007. PMID 15618007.
- ↑ a b LeBien TW, Tedder TF. (2008. September). „B lymphocytes: how they develop and function.” (angol nyelven). Blood. 112 (5), 1570-80. o. DOI:10.1182/blood-2008-02-078071. PMID 18725575.
- ↑ Davison TF. (2003. March). „The immunologists' debt to the chicken.” (angol nyelven). Br Poult Sci. 44 (1), 6-21. o. DOI:10.1136/ard.62.8.722. PMID 12737220.
- ↑ Morbach H, Eichhorn EM, Liese JG, Girschick HJ. (2010. November). „Reference values for B cell subpopulations from infancy to adulthood.” (angol nyelven). Clin Exp Immunol. 162 (2), 271-9. o. DOI:10.1111/j.1365-2249.2010.04206.x. PMID 20854328.
- ↑ Tollerud DJ, Clark JW, Brown LM, Neuland CY, Pankiw-Trost LK, Blattner WA, Hoover RN. (1989. May). „The influence of age, race, and gender on peripheral blood mononuclear-cell subsets in healthy nonsmokers.” (angol nyelven). J Clin Immunol. 9 (3), 214-22. o. PMID 2788656.
- ↑ Reichert T, DeBruyère M, Deneys V, Tötterman T, Lydyard P, Yuksel F, Chapel H, Jewell D, Van Hove L, Linden J, et al. (1991. August). „Lymphocyte subset reference ranges in adult Caucasians.” (angol nyelven). Clin Immunol Immunopathol. 60 (2), 190-208. o. PMID 1712687.
- ↑ Vickery JD, Michael CF, Lew DB. (2013. August). „Evaluation of B lymphocyte deficiencies.” (angol nyelven). Cardiovasc Hematol Disord Drug Targets. 13 (2), 133-43. o. PMID 23988001.
- ↑ Campo E, Swerdlow SH, Harris NL, Pileri S, Stein H, Jaffe ES. (2011. May). „The 2008 WHO classification of lymphoid neoplasms and beyond: evolving concepts and practical applications.” (angol nyelven). Blood. 117 (19), 5019-32.. o. DOI:10.1182/blood-2011-01-293050. PMID 21300984.
- ↑ Wang K, Wei G, Liu D. (2012. November). „CD19: a biomarker for B cell development, lymphoma diagnosis and therapy.” (angol nyelven). Exp Hematol Oncol. 1 (1), 36. o. DOI:10.1186/2162-3619-1-36. PMID 23210908.
- ↑ Rothstein TL, Griffin DO, Holodick NE, Quach TD, Kaku H. (2013. May). „Human B-1 cells take the stage.” (angol nyelven). Ann N Y Acad Sci. 1285, 97-114. o. DOI:10.1111/nyas.12137. PMID 23692567.
- ↑ Sims GP, Ettinger R, Shirota Y, Yarboro CH, Illei GG, Lipsky PE. (2005. June). „Identification and characterization of circulating human transitional B cells.” (angol nyelven). Blood. 105 (11), 4390-8. o. DOI:10.1111/nyas.12137. PMID 15701725.
- ↑ Lee J, Kuchen S, Fischer R, Chang S, Lipsky PE. (2009. April). „Identification and characterization of a human CD5+ pre-naive B cell population.” (angol nyelven). J Immunol. 182 (7), 4116-25. o. DOI:10.4049/jimmunol.0803391. PMID 19299709.
- ↑ Weill JC, Weller S, Reynaud CA. (2009). „Human marginal zone B cells.” (angol nyelven). Annu Rev Immunol. 27, 267-85. o. DOI:10.1146/annurev.immunol.021908.132607. PMID 19302041.
- ↑ Steiniger BS. (2015. July). „Human spleen microanatomy: why mice do not suffice.” (angol nyelven). Immunology. 145 (3), 334-46. o. DOI:10.1111/imm.12469. PMID 25827019.
- ↑ Sanz I, Wei C, Lee FE, Anolik J. (2008. February). „Phenotypic and functional heterogeneity of human memory B cells.” (angol nyelven). Semin Immunol. 20 (1), 67-82. o. DOI:10.1016/j.smim.2007.12.006. PMID 18258454.
- ↑ a b Kurosaki T, Kometani K, Ise W. (2015. March). „Memory B cells.” (angol nyelven). Nat Rev Immunol. 15 (3), 149-59. o. DOI:10.1038/nri3802. PMID 25677494.
- ↑ Harada H, Kawano MM, Huang N, Harada Y, Iwato K, Tanabe O, Tanaka H, Sakai A, Asaoku H, Kuramoto A. (1993. May). „Phenotypic difference of normal plasma cells from mature myeloma cells.” (angol nyelven). Blood. 81 (10), 2658-63. o. PMID 8490175.
- ↑ Bataille R, Jégo G, Robillard N, Barillé-Nion S, Harousseau JL, Moreau P, Amiot M, Pellat-Deceunynck C. (2006. September). „The phenotype of normal, reactive and malignant plasma cells. Identification of "many and multiple myelomas" and of new targets for myeloma therapy.” (angol nyelven). Haematologica. 91 (9), 1234-40. o. PMID 16956823.
- ↑ Kessel A, Haj T, Peri R, Snir A, Melamed D, Sabo E, Toubi E. (2012. July). „Human CD19(+)CD25(high) B regulatory cells suppress proliferation of CD4(+) T cells and enhance Foxp3 and CTLA-4 expression in T-regulatory cells.” (angol nyelven). Autoimmun Rev. 11 (9), 670-7. o. DOI:10.1016/j.autrev.2011.11.018. PMID 22155204.
- ↑ Rosser EC, Mauri C. (2015. April). „Regulatory B cells: origin, phenotype, and function.” (angol nyelven). Immunity. 42 (4), 607-12. o. DOI:10.1016/j.immuni.2015.04.005. PMID 25902480.
- ↑ Prieyl JA, LeBien TW. (1996. September). „Interleukin 7 independent development of human B cells.” (angol nyelven). Proc Natl Acad Sci U S A. 93 (19), 10348-53. o. PMID 8816803.
- ↑ Yoshida T, Ng SY, Zuniga-Pflucker JC, Georgopoulos K. (2006. April). „Early hematopoietic lineage restrictions directed by Ikaros.” (angol nyelven). Nat Immunol. 7 (4), 382-91. o. DOI:10.1038/ni1314. PMID 16518393.
- ↑ Scott EW, Fisher RC, Olson MC, Kehrli EW, Simon MC, Singh H. (1997. April). „PU.1 functions in a cell-autonomous manner to control the differentiation of multipotential lymphoid-myeloid progenitors.” (angol nyelven). Immunity. 6 (4), 437-47. o. DOI:10.1016/S1074-7613(00)80287-3. PMID 9133423.
- ↑ Dias S, Månsson R, Gurbuxani S, Sigvardsson M, Kee BL. (2008. August). „E2A proteins promote development of lymphoid-primed multipotent progenitors.” (angol nyelven). Immunity. 29 (2), 217-27. o. DOI:10.1016/j.immuni.2008.05.015. PMID 18674933.
- ↑ DeKoter RP, Singh H. (2000. May). „Regulation of B lymphocyte and macrophage development by graded expression of PU.1.” (angol nyelven). Science. 288 (5470), 1439-41. o. DOI:10.1126/science.288.5470.1439. PMID 10827957.
- ↑ Ichii M, Oritani K, Kanakura Y. (2014. September). „Early B lymphocyte development: Similarities and differences in human and mouse.” (angol nyelven). World J Stem Cells. 6 (4), 321-31. o. DOI:10.4252/wjsc.v6.i4.421. PMID 25258663.
- ↑ Schatz DG, Ji Y. (2011. April). „Recombination centres and the orchestration of V(D)J recombination.” (angol nyelven). Nat Rev Immunol. 11 (4), 251-63. o. DOI:10.1038/nri2941. PMID 21394103.
- ↑ Repasky JA, Corbett E, Boboila C, Schatz DG. (2004. May). „Mutational analysis of terminal deoxynucleotidyltransferase-mediated N-nucleotide addition in V(D)J recombination.” (angol nyelven). J Immunol. 172 (9), 5478-88. o. DOI:10.4049/jimmunol.172.9.5478. PMID 15100289.
- ↑ Zhang M, Srivastava G, Lu L. (2004. April). „The pre-B cell receptor and its function during B cell development.” (angol nyelven). Cell Mol Immunol. 1 (2), 89-94. o. PMID 16212894.
- ↑ Tonegawa S. (1983. April). „Somatic generation of antibody diversity.” (angol nyelven). Nature. 302 (5909), 575-81. o. PMID 6300689.
- ↑ The Nobel Prize in Physiology or Medicine 1987 (angol nyelven). Nobelprize.org. (Hozzáférés: 2015. augusztus 6.)
- ↑ Wang X, Cho B, Suzuki K, Xu Y, Green JA, An J, Cyster JG. (2011. November). „Follicular dendritic cells help establish follicle identity and promote B cell retention in germinal centers.” (angol nyelven). J Exp Med. 208 (12), 2497-510. o. DOI:10.1084/jem.20111449. PMID 22042977.
- ↑ Shlomchik MJ, Weisel F. (2012. May). „Germinal center selection and the development of memory B and plasma cells.” (angol nyelven). Immunol Rev. 247 (1), 52-63. o. DOI:10.1111/j.1600-065X.2012.01124.x. PMID 22500831.
- ↑ Reif K, Ekland EH, Ohl L, Nakano H, Lipp M, Förster R, Cyster JG. (2002. March). „Balanced responsiveness to chemoattractants from adjacent zones determines B-cell position.” (angol nyelven). Nature. 416 (6876), 94-9. o. DOI:10.1038/416094a. PMID 11882900.
- ↑ Pereira JP, Kelly LM, Cyster JG. (2010. June). „Finding the right niche: B-cell migration in the early phases of T-dependent antibody responses.” (angol nyelven). Int Immunol. 22 (6), 413-9. o. DOI:10.1093/intimm/dxq047. PMID 20508253.
- ↑ Ramiscal RR, Vinuesa CG. (2013. March). „T-cell subsets in the germinal center.” (angol nyelven). Immunol Rev. 252 (1), 146-55. o. DOI:10.1111/imr.12031. PMID 23405902.
- ↑ Bhushan A, Covey LR. (2001). „CD40:CD40L interactions in X-linked and non-X-linked hyper-IgM syndromes.” (angol nyelven). Immunol Res. 24 (3), 311-24. o. PMID 11817328.
- ↑ Defrance T, Taillardet M, Genestier L. (2011. June). „T cell-independent B cell memory.” (angol nyelven). Curr Opin Immunol. 23 (3), 330-6. o. DOI:10.1016/j.coi.2011.03.004. PMID 21482090.
- ↑ Mond JJ, Kokai-Kun JF. (2008). „The multifunctional role of antibodies in the protective response to bacterial T cell-independent antigens.” (angol nyelven). Curr Top Microbiol Immunol. 319, 17-40. o. PMID 18080413.
- ↑ Seda V, Mraz M. (2015. March). „B-cell receptor signalling and its crosstalk with other pathways in normal and malignant cells.” (angol nyelven). Eur J Haematol. 94 (3), 193-205. o. DOI:10.1111/ejh.12427. PMID 25080849.
- ↑ Monroe JG. (2006. April). „ITAM-mediated tonic signalling through pre-BCR and BCR complexes.” (angol nyelven). Nat Rev Immunol. 6 (4), 283-94. o. DOI:10.1038/nri1808. PMID 16557260.
- ↑ Vihinen M, Mattsson PT, Smith CI. (2000. December). „Bruton tyrosine kinase (BTK) in X-linked agammaglobulinemia (XLA).” (angol nyelven). Front Biosci. 5, D917-28. o. PMID 11102316.
