T-limfocita


A T-limfociták vagy T-sejtek a fehérvérsejtek egyik alcsoportja, amely központi szerepet játszik a sejtes immunválasz működésében. Más limfocitáktól (mint B-limfociták, természetes ölősejtek) a felületükön található T-sejt-receptor által különíthetőek el. Nevük onnan származik, hogy a tímuszban (vagy csecsemőmirigyben) válnak éretté[1] (bár kis hányaduk a mandulákban válik érett T-sejtté).[2] A T-sejteket több alcsoportra osztjuk, amelyek különböző funkciókkal bírnak. Az emberi T-sejtek döntő többsége a szerzett immunválasz folyamatában vesz részt, míg egy kisebb csoportjuk (amely a kérődzők esetében jóval gyakoribb) nem variálódó T-sejt receptorral rendelkezik, képesek antigéneket prezentálni a többi T-limfocitának és a veleszületett immunrendszer részének tekintik őket.[3]
Alcsoportok
[szerkesztés]A T-limfocitákat aktivitásuk szerint effektorokra és memóriasejtekre osztják. Az effektorok (ide tartoznak a helper, citotoxikus, regulációs stb.) T-sejtek, amelyek aktívan reagálnak a stimulusokra. Funkció szerinti felosztásuk a következő:
Helper T-sejtek
[szerkesztés]A helper (segítő) T-sejtek (TH sejtek) a többi fehérvérsejtnek segítenek immunológiai feladataikban; ide tartozik a B-sejtek érése plazmasejtté és memória B-sejtté, vagy a citotoxikus T-sejtek és makrofágok aktiválása. A csoportba tartozó sejtek közös jellemzője, hogy felszínükön hordozzák a CD4 glikoproteint. A helper T-sejtek akkor válnak aktiválttá, amikor egy antigénprezentáló sejt kapcsolatba lép velük és prezentál számukra egy MHC II (fő hisztokompatiblitási komplex II) komplexhez kapcsolódott szervezetidegen antigént. Az aktivált helper sejtek gyors ütemben osztódnak és az immunrendszert szabályozó szignálmolekulákat, citokineket választanak ki. A későbbiekben további altípusokba differenciálódnak tovább, megkülönböztetnek TH1, TH2, TH3, TH17, TH9 vagyTFH sejteket, amelyek más-más citokineket termelnek és másfajta immunválaszt váltanak ki.[4]
Citotoxikus (vagy killer) T-sejtek
[szerkesztés]
A citotoxikus T-sejtek (TC-sejtek vagy killer T-sejtek) elpusztítják a szervezet vírusfertőzött vagy rákos transzformáción átesett sejtjeit. Ők felelősek a szervátültetés során a kilökődési reakcióért is. CD8+ T-sejtekként is hivatkoznak rájuk legjellemzőbb felszíni markerük alapján. Célpontjukat az annak a felszínén található MHC I komplexum és a hozzá kapcsolódóan prezentált patogén (vagy tumormarker) antigén alapján ismerik fel. Az MHC I-et egyébként valamennyi, sejtmaggal rendelkező sejt felszínén megtalálható. Interleukin 10, adenozin és egyéb, regulációs T-sejtek által kibocsátott szignálmolekulák segítségével a CD8+ sejtek inaktiválhatók, így előzve meg az autoimmun betegségeket.
Regulációs (vagy szupresszor) T-sejtek
[szerkesztés]A regulációs T-sejtek folyamatosan felügyelik az immuntoleranciát, azt hogy az immunrendszer ne támadja meg a saját szöveteket. Egy fertőzés vagy egyéb immunreakció végeztével lekapcsolják a sejtes immunválaszt, illetve kiiktatják azokat a T-sejteket, amelyek valamiért nem megfelelően szelektálódtak érésük során és idegenként jelölve meg a saját antigéneket autoimmun betegséget indítanának el. Néha a helper sejteket is a regulációs csoportba sorolják.[5]
A CD4+ Treg sejteknek két nagy alcsoportja ismert, a FOXP3+ Treg és a FOXP3− Treg sejtek.
A regulációs T-sejtek vagy a tímuszban a limfociták szokásos fejlődési helyén, vagy periferiálisan alakulnak ki. A két alcsoportot korábban "természetes" és "adaptív" (vagy "indukált") T-limfocitáknak nevezték.[6] Mindkettőben aktiválódik a FOXP3 transzkripciós faktor génje. A gén mutációja halálos kimenetelű autoimmun betegséget, az IPEX-et okozhatja.
Vannak olyan szupresszor T-sejtek, amelyek nem expresszálnak FOXP3-at. Ezek a Tr1 (1. típusú regulációs T-sejtek), a Th3 vagy a Treg17 alcsoportok, amelyekről azt feltételezik, hogy az immunválasz során alakulnak ki és szupresszív szignálmolekulákat képesek kiválasztani. A Tr1-ek interleukin 10-et a Th3-ak TGF-bétát szekretálhatnak.[7]
NKT-sejtek
[szerkesztés]A natural killer T-sejtek (nem összetévesztendő a veleszületett immunrendszerhez tartozó natural killer, vagy NK-sejtekkel) összekötő kapcsot jelentenek a veleszületett és adaptív immunrendszer között. Míg a többi T-sejt az MHC-komplexhez kapcsolódó antigéneket ismeri fel, az NKT-sejtek a CD1d fehérjéhez kötődő glikolipid antigénekhez kapcsolódhatnak. Aktiválásuk után egyaránt képesek a helper vagy citotoxikus T-sejtekhez köthető funkciók ellátására (mint a citokintermelés vagy a célsejtek elpusztítása) Képesek egyes tumorsejtek vagy a herpeszvírusokkal fertőzött sejtek felismerésére is kiiktatására is.[8]
Mucosa-asszociált invariáns T-sejtek
[szerkesztés]A mucosa-asszociált invariáns T-sejtek (MAIT-ok) tulajdonságaik alapján effektorszerű sejtek és a veleszületett immunrendszerhez tartozhatnak.[9][10] Az emberek esetében a vérben, májban, tüdőben és a nyálkahártyákon fordulnak elő, ahol a mikrobák kolonizációja ellen védik a szervezetet.[9] A szöveti sejtekben a MHC I-szerű MR1 fehérje megköti a baktériumok által termelt B-vitamin metabolitokat és prezentálja azt a MAIT-ok számára.[11][12][13] Az így aktivált MAIT gyulladáskeltő citokineket kezd termelni, de közvetlenül is képes elpusztítani a megfertőzött sejtet.[9][13] Az MR1-út mellett más módon is aktiválhatóak.[13] Bár a fenti funkciója alapján a veleszületett immunrendszerhez lenne sorolható, citokintermelésével képes az adaptív immunválasz segítésére, fenotípusa szerint pedig leginkább a memóriasejtekhez hasonlít.[9] Feltételezik, hogy a MAIT-ok részleges szerepet játszanak olyan autoimmun folyamatokban, mint a szklerózis multiplex, reuma vagy bélgyulladás.[14][15]
Memória T-sejtek
[szerkesztés]A naiv T sejtek a prezentált antigénnel való találkozás után aktiválódnak és ezután megfelelő kostimulánsok hatására egy részük memóriasejtekké alakul át. Korábban úgy vélték, hogy a memória T-sejteknek két alcsoportja létezik (amelyeket felszíni markereik alapján lehet elkülöníteni), az effektor és a centrális, ám azóta több másik altípust felfedeztek, mint pl a szöveti-, a virtuális- vagy a memória-őssejtet.[16] Közös jellemzőjük, hogy hosszú az élettartamuk és ha ismét találkoznak a rájuk specifikus antigénnel, gyors osztódással effektor utódsejteket hoznak létre. Így az immunrendszer a patogén újabb támadására jóval előbb tud reagálni. A memóriasejtek mind a CD4+, mind a CD8+ alcsoportba tartozhatnak és általában a CD45RO marker is megtalálható a felszínükön.[17]
A memória T-sejtek altípusai:
- a centrális memóriasejtek (TCM sejtek) felszínén CD45RO, C-C kemokinreceptor 7 (CCR7) és L-szelektin (CD62L) markerek találhatóak; ezenfelül a CD44-it is expresszálják közepes vagy nagy mennyiségben. Ez a szubpopuláció elsősorban a nyirokcsomókban és a periferiális keringésben fordul elő (egerek esetében a CD44 kifejezése megkülönbözteti a naiv és memória T-sejteket).
- az effektor memória T-sejtek (TEM és TEMRA sejtek) felszínén megtalálható a CD45RO, de a CCR7 és az L-szelektin nem. Ők is közepes vagy nagy mennyiségben termelnek CD44-et. Elsősorban a periferiális keringésben és a szövetekben találhatóak meg.[18] A véglegesen differenciált effektor memóriasejtek (TEMRA) felszínén megtalálható a CD45RA, amely inkább a naiv T-sejtekre jellemző.[19]
- a szöveti memóriasejtek (TRM) nevüknek megfelelően a szövetekben (tüdő, bőr, stb.) találhatóak meg. Egyik jellemző markerük az integrin αeβ7.[20]
- a virtuális memóriasejtek abban különböznek a többi alcsoporttól, hogy nem egy erőteljes klonális szaporodási eseményből származnak. Emiatt - bár összességében viszonylag gyakoriak a periferiális keringésben - az egy bizonyos antigénre reagáló memóriasejtből kevés van. Ebben az alcsoportban CD8+ és CD4+ sejtek is megtalálhatóak.[21] [22]
Gamma-delta T-sejtek
[szerkesztés]A gamma-delta T-sejtek (γδ T-sejtek) egy kis létszámú alcsoportot alkotnak, amelyek jellegzetessége a különleges T-sejt receptor. A T-limfociták többségének receptora egy α- és egy β-láncból tevődik össze, míg a γδ T-sejteknél egy γ- és egy δ-láncból. Emberben és egérben ez az altípus igen ritka és főleg az emésztőrendszer nyálkahártyáiban található meg. Nyúl, birka és tyúk esetében viszont a γδ T-sejtek az összes T-limfocita 60%-át is kitehetik. Az őket aktiváló molekulák nem teljesen ismertek, de azt tudjuk, hogy nem korlátozódik az MHC-ra és képesek egész fehérjéket is felismerni.
Kialakulásuk
[szerkesztés]Valamennyi T-sejt végső soron a csontvelő vérképző őssejtjeiből származik. Az itteni elődsejtek (limfoid progenitor sejtek) a tímuszba vándorolnak, ahol osztódással éretlen timocitákká alakulnak át.[23] Legkorábbi stádiumukban a timociták sem CD4-et, sem CD8-at nem expresszálnak (dupla negatív, CD4−CD8− timociták), majd a fejlődés során mindkét markert megjelenítik (dupla pozitív CD4+CD8+ sejtek). Végül egyszeres pozitív (CD4+CD8− vagy CD4−CD8+) timocitákká alakulnak, elhagyják a tímuszt és a periferiális szövetekbe vándorolnak. Egyes esetekben a dupla pozitív sejtek is kikerülnek a perifériára, de funkciójuk és jelentőségük nem tisztázott.[24][25]
A timociták 98%-a fejlődésük során a pozitív vagy negatív szelekció révén elpusztul. A maradék 2% érett, immunkompetens T-limfocitaként hagyja el a tímuszt. A tímusz (vagy csecsemőmirigy) a kor előrehaladtával egyre kevesebb limfocitát állít elő és a középkorú emberekben mérete évente kb. 3%-kal csökken.[26] Az idősek immunrendszerében így a periferiális T-sejt proliferáció egyre nagyobb szerepet játszik.
Béta-szelekció
[szerkesztés]A tímuszba vándorló limfoid prekurzor sejtek még nem tartalmaznak T-sejt receptort. A receptor β-lánca a dupla negatív fázis során kezd termelődni, majd a dupla pozitív stádiumban megindul az α-lánc termelése is, így ezek a sejtek már funkcionális T-sejt receptorral rendelkeznek. Mindkét lánc génje genetikai rekombináción megy át az érés során, így egyedi receptorok keletkeznek. A dupla negatív fázisban az α-lánc változatlan, az átrendeződött β-láncnak pedig megfelelően illeszkednie kell hozzá. Az illeszkedés sejten belüli szignált produkál, amely leállítja a β-rekombinációt és lehetővé teszi a sejt további osztódásait. Szignál hiányában a fejlődés leáll és a sejt elpusztul.[27] A dupla pozitív fázisban az α-lánc átrendeződése történik meg.
Pozitív szelekció
[szerkesztés]A T-sejtek pozitív szelekciója során az MHC-vel kapcsolatot kialakítani képtelen sejtvonalak szelektálódnak ki. A kettős pozitív (CD4+/CD8+) fázisban lévő timociták a tímusz kérgébe (cortexébe) vándorolnak, ahol a szervezet saját antigénjeivel találkoznak. Ezeket az antigéneket a cortex epiteliális sejtjei prezentálják felszínükön MHC komplexszel kapcsoltan. Azok a timociták amelyek megfelelően kötődnek a komplexhez (nem túl erősen és nem túl gyengén) egy továbbhaladási szignált kapnak, míg a többiek ilyen szignál hiányában idővel elpusztulnak. Ez a folyamat biztosítja, hogy csak az alapvető funkcióját megfelelően ellátó T-sejtek kerülnek ki a keringésbe. A timociták döntő többsége elpusztul ebben a fázisban.
A pozitív szelekció során dől el, hogy a timocitából melyik alcsoportba tartozó T-sejt lesz. Az MHC II-höz jól illeszkedő dupla pozitív sejtekből CD4+ helper sejtek, míg a MHC I-affinitással rendelkezőkből CD8+ citotoxikus T-limfocita lesz; a folyamat során a másik marker génje kikapcsolódik.[28]
A pozitív szelekció során még megmaradnak a szervezet saját antigénjeivel reagáló, autoimmun betegségeket okozó timociták. Ezeket az ezt követő negatív szelekció válogatja ki.
Negatív szelekció
[szerkesztés]A pozitív szelekciót túlélő timociták a cortex és a medulla határára vándorolnak. A medullában a helyi AIRE+ és MHC I+ epiteliális sejtek ismételten prezentálják számukra a szervezet saját antigénjeit.[29] Néhány epiteliális sejtet a tímusz dendritikus sejtjei bekebeleznek és antigénjeiket az MHC II-komplexhez kapcsoltan prezentálják a CD4+ timociták számára. A saját antigénekhez erősen kapcsolódó timocuták apoptózis révén elpusztulnak (egy kis hányadukból regulációs T-sejt lesz). A negatív szelekciót túlélők az éretlen vagy naiv T-sejtek.[30]).
Összegzésül: a T-sejtek érése során a béta-szelekció az első ellenőrző pont, ahol csak megfelelően illeszkedő alfa és béta láncokkal rendelkező sejtvonalak jutnak tovább. A következő lépés a pozitív szelekció, ahol azt ellenőrzik, hogy a sejt képes-e felismerni az MHC-antigén komplexet. A negatív szelekció elpusztítja azokat a sejtvonalakat, amelyek a saját antigénekhez kapcsolódva autoimmun reakciót indítanának be.
Aktiváció
[szerkesztés]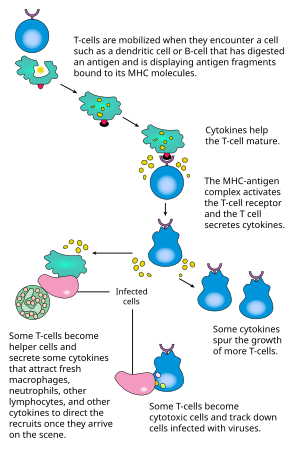
A CD4+ T-sejtek aktiválásakor a felszínén található T-sejt receptorok és az egyéb kostimulátor molekulák (mint a CD28 vagy CD278) összekapcsolódnak egy antigénprezentáló sejt MHC II-antigén komplexével és kostimulátoraival. A naiv T-sejt kostimulációs receptorához, a CD28-hoz az antigénprezentáló sejt részéről olyan felszíni fehérjék kapcsolódnak, mint a CD80 és a CD86; komplexüket B7-nek nevezik. Az aktivált sejt más receptorokat is expresszál, mint az OX40 vagy a CD278, de ezek kifejeződése alapvetően a CD28-tól függ.
A kostimuláció elmaradása anergiás, működésképtelen T-limfocitákat eredményez. A megfelelően aktivált T-sejt felszíni proteinjei megváltoznak, megjelenik a CD69, a CD71, a CD25 (ez a regulációs T-sejtek egyik markere is) és a HLA-DR. A CTLA-4 fehérje szintje is megnő és kiszorítja a CD28-at a B7-komplexből; ezáltal megakadályozza a sejt "túlaktiválását". Az aktivált sejt felszíni glikozilációs mintázata is megváltozik.[31] A sejt belsejében egy viszonylah bonyolult szignáltovábbító láncolat eredményeképpen aktiválódik a NFAT transzkripciós faktor, amely bekapcsolja az érett T-sejt működéséhez szükséges géneket, többek között az interleukin 2-t (amely fenntartja az aktivált sejt proliferációját).
Ritka esetekben előfordul az aktivációnak valamilyen alternatív útja; például a citotoxikus T-sejtek azáltal is aktiválódhatnak, hogy egy másik CD8 T-sejt kapcsolódik hozzájuk.[32]
Klinikai elváltozások
[szerkesztés]A T-sejtek elégtelensége
[szerkesztés]A T-sejtek elégtelenségét a sejtek számának csökkenése (limfocitopénia) vagy a funkciójuk hibás ellátása okozhatja. Teljes elégtelenséget okozhat olyan genetikai betegség, mint a súlyos kombinált immundefektus (SCID), az Omenn-szindróma vagy a porc-haj hipoplázia.[33] A T-sejtek hiányára visszavezethető immundefektust okoz a szerzett immunhiány szindrómája (AIDS), az öröklött DiGeorge-szindróma (DGS), a kromoszómainstabilitási szindrómák, vagy a T- és B-sejtek hiányával járó ataxia-telangiektázia (AT) és a Wiskott–Aldrich-szindróma (WAS).[33]
A T-sejtek számának visszaesését okozhatják olyan patogének, mint a herpesz szimplex-vírus, a mikobaktériumok vagy a Listeria.[34] T-sejthiány esetén a gombás fertőzések jellemzően jóval súlyosabbak.[34]
Tumor
[szerkesztés]A T-limfociták tumoros elváltozását T-sejtes limfómának nevezik és a non-Hodgkin limfómáknak kb. a tizedét teszik ki.[35] A T-sejtes limfómák gyakoribb formái a következők:
- extranodális T-sejtes limfóma
- kután T-sejtes limfómák: Sézary-szindróma és mycosis fungoides
- anaplasztikus nagysejtes limfóma
- angioimmunoblasztikus T-sejtes limfóma
Jegyzetek
[szerkesztés]- ↑ Alberts B, Johnson A, Lewis J, Raff M, Roberts k, Walter P (2002) Molecular Biology of the Cell. Garland Science: New York, NY pg 1367.
- ↑ (2012. április 1.) „Evidence for a stepwise program of extrathymic T cell development within the human tonsil”. The Journal of Clinical Investigation 122 (4), 1403–15. o. DOI:10.1172/JCI46125. PMID 22378041. PMC 3314444.
- ↑ (2013. február 1.) „Six-of-the-best: unique contributions of γδ T cells to immunology”. Nature Reviews. Immunology 13 (2), 88–100. o. DOI:10.1038/nri3384. PMID 23348415. PMC 3951794.
- ↑ (2007) „APC-derived cytokines and T cell polarization in autoimmune inflammation”. J. Clin. Invest. 117 (5), 1119–27. o. DOI:10.1172/JCI31720. PMID 17476341. PMC 1857272.
- ↑ Textbook of Medical Physiology by Guyton and Hall, edition 6, pg. 448, Suppressor T cells paragraph.
- ↑ (2013) „Regulatory T cells: recommendations to simplify the nomenclature”. Nat. Immunol. 14 (4), 307–8. o. DOI:10.1038/ni.2554. PMID 23507634.
- ↑ (2013) „Modulation of autoimmune diseases by interleukin (IL)-17 producing regulatory T helper (Th17) cells”. Indian J. Med. Res. 138 (5), 591–4. o. PMID 24434314. PMC 3928692.
- ↑ (2007. május 1.) „Invariant and noninvariant natural killer T cells exert opposite regulatory functions on the immune response during murine schistosomiasis”. Infection and Immunity 75 (5), 2171–80. o. DOI:10.1128/IAI.01178-06. PMID 17353286. PMC 1865739.
- ↑ a b c d (2015. július 6.) „The Role of Mucosal Associated Invariant T Cells in Antimicrobial Immunity”. Frontiers in Immunology 6, 344. o. DOI:10.3389/fimmu.2015.00344. PMID 26217338. PMC 4492155.
- ↑ (2011. augusztus 1.) „Mucosal associated invariant T cells and the immune response to infection”. Microbes and Infection 13 (8-9), 742–8. o. DOI:10.1016/j.micinf.2011.03.007. PMID 21458588. PMC 3130845.
- ↑ (2015. december 1.) „Recognition of Vitamin B Precursors and Byproducts by Mucosal Associated Invariant T Cells”. The Journal of Biological Chemistry 290 (51), 30204–11. o. DOI:10.1074/jbc.R115.685990. PMID 26468291. PMC 4683245.
- ↑ (2014. október 8.) „Mucosal-associated invariant T-cells: new players in anti-bacterial immunity”. Frontiers in Immunology 5, 450. o. DOI:10.3389/fimmu.2014.00450. PMID 25339949. PMC 4189401.
- ↑ a b c (2015. június 16.) „MR1-Restricted Mucosal-Associated Invariant T Cells and Their Activation during Infectious Diseases”. Frontiers in Immunology 6, 303. o. DOI:10.3389/fimmu.2015.00303. PMID 26136743. PMC 4468870.
- ↑ (2016. május 1.) „Mucosal-associated invariant T cells in autoimmunity, immune-mediated diseases and airways disease”. Immunology 148 (1), 1–12. o. DOI:10.1111/imm.12582. PMID 26778581. PMC 4819138.
- ↑ (2017. március 1.) „Invariant natural killer T cells and mucosal-associated invariant T cells in multiple sclerosis”. Immunology Letters 183, 1–7. o. DOI:10.1016/j.imlet.2017.01.009. PMID 28119072.
- ↑ (1999) „Two subsets of memory T lymphocytes with distinct homing potentials and effector functions.”. Nature 401, 708–712. o. DOI:10.1038/44385. PMID 10537110.
- ↑ (1988. április 1.) „Loss of CD45R and gain of UCHL1 reactivity is a feature of primed T cells”. J. Immunol. 140 (7), 2171–8. o. PMID 2965180.
- ↑ (2005) „Molecular signatures distinguish human central memory from effector memory CD8 T cell subsets.”. Journal of Immunology 175 (9), 5895–903. o. DOI:10.4049/jimmunol.175.9.5895. PMID 16237082.
- ↑ (2008) „Multiparameter flow cytometric analysis of CD4 and CD8 T cell subsets in young and old people.”. Immunity & Ageing 5 (6). DOI:10.1186/1742-4933-5-6. PMID 18657274. PMC 2515281.
- ↑ (2013. szeptember 1.) „Tissue-resident memory T cells”. Immunological Reviews 255 (1), 165–81. o. DOI:10.1111/imr.12087. PMID 23947354. PMC 3748618.
- ↑ (2011) „Alternative memory in the CD8 T cell lineage.”. Trends in Immunology 32 (2), 50–56. o. DOI:10.1016/j.it.2010.12.004. PMID 21288770. PMC 3039080.
- ↑ (2017) „CD4+ virtual memory: Antigen-inexperienced T cells reside in the naïve, regulatory, and memory T cell compartments at similar frequencies, implications for autoimmunity.”. Journal of Autoimmunity 77, 76–88. o. DOI:10.1016/j.jaut.2016.11.001. PMID 27894837.
- ↑ (2006. február 1.) „Trafficking from the bone marrow to the thymus: a prerequisite for thymopoiesis”. Immunological Reviews 209, 47–57. o. DOI:10.1111/j.0105-2896.2006.00350.x. PMID 16448533.
- ↑ (2015. január 1.) „CD4+/CD8+ double-positive T cells: more than just a developmental stage?”. Journal of Leukocyte Biology 97 (1), 31–8. o. DOI:10.1189/jlb.1RU0814-382. PMID 25360000.
- ↑ (2017. szeptember 1.) „+ double-positive T cells in skin-draining lymph nodes respond to inflammatory signals from the skin”. Journal of Leukocyte Biology 102 (3), 837–844. o. DOI:10.1189/jlb.1AB0217-065R. PMID 28637895.
- ↑ (2000) „The role of the thymus in immune reconstitution in aging, bone marrow transplantation, and HIV-1 infection”. Annu. Rev. Immunol. 18, 529–60. o. DOI:10.1146/annurev.immunol.18.1.529. PMID 10837068.
- ↑ Janeway, Charles. Immunobiology. Garland Science, 301–305. o. (2012). ISBN 9780815342434
- ↑ (1997. március 1.) „The MHC reactivity of the T cell repertoire prior to positive and negative selection” (english nyelven). Cell 88 (5), 627–36. o. DOI:10.1016/S0092-8674(00)81905-4. PMID 9054502.
- ↑ (2010. június 1.) „Autonomous role of medullary thymic epithelial cells in central CD4(+) T cell tolerance”. Nature Immunology 11 (6), 512–9. o. DOI:10.1038/ni.1874. PMID 20431619.
- ↑ (2017. augusztus 1.) „Neonatal and adult recent thymic emigrants produce IL-8 and express complement receptors CR1 and CR2”. JCI Insight 2 (16). DOI:10.1172/jci.insight.93739. PMID 28814669.
- ↑ (2015) „Glycans in the immune system and The Altered Glycan Theory of Autoimmunity”. J Autoimmun 57 (6), 1–13. o. DOI:10.1016/j.jaut.2014.12.002. PMID 25578468. PMC 4340844.
- ↑ (2011. január 1.) „CTLs respond with activation and granule secretion when serving as targets for T cell recognition”. Blood 117 (3), 1042–52. o. DOI:10.1182/blood-2010-05-283770. PMID 21045195. PMC 3035066.
- ↑ a b Medscape > T-cell Disorders. Author: Robert A Schwartz, MD, MPH; Chief Editor: Harumi Jyonouchi, MD. Updated: May 16, 2011
- ↑ a b Infection: Microbiology and Management. Wiley-Blackwell, 435. o. (2006). ISBN 1-4051-2665-5
- ↑ The Lymphomas (PDF). The Leukemia & Lymphoma Society, 2006. május 1. [2008. július 6-i dátummal az eredetiből archiválva]. (Hozzáférés: 2008. április 7.)
Fordítás
[szerkesztés]- Ez a szócikk részben vagy egészben a T cell című angol Wikipédia-szócikk ezen változatának fordításán alapul. Az eredeti cikk szerkesztőit annak laptörténete sorolja fel. Ez a jelzés csupán a megfogalmazás eredetét és a szerzői jogokat jelzi, nem szolgál a cikkben szereplő információk forrásmegjelöléseként.
