Amin-oxid

Az amin-oxid, más néven amin-N-oxid vagy N-oxid R3N+–O− funkciós csoportot (nitrogén-oxigén koordinációs kötés) tartalmazó vegyület 3 további hidrogénatommal vagy oldallánccal. Néhány helyen R3N→O[1] vagy R3N=O képlettel jelölik.
Szigorú értelemben az amin-oxid fogalom csak tercier aminok oxidjait jelenti. Más esetekben a megfelelő primer- és szekunderamin-származékokra is használják.
Amin-oxidok például a piridin-N-oxid (62–67 °C olvadáspontú vízoldékony szilárd anyag) és a N-metilmorfolin-N-oxid, mely oxidáns.
Alkalmazás
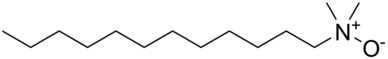
[szerkesztés]Az amin-oxidok gyakran samponokban, kondicionálókban, mosószerekben és felülettisztító szerekben használt felületaktív anyagok.[2] Az alkil-dimetilamin-oxidok (lánchossz: C10–C16) a leggyakrabban használtak.[3] Ezek nagy mennyiségben termelt anyagok az OECD több tagországában, az éves termelés több mint 26 000 tonna az Amerikai Egyesült Államokban, 16 000 tonna Európában és 6800 tonna Japánban.[2] Észak-Amerikában az amin-oxidok több mint 95%-át tisztítószerekben használják fel.[4] Stabilizálóként, viszkozitásnövelőként, lágyítószerként, emulgeálószerként és kondicionálóként használják 0,1–10% koncentrációban.[2] A maradékot (<5%) a testápolókban, ipari, kereskedelmi termékekben[5] és szabadalmaztatott esetekben, például fényképészetben használják.[2]
Jellemzők
[szerkesztés]Az amin-oxidokat aminok védőcsopoprtjaként és köztitermékként használják. A hosszú láncú alkilamin-oxidok használhatók amfoter felületaktív szerként és habstabilizátorként.
Az amin-oxidok erősen poláris molekulák, polaritásuk közel van a kvaterner ammóniumsókéhoz. A kis amin-oxidok erősen hidrofilek, és vízoldékonyak, a legtöbb szerves oldószer gyengén oldja-
Az amin-oxidok gyenge bázisok, pKb-jük mintegy 4,5, az ez alatti pH-jú anyag hatására protonálódnak, R3N+–OH (hidroxilammóniumion) keletkezik.
Szintézis
[szerkesztés]Számos amin-oxidot tercier alifás amin vagy aromás N-heterociklus oxidációjával állítanak elő. A hidrogén-peroxid a leggyakoribb reagens az iparban és a kutatásban is, azonban a persavak is fontosak.[6] A speciálisabb oxidánsok, például a Caro-sav vagy a mCPBA kis mennyiségben szintén használatos. A molekuláris oxigént használó spontán vagy katalizált reakciók ritkák. Egyes további reakciók, például a retro-Cope-elimináció is amin-oxidot adnak, de ezek ritkán használatosak.
Reakciók
[szerkesztés]Az amin-oxidok számos reakciót mutatnak:[7]
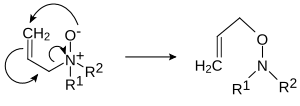
- Pirolitikus elimináció: Az amin-oxidok 150–200 °C-on Cope-reakcióval hidroxilamint és alként adnak. E reakcióhoz β-szénatomon lévő hidrogén szükséges (vagyis etil- vagy nagyobb alkilcsoporttal működik, metilcsoporttal nem)
- Redukció aminná: Az amin-oxidok könnyen redukálhatók a megfelelő aminná például lítium-alumínium-hidriddel, nátrium-borohidriddel, katalitikus redukcióval, cinkkel/ecetsavval és vassal/ecetsavval. A piridin-N-oxidok dezoxigénezhetők foszfor-oxikloriddal.
- Áldozati katalízis: Az oxidánsok N-oxidok redukciójával újra előállíthatók, például az ozmium-tetroxid regenerációjával az N-metilmorfolin-N-oxid révén az Upjohn-dihidroxilezés esetén.
- O-Alkilezés: A piridin-N-oxidok halogénalkánokkal reagálva O-alkilterméket adnak.
- Bisz-terpiridinszármazékok ezüstfelszínen oxigénnel reagálhatnak bisz(terpiridin)-N-oxidot adva. E reakció pásztázó elektronmikroszkóppal követhető szubmolekuláris felbontással.[8]
- A Meisenheimer-átrendeződésben bizonyos R1R2R3N+O− képletű amin-oxidok átrendeződnek R2R3NOR1 képletű alkoxilaminokká.[9][10]
- A Polonovski-reakcióban egy tercier-N-oxidot ecetsavanhidrid bont a megfelelő acetamiddá és aldehiddé:[11][12][13]
Metabolitok
[szerkesztés]Az amin-oxidok gyógyszerek és pszichoaktív szerek, például a nikotin, a zolmitriptán és a morfin gyakori metabolitjai.
A rákellenes szerek amin-oxidjai prodrugok, melyek az oxigénhiányos rákszövet anyagcseréje során alakulnak az aktív szerré.
Humán biztonság
[szerkesztés]Nem ismert az amin-oxidok (AO) esetén karcinogén, fogérzékenység-okozó vagy reprotoxikus hatás. Bevitelük után könnyen lebomlanak és ürülnek. Nyulaknak folyamatosan adagolva csökkent testtömeget, hasmenést és lenticularis átlátszatlanságokat figyeltek meg a legalacsonyabb megfigyelt káros szintnél (87–150 mg AO/ttkg/nap). Az emberi bőr 8 óra után kevesebb mint 1%-ot szív fel. Az amin-oxidok és más felületaktív anyagok miatti szemirritáció közepes és átmeneti, maradandó hatás nem jelentkezik.[2]
Környezeti biztonság
[szerkesztés]Átlagosan 12,6 lánchosszú amin-oxidok vízoldékonyak (oldhatóság: mintegy 410 g/l). Vízi fajokban csekély bioakkumuláció feltételezhető a log Kow alapján 14 tagúnál rövidebb lánchossz mellett (biokoncentrációs faktor < 87%).[2] Az AO szintje kezeletlen vízben 2,3–27,8 μg/l volt, a beömlő vízben ez 0,4–2,91 μg/l volt. A legmagasabb befolyóvízi koncentrációkat oxidációs területeken és szűrőkezelőknél találták. Átlagosan az amin-oxidok több mint 96%-a távozott másodlagos szennyvízkezeléssel.[3] Halban 96 órás LC50-kísérletek alapján az akut LC50 1–3 mg/l volt 14 szénatom alatti szénlánchossz mellett. 14 szénatom feletti lánchosszok esetén az LC50 0,6–1,4 mg/l volt. A krónikus toxicitás halban 420 μg/l-nél jelentkezikL. C12,9-re normalizálva a NOEC 310 μg/l a növekedésre és a kikelésre.[3]
Jegyzetek
[szerkesztés]- ↑ Durrant, Marcus C. (2015). „A quantitative definition of hypervalency”. Chemical Science 6 (11), 6614–6623. o. DOI:10.1039/C5SC02076J. PMID 30090275. PMC 6054109.
- ↑ a b c d e f Amine Oxides. OECD Existing Chemicals Database. Organisation for Economic Co-operation and Development (OECD), 2006. [2014. február 22-i dátummal az eredetiből archiválva].
- ↑ a b c Sanderson, H (2009). „High Production Volume Chemical Amine Oxides [C8–C20]”. Risk Analysis 29 (6), 857–867. o. DOI:10.1111/j.1539-6924.2009.01208.x. PMID 19504658.
- ↑ Modler, RF: CEH Marketing Research Report: Surfactants, Household Detergents, and their Raw Materials. Chemical Economics Handbook. SRI Consulting, 2004
- ↑ Sanderson, H (2006). „Exposure and Prioritization—Human Screening Data and Methods for High Production Volume Chemicals in Consumer Products: Amine Oxides a Case Study.”. Risk Analysis 26 (6), 1637–1657. o. DOI:10.1111/j.1539-6924.2006.00829.x. PMID 17184403.
- ↑ Sablon:March6th
- ↑ Albini, Angelo (1993). „Synthetic utility of amine N-oxides”. Synthesis 1993 (3), 263–77. o. DOI:10.1055/s-1993-25843.
- ↑ Waldmann, T. (2012. december 7.). „Oxidation of an Organic Adlayer: A Bird's Eye View”. Journal of the American Chemical Society 134 (21), 8817–22. o. DOI:10.1021/ja302593v. PMID 22571820.
- ↑ J. Meisenheimer, Ber. 52. 1667–1677 (1919)
- ↑ Smith, Michael B.. March's Advanced Organic Chemistry: Reactions, Mechanisms, and Structure, 5th, Wiley-Interscience (2001). ISBN 0-471-58589-0
- ↑ Grierson, D (1990). „The Polonovski Reaction”. Org. React. 39, 85. o. DOI:10.1002/0471264180.or039.02.
- ↑ Polonovski, Max (1927). „Sur les aminoxydes des alcaloïdes. III. Action des anhydrides et chlorures d’acides organiques. Préparation des bases nor.”. Bull. Soc. Chim. Fr 41, 1190-1208. o.
- ↑ Kürti László, Czakó Barbara. Strategic Applications of Named Reactions in Organic Synthesis, paperback, Elsevier Science, 357–358. o. (2005). ISBN 0-12-429785-4
Fordítás
[szerkesztés]Ez a szócikk részben vagy egészben az Amine oxide című angol Wikipédia-szócikk ezen változatának fordításán alapul. Az eredeti cikk szerkesztőit annak laptörténete sorolja fel. Ez a jelzés csupán a megfogalmazás eredetét és a szerzői jogokat jelzi, nem szolgál a cikkben szereplő információk forrásmegjelöléseként.
Források
[szerkesztés]- Chemistry of amine oxides
- Surfactants, types and uses Archiválva 2020. július 31-i dátummal a Wayback Machine-ben. (pdf)
- The amine oxides homepage
- Nomenclature of nitrogen compounds
- IUPAC definition