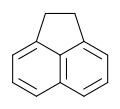
Acenaftén
| Acenaftén | |||
 |

| ||
| IUPAC-név | 1,2-dihidroacenaftilén | ||
| Szabályos név | triciklo[6.3.1.04,12]dodekapenta-1(12),4,6,8,10-én | ||
| Más nevek | 1,8-etilénnaftalin peri-etilénnaftalin naftilénetilén | ||
| Kémiai azonosítók | |||
|---|---|---|---|
| CAS-szám | 83-32-9 | ||
| PubChem | 6734 | ||
| ChemSpider | 6478 | ||
| EINECS-szám | 201-469-6 | ||
| KEGG | C19312 | ||
| ChEBI | 22154 | ||
| RTECS szám | AB1000000 | ||
| |||
| |||
| InChIKey | CWRYPZZKDGJXCA-UHFFFAOYSA-N | ||
| UNII | V8UT1GAC5Y | ||
| ChEMBL | 1797271 | ||
| Kémiai és fizikai tulajdonságok | |||
| Kémiai képlet | C12H10 | ||
| Moláris tömeg | 154,21 g/mol | ||
| Megjelenés | fehér vagy halványsárga kristályos por | ||
| Sűrűség | 1,225 g/cm³ (0 °C)[1] | ||
| Olvadáspont | 93,4 °C | ||
| Forráspont | 279 °C | ||
| Oldhatóság (vízben) | 0,4 mg/100 ml | ||
| Oldhatóság (etanol) | kevéssé | ||
| Oldhatóság (kloroform) | kevéssé | ||
| Oldhatóság (benzol) | jól oldódik | ||
| Oldhatóság (ecetsav) | oldódik | ||
| Veszélyek | |||
| MSDS | ICSC 1674 | ||
| EU Index | Nem szerepel | ||
| NFPA 704 | |||
| Lobbanáspont | 135 °C | ||
| Öngyulladási hőmérséklet | >450 °C | ||
| Ha másként nem jelöljük, az adatok az anyag standardállapotára (100 kPa) és 25 °C-os hőmérsékletre vonatkoznak. | |||
Az acenaftén a policiklusos aromás szénhidrogének (PAH) közé tartozó szerves vegyület, molekulaszerkezetét tekintve egy naftalingyűrűből áll, melyben az 1-es és 8-as szénatomot egy etilénhíd köti össze. Színtelen szilárd anyag, a kőszénkátrányban mintegy 0,3% mennyiségben fordul elő.[2]
Előállítása és reakciói
[szerkesztés]Az acenaftént először Marcellin Berthelot állította elő kőszénkátrányból. Később Berthelot és Bardy α-etilnaftalin gyűrűzárásával szintetikusan is előállította. Iparilag még mindig a kőszénkátrányból nyerik az acenaftilénnel (és sok már vegyülettel) együtt.
Alacsony oxidációs állapotú fémcentrumokkal – más aromás szénhidrogénekhez hasonlóan – komplexeket képez. Ilyen például a (η6-acenaftén)Mn(CO)3]+.[3] Az acenaftén redukciója során nátrium-acenaftilenid gyök anion keletkezik, mely erős redukálószer (E° = −1,75 V).[4]
Felhasználása
[szerkesztés]Nagy mennyiségben használják naftálsav-anhidrid (naftalindikarbonsav-anhidrid) előállítására, mely színezékek és optikai fehérítők szintézisének kiindulási anyaga.[2] A naftilsav-anhidrid a periléntetrakarbonsav-anhidrid prekurzora, melyből számos, kereskedelmi forgalomban kapható pigmentet és színezéket állítanak elő.[5][6]
Fordítás
[szerkesztés]Ez a szócikk részben vagy egészben az Acenaphthene című angol Wikipédia-szócikk ezen változatának fordításán alapul. Az eredeti cikk szerkesztőit annak laptörténete sorolja fel. Ez a jelzés csupán a megfogalmazás eredetét és a szerzői jogokat jelzi, nem szolgál a cikkben szereplő információk forrásmegjelöléseként.
Hivatkozások
[szerkesztés]- ↑ Römpp vegyészeti lexikon: Első kötet A–E. Budapest: Műszaki Könyvkiadó, 24. o. (1981). ISBN 963 10 3270 1
- ↑ a b Karl Griesbaum, Arno Behr, Dieter Biedenkapp, Heinz-Werner Voges, Dorothea Garbe, Christian Paetz, Gerd Collin, Dieter Mayer, Hartmut Höke “Hydrocarbons” in Ullmann's Encyclopedia of Industrial Chemistry 2002 Wiley-VCH, Weinheim. doi:10.1002/14356007.a13_227
- ↑ S. B. Kim, S. Lotz, S. Sun, Y. K. Chung, R. D. Pike, D. A. Sweigart "Organometallic Reagents – Manganese Tricarbonyl Transfer (MTT) Agents" in Inorganic Syntheses, 2010, Vol. 35, 109–128. doi:10.1002/9780470651568.ch6
- ↑ N. G. Connelly and W. E. Geiger, "Chemical Redox Agents for Organometallic Chemistry", Chem. Rev. 1996, 96, 877-910. doi:10.1021/cr940053x
- ↑ K. Hunger. W. Herbst "Pigments, Organic" in Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim, 2012. doi:10.1002/14356007.a20_371
- ↑ Greene, M. "Perylene Pigments" in High Performance Pigments, 2009, Wiley-VCH, Weinheim. pp. 261-274.doi:10.1002/9783527626915.ch16


