Szerkesztő:Glikol/Rubídium-oxid
| berillium-hidrid | |||
[[file: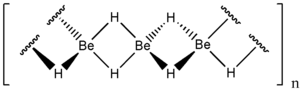 |250px]] |250px]]
| |||

| |||
| IUPAC-név | berillium-hidrid | ||
| Más nevek | Berillium-dihidrid Berillán | ||
| Kémiai azonosítók | |||
| CAS-szám | 7787-52-2 | ||
| PubChem | 139073 | ||
| ChEBI | CHEBI:33787 | ||
| |||
| |||
| Kémiai és fizikai tulajdonságok | |||
| Kémiai képlet | BeH2 | ||
| Moláris tömeg | 11,03 g·mol−1 | ||
| Megjelenés | fehér por | ||
| Sűrűség | 0,65 g·cm−3 (25 °C)[1] | ||
| Olvadáspont | 240 ° C-on elemeire bomlik[2] | ||
| Oldhatóság (vízben) | bomlik | ||
| Oldószerei | oldhatatlan dietil-éterben és toluolban | ||
| Veszélyek | |||
| Főbb veszélyek | nagyon mérgező, egészségre veszélyes, környezetre veszélyes, | ||
| R mondatok | R49 R25 R26 R36/37/38 R43 R48/23 R51/53 | ||
| S mondatok | S45 S53 S61 | ||
| Rokon vegyületek | |||
| Azonos kation | Berillium-fluorid Berillium-klorid Berillium-bromid | ||
| Azonos anion | Magnézium-hidrid kalcium-hidrid Stroncium-hidrid Bárium-hidrid Rádium-hidrid | ||
| Rokon vegyületek | lítium-hidrid bór-hidrid | ||
| Az infoboxban SI-mértékegységek szerepelnek. Ahol lehetséges, az adatok standardállapotra (100 kPa) és 25 °C-os hőmérsékletre vonatkoznak. Az ezektől való eltérést egyértelműen jelezzük. | |||
A berillium-hidrid egy kémiai vegyület, képlete BeH2 vagy ([BeH2])n. Oldhatatlan azokban az oldószerekben amelyekben nem bomlik.[3] Eltérően a 2. főcsoport nehezebb elemeinek hidridjeitől amelyek ionvegyületek a berillium-hidrid kovalens vegyület.
Előállítása
[szerkesztés]Nem lehet elemi berillium és hidrogén reakciójával előállítani. Hanem fémorganikus berillium(II) vegyületek és hidrid (például lítium-alumínium-hidrid vagy diborán) reakciójával lehet előállítani. A reakciót dietil-éterben viszik végbe mert a berillium-hidrid nem oldódik a dietil-éterben és kicsapódik az oldatból:
De elő lehet állítani bisz(terc-butil)-berillium pirolízisével is 210 ° C-on:
Először 1951-ben állították elő dimetil-berillium Be(CH3)2 és lítium-alumínium-hidrid LiAlH4 reakciójával.[4]
Elő lehet állítani igen tiszta trifenil-foszfin és berillium-borohidrid reakciójával:
- Be(BH4)2 + 2 PPh3 → 2 Ph3PBH3 + BeH2
Tulajdonságai
[szerkesztés]A berilliumhidrid egy szilárd fehér színű polimer anyag, amely elemeire bomlik 205-250 ° C-on[5]. Nedvesség- és levegő érzékeny, nem oldható a legtöbb szerves oldószerben. Vízben berillium-oxid keletkezik belőle:
A berillium-hidrid lánc alakú polimert képez ahol minden egyes berillium atom körül tetraéderesen négy hidrogén van. Hasonló felépítésű mint az alumínium-hidrid.
A vízzel lassan reagál, de a savakban gyorsan hidrolizálódik.
Reagál a trimetil-aminnal N(CH3)3 dimert képez áthidaló hidridekkel.[6] A dimetil-aminnal HN(CH3)2 trimer berillium-diamidot [Be(N(CH3)2)2]3 és hidrogént képez.
A lítium-hidriddel és a hidrid ionnal reagálva LiBeH3 és Li2BeH4 képez.
Szerkezete
[szerkesztés]Általában amorf fehér színű szilárd anyag, de hexagonális kristályszerkezete is létezik ami nagyobb sűrűségű (~0.78 g cm−3) mint az amorf változat.[7] Az amorf változatból állítják elő nyomással 0,5-2,5% LiH katalizátorral.
A kristályos változatnak tércentrált ortorombos elemi cellája van.[8]
Dihidroberillium
[szerkesztés]A dihidroberillium egy rokon vegyület képlete BeH2. Szolvatálatlanul spontán autopolimerizálódik oligomerekké. Elő lehet állítani elektromos kisüléssel magas hőmérsékleten. Linerális molekula a Be-H kötés hossza 133.376 pm.[9]
Elméletben a 2 kordinációs számú hidridoberillium csoport (-BeH) hidridoberilliumokat képez, mivel a dihidroberillium elektron párt donáló ligandumot tartalmazó molekulákkal egyesül:[10]
- [BeH2] + L → [BeH2L]
Emiatt Lewis-sav karakterű. Két elektron párt tud fogadni így tetrahidroberilát(2) (BeH2−4) aniont képez.
Felhasználása
[szerkesztés]Használják rakéta üzemanyagként és moderátorként az atomreaktorokban.[11][12]
Biztonság
[szerkesztés]A berillium erősen mérgező. A patkányokban igen erős rákkeltő hatást észleltek.[13] Az emberben azonban csak néhány esetben.
Források
[szerkesztés]- ↑ Carl L. Yaws: "Thermophysical Properties of Chemicals and Hydrocarbons", S. 298. (korlátozott előnézet a Google Könyvekben).
- ↑ Sablon:Holleman-Wiberg
- ↑ Pradyot Patnaik. Handbook of Inorganic Chemicals. McGraw-Hill, 2002, ISBN 0-07-049439-8
- ↑ Glenn D. Barbaras, Clyde Dillard, A. E. Finholt, Thomas Wartik, K. E. Wilzbach, and H. I. Schlesinger (1951). „The Preparation of the Hydrides of Zinc, Cadmium, Beryllium, Magnesium and Lithium by the Use of Lithium Aluminum Hydride”. J. Am. Chem. Soc. 73 (10), 4585–4590. o. DOI:10.1021/ja01154a025.
- ↑ C. H. Bamford – C. F. H. Tipper: Reactions in the Solid State. (hely nélkül): Elsevier. 1980. 155. o. ISBN 0444418075 korlátozott előnézet a Google Könyvekben
- ↑ Shepherd Jr., Lawrence H., Ter Haar, G. L.; Marlett, Everett M. (1969. április 1.). „Amine complexes of beryllium hydride” (PDF). Inorganic Chemistry 8 (4), 976–979. o, Kiadó: American Chemical Society. DOI:10.1021/ic50074a051. (Hozzáférés: 2013. október 16.)
- ↑ G. J. Brendel, E. M. Marlett, and L. M. Niebylski (1978). „Crystalline beryllium hydride”. Inorg. Chem. 17 (12), 3589–3592. o. DOI:10.1021/ic50190a051.
- ↑ Gordon S. Smith, Quintin C. Johnson, Deane K. Smith, D. E. Cox, Robert L. Snyder, Rong-Sheng Zhou and Allan Zalkin (1988). „The crystal and molecular structure of beryllium hydride”. Solid State Communications 67 (5), 491–494. o. DOI:10.1016/0038-1098(84)90168-6.
- ↑ Peter F. Bernath, Alireza Shayesteh, Keith Tereszchuk, Reginald Colin (2002). „The Vibration-Rotation Emission Spectrum of Free BeH2”. Science 297 (5585), 1323–1324. o. DOI:10.1126/science.1074580. PMID 12193780.
- ↑ (2000. november 23.) „σ Bond Activation by Cooperative Interaction with ns2 Atoms: Be + n H2, n = 1−3”. The Journal of Physical Chemistry A 104 (46), 10951–10957. o, Kiadó: ACS Publications. DOI:10.1021/jp002313m.
- ↑ Kenneth A. Walsh: "Beryllium chemistry and processing", ASM International (2009). S. 121 (korlátozott előnézet a Google Könyvekben).
- ↑ Dale L. Perry, Sidney L. Phillips: Handbook of inorganic compounds. CRC Press, 1995, ISBN 978-0-8493-8671-8, S. 62 (korlátozott előnézet a Google Könyvekben).
- ↑ umwelt-online.de
Fordítás
[szerkesztés]Ez a szócikk részben vagy egészben a Berylliumhydrid című német Wikipédia-szócikk fordításán alapul. Az eredeti cikk szerkesztőit annak laptörténete sorolja fel. Ez a jelzés csupán a megfogalmazás eredetét és a szerzői jogokat jelzi, nem szolgál a cikkben szereplő információk forrásmegjelöléseként.
Ez a szócikk részben vagy egészben a Beryllium hydride című angol Wikipédia-szócikk fordításán alapul. Az eredeti cikk szerkesztőit annak laptörténete sorolja fel. Ez a jelzés csupán a megfogalmazás eredetét és a szerzői jogokat jelzi, nem szolgál a cikkben szereplő információk forrásmegjelöléseként.
További információk
[szerkesztés]- Beryllium chloride at IPCS INTOX adatbank
- Properties of BeCl2 from NIST