Rubídium-hidrogén-karbonát
| rubídium-hidrogén-karbonát | |
| |
| Rubídiumion | |
| |
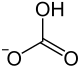
| hidrogén-karbonát-ion | |
| Kémiai azonosítók | |
| CAS-szám | 19088-74-5 |
| Kémiai és fizikai tulajdonságok | |
| Kémiai képlet | RbHCO3 |
| Moláris tömeg | 146,48 g/mol−1 |
| Megjelenés | színtelen kristályok[1] |
| Olvadáspont | 170 °C (bomlik) |
| Oldhatóság (vízben) | jól oldódik 116 g·l−1 (20 °C)[2] 537,3 g·l−1 (100 °C)[1] |
| Oldószerei | etanolban rosszul oldódik: 20 g·l−1 |
| Veszélyek | |
| Főbb veszélyek | nincs adat |
| Rokon vegyületek | |
| Azonos kation | rubídium-oxid rubídium-hidroxid |
| Rokon vegyületek | lítium-hidrogén-karbonát nátrium-hidrogén-karbonát kálium-hidrogén-karbonát cézium-hidrogén-karbonát |
| Az infoboxban SI-mértékegységek szerepelnek. Ahol lehetséges, az adatok standardállapotra (100 kPa) és 25 °C-os hőmérsékletre vonatkoznak. Az ezektől való eltérést egyértelműen jelezzük. | |
A rubídium-hidrogén-karbonát a szénsav rubídiumsója, képlete RbHCO3.
Előállítása
[szerkesztés]Előállítható úgy, hogy rubídium-karbonát vizes oldatába szén-dioxidot vezetnek:[3]
vagy ha rubídium-hidroxidot és dimetil-karbonátot reagáltatnak egymással, ekkor a keletkező rubídium-metil-karbonát vízben oldva rubídium-hidrogén-karbonáttá és metanollá hidrolizál:
Tulajdonságai
[szerkesztés]Monoklin kristályokat alkot, ezek tércsoportja C2/m. Rácsállandói: a = 1473,5 pm, b = 582,02 pm, c = 403,67 pm és β = 104,408°, elemi cellájában négy ionpár található.[4]
Szobahőmérsékleten dimer, mivel a hidrogén-karbonát-ionok közt hidrogénkötés jön létre és [H2C2O6]2− ionok keletkeznek.[5][6]
245 K hőmérsékleten fázisátmenet következik be,[7] alacsony hőmérsékleten kristályszerkezete triklin.[8]
A rubídium-hidrogén-karbonát a kálium-hidrogén-karbonáttal elegykristályokat alkot.
Hevítés hatására rubídium-karbonátra, vízre és szén-dioxidra bomlik:
Vizes oldatát rubídium-perjodáttal lassan bepárolva rubídium-ortoperjodát és szén-dioxid keletkezik belőle:[9]
Jegyzetek
[szerkesztés]- ↑ a b Jean D'Ans, Ellen Lax: Taschenbuch für Chemiker und Physiker. 3. Elemente, anorganische Verbindungen und Materialien, Minerale, Band 3. 4. Auflage, Springer, 1997, ISBN 978-3-5406-0035-0, S. 684f. (korlátozott előnézet a Google Könyvekben).
- ↑ CRC Handbook of Chemistry and Physics. (angolul) Szerk. David R. Lide. 90. (hely nélkül): CRC Press. 2009. ISBN 978-1420090840
- ↑ R. Abegg, F. Auerbach: "Handbuch der anorganischen Chemie". Verlag S. Hirzel, Bd. 2, 1908. S. 435.Volltext
- ↑ Dissertation: "Beiträge zur Kristallchemie der Alkalimetallcarbonate und -hydrogencarbonate", Vytas Cirpus, Universität Köln 1997. PDF Archiválva 2015. április 2-i dátummal a Wayback Machine-ben
- ↑ G. A. Webb, C. J. Jameson, H. Fukui, K. Kamienska-Trela: "Nuclear Magnetic Resonance", Verlag Royal Society of Chemistry, 2005, ISBN 9780854043521, S. 311. (korlátozott előnézet a Google Könyvekben)
- ↑ Moon Il Kim: "The Crystal Structure of Rubidium Hydrogen Carbonate (RbHCO3)" in Journal of the Korean Chemical Society 1969, 13(2), S. 131-136. Abstract Archiválva 2013. október 20-i dátummal a Wayback Machine-ben
- ↑ C. Odin: "Evidence of a phase transition of RbHCO3 from high-resolution solid-state 13C and 87Rb NMR by comparison with KHCO3." in Magn. Reson. Chem 2004, 42(4), S. 381-388 (PMID 15022199).
- ↑ R. Müller, G. Roth: "Matrix-free integration of image-plate diffraction data" in J. Appl. Cryst 2005, 38, S. 280-290. doi:10.1107/S0021889804034089
- ↑ G. V. Shilov, Z. K. Nikitina, Yu. A. Dobrovol'skii, L. S. Leonova, L. O. Atovmyan: "Disubstituted Rubidium Orthoperiodate Rb2H3IO6: Crystal and Molecular Structures and Properties" in Russian Journal of Coordination Chemistry 2004, 30(7), S. 449-452. doi:10.1023/B:RUCO.0000034783.23782.8d
Fordítás
[szerkesztés]Ez a szócikk részben vagy egészben a Rubidiumhydrogencarbonat című német Wikipédia-szócikk ezen változatának fordításán alapul. Az eredeti cikk szerkesztőit annak laptörténete sorolja fel. Ez a jelzés csupán a megfogalmazás eredetét és a szerzői jogokat jelzi, nem szolgál a cikkben szereplő információk forrásmegjelöléseként.





