Oxoanion
Az oxoanionok AxOz−y általános képlettel leírható összetett anionok, ahol A valamely kémiai elem, O pedig oxigénatom. Az elemek nagy többsége képez oxoanion(oka)t.[1] Az egyszerű oxoanionok képletét az oktettszabály határozza meg. A kondenzációs reakcióval keletkező oxoanionok szerkezete leírható éleken vagy csúcsokon érintkező AOn poliéder egységekkel. Az adenozin-monofoszfát (AMP), adenozin-difoszfát (ADP) és adenozin-trifoszfát (ATP) foszfát- és polifoszfát-észterek nagy biológiai jelentőséggel rendelkeznek.
Monomer oxoanionok
[szerkesztés]A monomer oxoanionok AOm−n képletét az A elem oxidációs állapota és a periódusos rendszerben elfoglalt helye határozza meg. A második periódus elemeinek maximális koordinációs száma 4, azonban egyikük sem képez ilyen koordinációs számmal oxoaniont, ehelyett a központi atom és az oxigénatomok között pi-kötéses, síkháromszöges (trigonális planáris) szerkezet valósul meg, mint a karbonátion (CO2−3) és a nitrátion (NO−3) esetén. A π-kötést a központi atom és az oxigénatom hasonló mérete teszi kedvezővé.
A harmadik periódus elemei a csoportszámuknak megfelelő oxidációs állapotban tetraéderes szerkezetűek. Az SiO4 szerkezet megtalálható az [Mg,Fe]SiO4 olivin ásványokban, de az anion önmagában nem fordul elő, mivel az oxigénatomokat szilárd fázisban tetraéderesen kationok veszik körbe. A foszfátion (PO3−4), szulfátion (SO2−4) és perklorátion (ClO−4) számos sóban megtalálható. Számos alacsonyabb oxidációs állapotú központi atomot tartalmazó oxoanion megfelel az oktettszabálynak, ami alapján képletük megindokolható. Például a klór(V) két vegyértékelektronnal rendelkezik, így az oxidionokkal való kötésben három elektronpárt tud fogadni. Az iont töltése tehát +5 −3·2 = −1, a képlet tehát ClO−3. Az ion szerkezete a vegyértékelektronpár-taszítási elmélet szerint piramis alakú, három kötő és egy nemkötő elektronpárral. Hasonlóan a klór(III) oxoanionjának képlete ClO−2, szerkezete V alakú, két kötő és két nemkötő elektronpárral.
| Oxidációs állapot | Név | Képlet | Kép |
|---|---|---|---|
| +1 | hipoklorition | ClO− | 
|
| +3 | klorition | ClO−2 | 
|
| +5 | klorátion | ClO−3 | 
|
| +7 | perklorátion | ClO−4 | 
|
A negyedik periódustól kezdve lehetővé válik a 6-os koordináció, de különálló oktaéderes oxoanionok nem ismeretesek, mivel túlságosan nagy töltést kellene hordozniuk. A molibdén(VI) ezért nem képez MoO6−6-ot, hanem csak tetraéderes MoO2−4 molibdát aniont. MoO6 egységek a kondenzált molibdátokban találhatók. Oktaéderes szerkezetű, teljesen protonált oxoanionok léteznek, ilyen például az Sn(OH)2−6 és az Sb(OH)−6. Az ortoperjodát ugyanakkor csak részlegesen protonálható, a H3IO2−6 ⇌ H2IO3−6 + H+ egyensúlyra pKa=11,60.[2][3]
Elnevezésük
[szerkesztés]A monomer oxoanionok elnevezése néhány egyszerű szabályt követ.
- Ha a központi atom nem a VII. csoportba tartozik
| A központi atom oxidációs száma | Nevezéktan | Példák |
|---|---|---|
| = csoportszám | *-át | borát (BO3−3), karbonát (CO2−3), nitrát (NO−3), foszfát (PO3−4), szulfát (SO2−4), kromát (CrO2−4), arzenát (AsO3−4) |
| = csoportszám − 2 | *-it | nitrit (NO−2), foszfit (PO3−3), szulfit (SO2−3), arzenit (AsO3−3) |
| = csoportszám − 4 | hipo-*-it | hipofoszfit (PO3−2), hiposzulfit (SO2−2) |
- Ha a központi atom a VII. csoportba tartozik
| A központi atom oxidációs száma | Nevezéktan | Példák |
|---|---|---|
| = csoportszám | per-*-át | perklorát (ClO−4), perbromát (BrO−4), perjodát (IO−4), permanganát (MnO−4) |
| = csoportszám − 2 | *-át | klorát (ClO−3), bromát (BrO−3), jodát (IO−3) |
| = csoportszám − 4 | *-it | klorit (ClO−2), bromit (BrO−2) |
| = csoportszám − 6 | hipo-*-it | hipoklorit (ClO−), hipobromit (BrO−) |
Kondenzációs reakciók
[szerkesztés]
Vizes oldatokban a nagy töltéssel rendelkező oxoanionok kondenzációs reakcióban vehetnek részt, ilyen például a Cr2O2−7 dikromátion keletkezése:
- 2 CrO2−4 + 2 H+ ⇌ Cr2O2−7 + H2O
A reakció hajtóereje az anion töltéssűrűségének és a H+ ion mennyiségének csökkenése. Az oldat rendezettségének mértéke csökken, ami adott mennyiségű entrópia keletkezésével jár, ami a szabadentalpiát még negatívabbá teszi, így a felső nyíl irányába lejátszódó reakció válik kedvezőbbé. Ez olyan sav–bázis reakcióra példa, ahol a monomer oxoanion a bázis, és a kondenzált oxoanion a konjugált sav. A fordított irányú reakció a hidrolízis, melynek során egy bázisként szereplő vízmolekula disszociál. További kondenzációs reakció is végbemehet, különösen nagyobb töltésű anionok esetén – ilyenek például az adenozin-foszfátok.

|
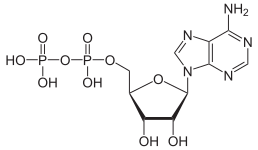
|
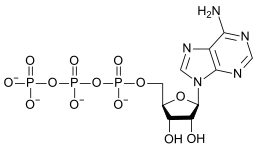
|
| AMP | ADP | ATP |
Az ATP ADP-vé történő átalakulása is hidrolízis, ez az élőlények fontos energiaforrása.
A szilikátásványok többségének keletkezése felfogható úgy, mint a szilícium-dioxid és egy bázikus oxid reakciója – ez Lux–Flood-szerinti sav–bázis reakció.
- CaO (bázis) + SiO2 (sav) → CaSiO3
A polioxoanionok szerkezete és képlete
[szerkesztés]
A polioxoanion olyan polimer oxoanion, mely több, jellemzően MOn poliédernek tekintett oxoanion monomernek a közös csúcson vagy élen keresztül történő összekapcsolódásával jön létre.[4] Ha egy poliéder két csúcsa is közös, akkor lánc vagy gyűrűs szerkezet alakul ki. Rövid láncok találhatók például a polifoszfátokban. A láncszilikátokat, például a piroxént két közös csúccsal rendelkező SiO4 tetraéderek hosszú lánca alkotja. Ugyanez a szerkezet fordul elő a metavanadátokban, például az ammónium-metavanadátban (NH4VO3).
Az SiO2−3 oxoanion képlete az alábbi módon származtatható: minden egyes névleges szilíciumion (Si4+) két névleges oxidionhoz (O2−) kapcsolódik, és másik kettőn félig osztozik. A sztöchiometria és a töltés tehát az alábbiak szerint kapható meg:
- Sztöchiometria: Si + 2 O +2 · ½ O = SiO3
- Töltés: +4 + (2 · − 2) + (2 · (½ · −2)) = −2.
A gyűrű olyan láncnak tekinthető, melynek a két vége összekapcsolódik. Erre példa a P3O3−9 gyűrűs trifoszfát.
Három közös csúcs esetén a szerkezet kétdimenzióssá válik. Az amfibolokban (ezek közé tartozik például az azbeszt) két lánc úgy kapcsolódik össze, hogy a lánc mentén váltakozva egy közös hármas csúcson osztoznak. Ennek eredménye a [Si4O11]6− képlet és a lineáris láncszerkezet, ami megmagyarázza ezen ásványok szálas természetét. Ha mind a három csúcs közös, akkor lapszerű szerkezet jön létre, mint a csillámpalában ([Si2O5]2−), amelyben minden szilíciumhoz egy oxigén kapcsolódik és három másikon osztozik. A kristályos csillámpala nagyon vékony rétegekre hasítható.
Ha a tetraéder mind a négy csúcsa közös, akkor 3 dimenziós szerkezet alakul ki, ilyen például a kvarc. Az alumínium-szilikátok olyan ásványok, amelyekben a szilícium egy részét alumínium helyettesíti. Az alumínium oxidációs száma azonban a szilíciuménál eggyel kisebb, ezért a helyettesítéshez további kation is szükséges. Az ilyen szerkezetek lehetséges kombinációinak száma hatalmas, részben ez is az oka annak, hogy ilyen sok alumínium-szilikát létezik.

Az oktaéderes MO6 egységes gyakoriak a nehezebb átmenetifémek esetén. Néhány vegyület, például a Mo2O2−7 láncpolimerion sói tetraéderes és oktaéderes egységeket is tartalmaznak.[5][6] A közös élek gyakoriak az oktaéderes szerkezeti egységeket tartalmazó ionoknál, és ilyenkor az oktaéderek többnyire torzulnak, hogy a híd oxigénatomoknál fellépő feszülés csökkenjen. Ennek eredményeként 3 dimenziós szerkezetek, úgynevezett polioxometallátok keletkeznek. Tipikus példa a foszfomolibdátion. A közös él hatékonyan csökkenti az elektromos töltéssűrűséget, ami az alábbi, két oktaéderes egység közötti elméleti kondenzációs reakció is mutat:
- 2 MOn−6 + 4 H+ → M2O(n−4)−10 + 2 H2O
Ebben az esetben minden egyes M atom töltése 2-vel csökken. A közös él hatását az alábbi, a molibdát lúgos oldatának savanyításakor végbemenő reakció mutatja:
- 7 MoO2−4 + 8 H+ ⇌ Mo7O6−24 + 4 H2O
A tetraéderes molibdátion olyan klaszterré alakul, melyben 7 oktaéder egy-egy éle közös,[6][7] így az egyes molibdének átlagos töltése 6/7. A heptamolibdát klaszter annyira stabil, hogy 2–6 molibdát egységből álló klasztert nem találtak, pedig köztitermékként ezeknek is keletkezniük kell.[forrás?]
Sav–bázis tulajdonságok
[szerkesztés]Az oxoanionok többsége gyenge bázis, melyek protonálódva savakat vagy savanyú sókat képeznek. A foszfátion például sorozatos protonálással foszforsavvá alakítható.
- PO3−4 + 3 H+ ⇌ HPO2−4 + 2 H+ ⇌ H2PO−4 + H+ ⇌ H3PO4


Vizes oldatban a protonálódás mértéke a savi disszociációs állandó és a pH függvénye. Az AMP (adenozin-monofoszfát) pKa értéke például 6,21,[8] így 7-es pH-n kb. 10%-ban van protonálva. Ezekben a prptonálódási reakciókban fontos tényező a töltés semlegesítése. Ezzel szemben az egyértékű perklorát- és permanganátionok nagyon nehezen protonálhatóak, ezért a megfelelő konjugált savak erős savak.
Noha a savak, például a foszforsav képletét H3PO4 formában írjuk fel, a protonok oxigénatomhoz kapcsolódva hidroxilcsoportot alkotnak, így a képlet OP(OH)3 alakban is megadható, ami jobban tükrözi a szerkezetet. A kénsav O2S(OH)2 képlettel is megadható, ez a gázfázisú molekulaszerkezete.
A PO3−3 foszfition erős bázis, ezért legalább egy proton mindig kapcsolódik hozzá. Ebben az esetben a proton közvetlenül a foszforatomhoz kapcsolódik, szerkezete tehát HPO2−3. Az ion keletkezésekor a foszforatom Lewis-bázisként viselkedik és elektronpárt donál a Lewis-savnak, azaz a H+-nak.

Mint fentebb említettük, a kondenzációs reakció is sav–bázis reakció. Sok rendszerben protonálódási és kondenzációs reakciók is végbemehetnek. A kromátion esete viszonylag egyszerű példa. A kromát megoszlási diagramján (jobb oldali ábra) a pCr a króm koncentráció logaritmusának ellentettjét jelöli, míg a pH a H+ ion koncentráció logaritmusának ellentettje. Két, egymástól független egyensúly áll fenn, ezek egyensúlyi állandói a következők:[9]
CrO2−4 + H+ ⇌ HCrO−4 log K1=5,89 2 HCrO−4 ⇌ Cr2O2−7 + H2O log K2=2,05
A megoszlási diagram értelmezése:
- Magas pH-n a kromátion (CrO2−4) a domináns részecske. A pH növelésével a kromátion aránya egyre nő, a 6,75-nél nagyobb pH-jú oldatokban pedig már csak ebben a formában fordul elő.
- Híg oldatokban, ha a pH < pK1, a fő részecske a hidrogénkromátion (HCrO−4).
- Töményebb oldatokban – a magas pH kivételével – a dikromátion (Cr2O2−7) a jellemző részecske.
A H2CrO4 és HCr2O−7 részecskék nincsenek feltüntetve, mivel ezek csak nagyon alacsony pH-n keletkeznek.
A megoszlási diagramok nagyon bonyolulttá válnak, ha többféle polimer részecske is képződhet,[10] mint például a vanadátok, molibdátok vagy volframátok esetén. További nehézséget jelent, hogy a nagyobb polimerek sokszor rendkívül lassan alakulnak ki, az egyensúly akár még hónapok alatt sem áll be, emiatt az egyensúlyi állandóra és a megoszlási diagramra hibás adatot kaphatunk.
Hivatkozások
[szerkesztés]- ↑ Greenwood, N.N.. Az elemek kémiája, 1., Budapest: Nemzeti Tankönyvkiadó (1999). ISBN 963-18-9144-5
- ↑ Aylett, founded by A.F. Holleman; continued by Egon Wiberg; translated by Mary Eagleson, William Brewer; revised by Bernhard J.. Inorganic chemistry, 1st English ed., [edited] by Nils Wiberg., San Diego, Calif.: Berlin: Academic Press, W. de Gruyter., 454. o. (2001). ISBN 0123526515
- ↑ Burgot, Jean-Louis. Ionic equilibria in analytical chemistry. New York: Springer, 358. o.. ISBN 1441983821
- ↑ Mueller, U.. Inorganic Structural Chemistry. Wiley (1993). ISBN 0-471-93717-7
- ↑ Lindqvist, I. (1950). „Crystal Structure Studies on Anhydrous Sodium Molybdates and Tungstates”. Acta Chem. Scand. 4, 1066–1074. o. DOI:10.3891/acta.chem.scand.04-1066.
- ↑ a b Wells, A.F.. Structural Inorganic Chemistry, 3rd, Oxford: Clarendon Press (1962) p446
- ↑ Lindqvist, I. (1950). „{{{title}}}”. Arkiv för Kemi 2, 32ha5. o.
- ↑ da Costa, C.P. (2000). „Lead(II)-Binding Properties of the 5′-Monophosphates of Adenosine (AMP2−), Inosine (IMP2−), and Guanosine (GMP2−) in Aqueous Solution. Evidence for Nucleobase−Lead(II) Interactions”. Inorg. Chem. 39 (26), 5985–5993. o. DOI:10.1021/ic0007207. PMID 11151499.
- ↑ Brito, F. (1997). „Equilibria of chromate(VI) species in acid medium and ab initio studies of these species”. Polyhedron 16 (21), 3835–3846. o. DOI:10.1016/S0277-5387(97)00128-9.
- ↑ Pope, M.T.. Heteropoly and Isopoly Oxometalates. Springer (1983). ISBN 0-387-11889-6
Fordítás
[szerkesztés]Ez a szócikk részben vagy egészben az Oxyanion című angol Wikipédia-szócikk ezen változatának fordításán alapul. Az eredeti cikk szerkesztőit annak laptörténete sorolja fel. Ez a jelzés csupán a megfogalmazás eredetét és a szerzői jogokat jelzi, nem szolgál a cikkben szereplő információk forrásmegjelöléseként.

![{\displaystyle K_{1}={\frac {[\mathrm {HCrO_{4}^{-}} ]}{[\mathrm {CrO_{4}^{2-}} ][\mathrm {H^{+}} ]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/58c28311b8a8a69931b4cfa144888a4d9e4306b1)
![{\displaystyle K_{2}={\frac {[\mathrm {Cr_{2}O_{7}^{2-}} ]}{[\mathrm {HCrO_{4}^{-}} ]^{2}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/8247e0ecc828c99522eb74cce96893d4a0ca1f60)