Karbamátok
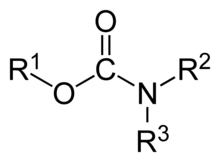
A karbamátok szerves vegyületek, a karbamidsav (NH2COOH) származékai. A karbamátcsoport, a karbamát-észterek (például az etil-karbamát) és a karbamidsavak szerkezetileg összefüggő funkciós csoportok, és kémiailag is gyakran átalakulnak egymásba. A karbamát-észtereket uretánoknak is nevezik.
Előállításuk
[szerkesztés]A karbamidsavakat aminokból nyerik:
- R2NH + CO2 → R2NCO2H
A karbamidsav körülbelül ugyanolyan erős sav, mint az ecetsav[forrás?], belőle egy proton leadásával karbamát anion, a karbamidsav konjugált bázisa keletkezik:
- R2NCO2H → R2NCO2- + H+
A kloroformamidok hidrolízise során is karbamátok keletkeznek:
- R2NC(O)Cl + H2O → R2NCO2H + HCl
Karbamátok keletkezhetnek Curtius-lebontás során is, ha a létrejött izocianátok alkohollal reagálnak:
- RNCO + R'OH → RNHCO2R'
Előfordulásuk és felhasználásuk
[szerkesztés]A cikkben többnyire a szerves karbamátokkal foglalkozunk, de megjegyzendő, hogy az egyik szervetlen sót, az ammónium-karbamátot nagy mennyiségben állítják elő köztitermékként a karbamid ammóniából és szén-dioxidból történő gyártása során.
Karbamátok a biokémiában
[szerkesztés]A dezoxihemoglobin α- és β-láncaiban levő valin aminosav maradékának N-terminális aminocsoportjai karbamátok formájában találhatók. Ezek segítik a fehérje stabilizálását a dezoxihemoglobinná alakulás során és növelik a fehérjéhez kötött maradék oxigénmolekulák felszabadulásának valószínűségét. Ezen karbamátcsoportoknak a hemoglobin O2 iránti affinitására kifejtett hatását Bohr-effektusnak nevezik.
Az ureázok és foszfotriészterázok lizin aminosav maradékának ε-aminocsoportjai is karbamát alakjában fordulnak elő. Az aminoimidazolból származó karbamát az inozin bioszintézisének köztiterméke. A karbamoil-foszfát inkább karboxifoszfátból, semmint CO2-ből keletkezik.[1]
CO2 megkötése ribulóz-1,5-biszfoszfát-karboxilázzal
[szerkesztés]Talán a legfontosabb karbamát a növények CO2-megkötésében részt vevő vegyület, mivel ez a folyamat a globális felmelegedés szempontjából is érdekes. A ribulóz-1,5-biszfoszfát-karboxiláz/oxigenáz enzim a reduktív pentózfoszfát-ciklus (Calvin-ciklus) első lépéseként egy molekula szén-dioxidot köt meg karbamát formájában. Az enzim aktív centrumában egy Mg2+ ion kötődik glutamát és aszpartát aminosav maradékához és egy lizin-karbamáthoz. A karbamát akkor keletkezik, amikor az ionhoz közeli töltés nélküli lizin oldallánc reagál a levegőből származó szén-dioxid molekulával (és nem a szubsztrát szén-dioxid molekulával). Ennek révén a lizin oldallánc töltötté válik, és így képessé válik a Mg2+ ion megkötésére.
Karbamát vegyületek
[szerkesztés]Karbamát inszekticidek
[szerkesztés]
Az úgynevezett karbamát inszekticidekben karbamát észter funkciós csoport található. Ebbe a vegyületcsoportba tartozik az aldikarb, a karbofurán (Furadan), a karbaril (Sevin), az etienokarb, a fenobukarb, az oxamil és a metomil. Ezek az inszekticidek a rovarokat az acetilkolin-észteráz reverzibilis inaktiválásával pusztítják el. A szerves foszfátvegyületek is ezt az enzimet gátolják, hatásuk azonban irreverzibilis, és így súlyosabb kolinerg mérgezést okozhatnak.[2]
A fenoxikarb ugyan tartalmaz karbamátcsoportot, de hatása inkább juvenilis hormonhatásán alapul, semmint az acetilkolin-észteráz gátlásán.[3]
Az ikaridin nevű rovarűzőszer szubsztituált karbamát.
Poliuretánok
[szerkesztés]A poliuretánok szerkezetében több karbamátcsoport is található. A „poliuretán” névben az „uretán” ezekre a karbamát csoportokra utal, a poliuretán nem tartalmaz és a gyártása során sem használnak etil-karbamátot (hétköznapi nevén „uretánt”). A poliuretán polimerek változatos tulajdonságokkal rendelkeznek, kereskedelmileg mint habok, elasztomerek és szilárd anyagok kaphatók. A poliuretánokat jellemzően diizocianátok, például toluol-diizocianát és diolok reakciójával állítják elő, a karbamát csoportok az alkoholok és izocianátok reakciójában keletkeznek:
- RN=C=O + R'OH → RNHC(O)OR'
Konzerválószerek és kozmetikumok
[szerkesztés]A jódpropinil-butilkarbamát fa- és festékkonzerválószer, de kozmetikumokban is használják.[4]
Gyógyszerek
[szerkesztés]Az uretánt vagy etil-karbamátot az Egyesült Államokban korábban kereskedelmi léptékben gyártották, mint rákellenes és egyéb betegségek kezelésére használt gyógyszert, de kiderült, hogy többnyire nem hatásos, hanem mérgező.[5] Esetenként állatgyógyászati szerként alkalmazzák.
Néhány karbamátot alkalmaznak a humán farmakoterápiában, például a neosztigmin és rivasztigmin kolinészteráz-gátlókat, melyek kémiai szerkezete a fizosztigmin, egy természetes alkaloid vázán alapul. További példák a meprobamát és származékai, például kariszoprodol, felbamát és tibamát, melyek az 1960-as években, a benzodiazepinek elterjedése előtt széles körben használt szorongásoldó és izomlazító gyógyszerek voltak, és egyes esetekben még ma is alkalmazzák őket.
A darunavirban – a proteáz-inhibitorok közé tartozó HIV-ellenes gyógyszer – is található karbamát funkciós csoport.
Kénanalógok
[szerkesztés]Az (1) jelű ROC(=O)NR2 karbamátban két oxigénatom található, melyek bármelyike vagy mindkettő kicserélhető kénatomra. A karbamátok azon megfelelőit, melyekben csak egy oxigént helyettesít kénatom, tiokarbamátoknak nevezzük (2 és 3). A mindkét helyen kénatommal helyettesített származékok (4) az RSC(=S)NR2 általános képletű ditiokarbamátok.
A tiokarbamátoknak két különböző típusú szerkezeti izomerje létezik:
- O-tiokarbamátok (2), ROC(=S)NR2, melyekben a karbonilcsoportot (C=O) tiokarbonilcsoport (C=S) helyettesíti
- S-tiokarbamátok (3), RSC(=O)NR2, melyekben az R–O– csoport helyett R–S– csoport található
Az O-tiokarbamátok izomerizációs reakcióban, például a Newman–Kwart-átrendeződés során átalakulhatnak S-tiokarbamáttá.

Fordítás
[szerkesztés]Ez a szócikk részben vagy egészben a Carbamate című angol Wikipédia-szócikk ezen változatának fordításán alapul. Az eredeti cikk szerkesztőit annak laptörténete sorolja fel. Ez a jelzés csupán a megfogalmazás eredetét és a szerzői jogokat jelzi, nem szolgál a cikkben szereplő információk forrásmegjelöléseként.
Jegyzetek
[szerkesztés]- ↑ Bartoschek, S.; Vorholt, J. A.; Thauer, R. K.; Geierstanger, B. H. and Griesinger, C., "N-Carboxymethanofuran (carbamate) formation from methanofuran and CO2 in methanogenic archaea : Thermodynamics and kinetics of the spontaneous reaction", Eur. J. Biochem., 2001, 267, 3130-3138. doi:10.1046/j.1432-1327.2000.01331.x
- ↑ Robert L. Metcalf “Insect Control” in Ullmann’s Encyclopedia of Industrial Chemistry” Wiley-VCH, Weinheim, 2002. doi:10.1002/14356007.a14_263
- ↑ Cornell University site on Fenoxycarb
- ↑ Badreshia, S (2002). „Iodopropynyl butylcarbamate”. American Journal of Contact Dermatitis 13 (2), 77–79. o. DOI:10.1053/ajcd.2002.30728. ISSN 1046199X.
- ↑ Holland JR, Hosley H, Scharlau C, Carbone PP, Frei E 3rd, Brindley CO, Hall TC, Shnider BI, Gold GL, Lasagna L, Owens AH Jr, Miller SP (1966. március 1.). „A controlled trial of urethane treatment in multiple myeloma” (free fulltext). Blood 27 (3), 328–42. o. [2007. március 28-i dátummal az eredetiből archiválva]. ISSN 0006-4971. PMID 5933438. (Hozzáférés: 2010. szeptember 11.)
