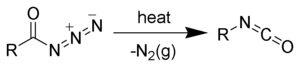Curtius-lebontás
A Curtius-lebontás az elsőként Theodor Curtius által leírt szerves kémiai reakció, melynek közbenső lépései során egy savazid izocianáttá rendeződik át.[1][2] A reakcióról több összefoglaló munkát publikáltak.[3][4]
Az izocianát különböző nukleofilekkel fogható meg. A reakcióelegyhez gyakran vizet adnak, hogy az izocianát hidrolízisével amint kapjanak.[5] Terc-butanol jelenlétében a reakció során Boc-csoporttal védett amin keletkezik, mely a szerves szintézisek értékes köztiterméke.[6][7]
A karbonsavak (1) difenilfoszforil-aziddal (2) könnyen savazidokká (3) alakíthatók.[8][9][10]
A Curtius-lebontást benzil-alkohol jelenlétében végezve a fentihez hasonló módon Cbz-védőcsoportot tartalmazó amin keletkezik.[11]
Reakciómechanizmus
[szerkesztés]A Curtius-lebontás kétlépéses folyamatnak tekinthető, melynek az első lépése egy acil-nitrén (2) keletkezése és nitrogén kilépése, a második lépés pedig az acil-nitrén átrendeződése R csoport vándorlással, melynek során a kívánt izocianát (3) keletkezik. A jelenleg rendelkezésre álló bizonyítékok azt mutatják, hogy ez a két lépés valószínűleg koncertikus (azaz egyidőben megy végbe), és nem keletkezik szabad nitrén köztitemék.[12]
Kiterjesztés
[szerkesztés]A reakció egyik változata a Darapsky-lebontás (A. Darapsky, 1936), ennek közbensői lépései során α-cianoészter átrendeződésével aminosav keletkezik.[13]
Kapcsolódó szócikkek
[szerkesztés]Fordítás
[szerkesztés]Ez a szócikk részben vagy egészben a Curtius rearrangement című angol Wikipédia-szócikk ezen változatának fordításán alapul. Az eredeti cikk szerkesztőit annak laptörténete sorolja fel. Ez a jelzés csupán a megfogalmazás eredetét és a szerzői jogokat jelzi, nem szolgál a cikkben szereplő információk forrásmegjelöléseként.
Hivatkozások
[szerkesztés]- ↑ Curtius, T. (1890). „{{{title}}}”. Ber. 23, 3023. o.
- ↑ (1894) „20. Hydrazide und Azide organischer Säuren I. Abhandlung”. Journal fër Praktische Chemie 50, 275–294. o. DOI:10.1002/prac.18940500125.
- ↑ Smith, P. A. S. (1946). „{{{title}}}”. Org. React. 3, 337–449. o.
- ↑ (1988) „Azides: their preparation and synthetic uses”. Chemical Reviews 88 (2), 297. o. DOI:10.1021/cr00084a001.
- ↑ Kaiser, C.; Weinstock, J. (1988). „Amines from mixed carboxylic-carbonic anhydrides: 1-phenylcyclopentylamine”. Org. Synth..; Coll. Vol. 6: 910
- ↑ (1998) „A Calorimetric Investigation to Safely Scale-Up a Curtius Rearrangement of Acryloyl Azide”. Organic Process Research & Development 2 (6), 382. o. DOI:10.1021/op970115w.
- ↑ (2005) „Boc-protected amines via a mild and efficient one-pot Curtius rearrangement”. Organic Letters 7 (19), 4107–4110. o. DOI:10.1021/ol051428b. PMID 16146363.
- ↑ Shioiri, T.; Yamada, S. (1990). „Diphenyl phosphorazidate”. Org. Synth..; Coll. Vol. 7: 206
- ↑ (1972) „Diphenylphosphoryl azide. New convenient reagent for a modified Curtius reaction and for peptide synthesis”. Journal of the American Chemical Society 94 (17), 6203–6205. o. DOI:10.1021/ja00772a052. PMID 5054412.
- ↑ (1974) „Phosphorus in organic synthesis—VII , Diphenyl phosphorazidate (DPPA). A new convenient reagent for a modified curtius reaction”. Tetrahedron 30 (14), 2151–2157. o. DOI:10.1016/S0040-4020(01)97352-1.
- ↑ Jessup, P. J.; Petty, C. B.; Roos, J.; Overman, L. E. (1988). „1-N-Acylamino-1,3-dienes from 2,4-pentadienoic acids by the Curtius rearrangement: benzyl trans-1,3-butadiene-1-carbamate”. Org. Synth..; Coll. Vol. 6: 95
- ↑ March's Advanced Organic Chemistry, 6th, Hoboken, New Jersey: Wiley, 1609. o. (2007). ISBN 978-0-471-72091-1
- ↑ Archivált másolat. [2008. május 2-i dátummal az eredetiből archiválva]. (Hozzáférés: 2012. november 1.)