Kálium-oxid
| Kálium-oxid | |
 kálium-oxid | |
| IUPAC-név | kálium-oxid |
| Más nevek | kálium-monoxid |
| Kémiai azonosítók | |
|---|---|
| CAS-szám | 12136-45-7 |
| Kémiai és fizikai tulajdonságok | |
| Kémiai képlet | K2O |
| Moláris tömeg | 94,20 g/mol |
| Megjelenés | halványsárga szilárd anyag |
| Sűrűség | 2,35 g/cm³ |
| Olvadáspont | >350 °C, bomlik |
| Oldhatóság (vízben) | heves reakcióban KOH keletkezik |
| Kristályszerkezet | |
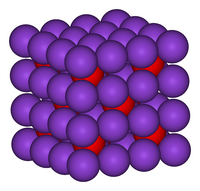
| Kristályszerkezet | Antifluorit (köbös), cF12 |
| Tércsoport | Fm3m, No. 225 |
| Koordinációs geometria |
tetraéderes (K+); köbös (O2–) |
| Veszélyek | |
| MSDS | ICSC 0769 |
| EU Index | nincs listázva |
| Főbb veszélyek | Korrozív, vízzel hevesen reagál |
| Lobbanáspont | nem gyúlékony |
| Rokon vegyületek | |
| Azonos kation | kálium-szulfid |
| Azonos anion | lítium-oxid nátrium-oxid rubídium-oxid cézium-oxid |
| Rokon kálium-oxidok | kálium-peroxid kálium-szuperoxid |
| Rokon vegyületek | kálium-hidroxid |
| Ha másként nem jelöljük, az adatok az anyag standardállapotára (100 kPa) és 25 °C-os hőmérsékletre vonatkoznak. | |
A kálium-oxid a kálium és oxigén halványsárga színű ionvegyülete, a kálium legegyszerűbb oxidja. Ritkán előforduló, nagyon reakcióképes vegyület. Néhány kereskedelmi forgalomban elérhető anyag, például műtrágyák és cementek százalékos hatóanyagtartalmát ekvivalens mennyiségű K2O-ra vonatkoztatva adják meg.
Előállítása
[szerkesztés]Oxigén és kálium reakciójával állítják elő, melynek során K2O2 kálium-peroxid keletkezik, majd ezt fémkáliummal reagáltatva kapják az oxidot:[1]
- K2O2 + 2 K → 2 K2O
Másik, kényelmesebb eljárás szerint K2O-t kálium-nitrát és fémkálium hevítésével szintetizálnak:
- 2 KNO3 + 10 K → 6 K2O + N2
Kálium-hidroxidból vízelvonással nem lehet oxidot nyerni.
Tulajdonságai és reakciói
[szerkesztés]A K2O antifluorit rácsban kristályosodik, melyben a kationok és anionok helye a CaF2 rácsához képest fel van cserélve. A káliumionokat 4 oxidion veszi körül, míg az oxidionokhoz 8 káliumion koordinálódik.[2][3] A K2O bázikus oxid, vízzel hevesen reagálva maró hatású kálium-hidroxid keletkezik belőle. Levegőn állva elfolyósodik, mivel elnyeli annak víztartalmát, minek hatására beindul a fenti reakció.
Kálium-oxid a műtrágyákban
[szerkesztés]A műtrágyák címkéjén az N-P-K (nitrogén-foszfor-kálium) számokban a K2O képletet használják, amely bár a kálium-oxid helyes kémiai képlete, azonban ezekben a termékekben nem magát a kálium-oxidot használják. A műtrágyák káliumforrása általában kálium-klorid, kálium-szulfát vagy kálium-karbonát. A címkén szereplő K2O százalékos mennyisége a műtrágyában levő kálium mennyiségét adja meg, ha az kálium-oxid formájában lenne jelen. A kálium-oxid tömegének kb. 83%-a kálium, de pl. a kálium-kloridban az aránya csak 52%, így a kálium-kloridban kevesebb kálium van, mint az ugyanolyan tömegű kálium-oxidban. Emiatt ha egy műtrágya tömegének 30%-a kálium-klorid, akkor káliumtartalma a – kálium-oxidban történő – szokásos megadási mód szerint csak 19%.
Fordítás
[szerkesztés]Ez a szócikk részben vagy egészben a Potassium oxide című angol Wikipédia-szócikk ezen változatának fordításán alapul. Az eredeti cikk szerkesztőit annak laptörténete sorolja fel. Ez a jelzés csupán a megfogalmazás eredetét és a szerzői jogokat jelzi, nem szolgál a cikkben szereplő információk forrásmegjelöléseként.
Hivatkozások
[szerkesztés]- ↑ Holleman, A. F.; Wiberg, E. "Inorganic Chemistry" Academic Press: San Diego, 2001. ISBN 0-12-352651-5.
- ↑ Zintl, E.; Harder, A.; Dauth B. (1934), "Gitterstruktur der oxyde, sulfide, selenide und telluride des lithiums, natriums und kaliums", Z. Elektrochem. Angew. Phys. Chem. 40: 588–93
- ↑ Wells, A.F. (1984) Structural Inorganic Chemistry, Oxford: Clarendon Press. ISBN 0-19-855370-6.
