Humán metapneumovírus
| Ezen a lapon vagy szakaszban aktuális eseményről, jelenségről vagy egyéb témáról számolunk be. Az itt közöltek az idő múlásával jelentősen megváltozhatnak, pontosításra, helyreigazításra szorulhatnak. Legutóbbi módosítás: 2025. február 6. |
| Humán metapneumovírus | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| ||||||||||||||||
| Vírusbesorolás | ||||||||||||||||
| ||||||||||||||||
| Hivatkozások | ||||||||||||||||
A Wikifajok tartalmaz Humán metapneumovírus témájú rendszertani információt. |
A humán metapneumovírus (HMPV vagy hMPV) a Pneumoviridae családba tartozó, negatív szenzitású, egyszálú RNS-vírus, amely közeli rokonságban áll az úgynevezett madár metapneumovírus (AMPV) C alcsoportjával. Először 2001-ben izolálták Hollandiában a RAP-PCR (RNS-alapú tetszőleges primerű PCR) technikával kitenyésztett, sejtekben növekvő, ismeretlen vírusok azonosítása során. [1] 2016-ban ez volt a második leggyakoribb oka a vizsgálatok szerint (az RSV-vírus után) az egyébként egészséges, 5 év alatti gyermekek akut légúti megbetegedésének egy nagy amerikai járóbeteg-klinikán.[2]
A HMPV klinikai jellemzői és ezen betegség súlyossága hasonló az RSV víruséhoz. A HMPV az idős felnőttek és fiatal csecsemők betegségeinek is fontos oka.
Rendszertan
[szerkesztés]| Nemzetség | Faj | Vírus (rövidítés) | NCBI-rendszertaniazonosító |
|---|---|---|---|
| Metapneumovirus | Metapneumovirus avis | madár-metapneumovírus (AMPV) | 38525 |
| metapneumovirus hominis | Humán metapneumovírus (HMPV) | 162145 |
Felfedezés és név
[szerkesztés]A humán metapneumovírust Bernadette G. van den Hoogen és kollégái fedezték fel 2001-ben.[5][6][7][8] Először 28 gyerek légzőrendszere által kibocsátott anyagból izolálták, és a többi korábban ismert gyakori légzőrendszer-fertőző vírustól eltért, mivel az általuk használt módszerek (például vírusspecifikus antitesteken alapuló immunológiai assay-k és vírusgenom-specifikus primereket használó PCR-módszerek) csak ismert vírusok tesztelésére voltak alkalmasak, így nem lehetett az új vírust azonosítani.[5] Csak a molekuláris biológiai technikák megjelenésekor derültek ki genetikai jellemzői és genomszakaszai, ilyenek például a véletlenszerű PCR-technika, mely korlátozott szekvenciaadatokat adott, de lehetővé tette az új vírus és a madár-metapneumovírus közti kapcsolat igazolását.[5] Az AMPV-hez való közeli kapcsolat miatt e vírust humán metapneumovírusnak nevezték el,[5] metapneumovírusok közti helye és emberi gazdája alapján.
Epidemiológia
[szerkesztés]Egy járóbeteg-klinikán a más megbetegedés nélküli gyermekek 12%-ában volt jelen,[2] az 5 éven aluli közösségben szerzett tüdőgyulladásos gyermekek 15, az 5 éven felüliek 8%-ában mutatták ki 2010–2012 közt.[9] A vírus világszerte megtalálható, mérsékelt övezetben elterjedése szezonális, és az RSV-t és az influenzavírust követi tél végén, tavasz elején.[2][10] Szerológiai tanulmányok szerint 5 éves korra a legtöbb gyermek kapcsolatba kerül a vírussal.[1][11][12][13] Ennek ellenére idősebb gyermekekben és felnőttekben gyakori az újrafertőződés.[2][14][12][15] Enyhe felső légúti megbetegedést okozhat. Azonban a koraszülöttek,[16] az immunhiányosak[17][18][19][20] és a 65 év felettiek[15][21][22] súlyosabb, akár kórházi beavatkozást is igénylő megbetegedést is okozhat. Egyes ilyen esetekben közel olyan gyakori és súlyos az idősebbekben, mint az influenza.[15][21][22][23] Súlyosabb a betegség asztmás[24][25][26][27] és krónikus obstruktív tüdőbetegséggel (COPD) élő személyekben.[28][29][30] Több járvány ismert hosszútávú gondozóházakban gyermekeknél és felnőtteknél is, alkalmanként áldozatokkal is.[31][32][33][34][35]
Genom
[szerkesztés]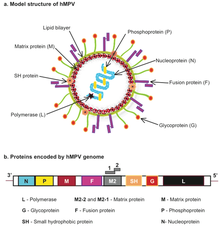
Genomszerkezete hasonlít a RSV-hez, de nincsenek benne NS1 és NS2 gének. Antiszenz RNS-genomja 8 nyitott leolvasási kerettel rendelkezik, melyek sorrendje az RSV-étől kissé eltér (3’-N-P-M-F-M2-SH-G-L-5’).[36] Genetikailag hasonlít a madár-metapneumovírus A-hoz, B-hez és különösen a C-hez. Filogenetikai elemzése 2 fő genetikai ágat (A, B) mutatott ki, bennük A1/A2 és B1/B2 alcsoportokkal. Az F és G gének genotipizálása alapján a B típus hosszabb köhögéssel és általános légúti tünetekkel függ össze, mint az A.[37]
Életciklus és szaporodás
[szerkesztés]Becslések szerint inkubációs időszaka 3–6 nap, és a mérsékelt övezetben gyakran tél végén és tavasszal aktív, átfedve az RSV- és influenzaszezonokkal, és lehetővé téve az ismétlődő fertőzést.[6] 2012-ben a hMPV és replikációs ciklusa nem volt jól ismert. Egyes főbb lépéseit tanulmányozták víruséletciklusokon alapuló kísérletekkel és a Paramyxoviridae többi tagjának reproduktív mérésével.[38]
A replikációs ciklus első lépése a gazdasejthez – a légúti epitélium egyik sejtjéhez – való kapcsolódás G-proteinnel.[8][38] Ezen lebontatlan jelzőpeptidként és kapcsolatkönnyítő membránkapocsként működő hidrofób szakasz van, azonban mivel az e nélküli rekombináns vírusok is képesek in vitro és in vivo is replikálni, a replikációs ciklus többi szakaszához feltehetően nem kell e kapcsolódás.[8]
Ezután a vírus- és gazdamembránok egyesülnek valószínűleg az F-protein által.[8][38] Bár ez a többi Paramyxoviridae-taghoz hasonló, és az F-protein konformációváltozásai is részei, ehhez nem kell G-protein a család többi tagjához hasonlóan, ez megerősíti, hogy nincs szükség G-proteinre a hMPV-replikációsciklus későbbi szakaszaihoz.[8][38] Az F-protein fúziós funkciója igazolja a gazdasejthez integrin αvβ1-gyel való kötés képességét arginilglicilaszparaginsav- (RGD) motívummal, ez okozhatja feltehetően a membránfúziót.[8] Fő különbség a hMPV és más Paramyxoviridae-tagok fúziója közt, hogy a hMPV savas, a többi vírus semleges pH-n fuzionál, azonban további kutatások kellenek annak jobb ismeretéhez, hogy mi az eltérés a hMPV fúziójában, és miért jelent ez meg.[38] Bár funkciója ismeretlen, az SH glikoprotein jelenléte nem befolyásolja a replikációs kinetikát, a citopátiás hatást vagy a plakk-képzést.[38]
Egyesülés után az antiszenz vírus-RNS-t tartalmazó vírus-ribonukleoprotein (RNP) a sejtplazmába kerül, és mRNS- és antigenomikus cRNS-szintézishez templáttá válik.[8] Ettől kezdve a hMPV-transzkripció ismerete az RSV-ről és más Paramyxoviridae-fajokról szóló ismeretből levezetett, például hogy a vezető és követő szekvenciák részben komplementerek, és transzkripciós promoterek.[8] Az N, P és L fehérjék leválnak a vRNS-ről, és egymáshoz kötve polimerázkomplexet alkotnak, így a genom-RNS mátrix lehet a virális transzkripcióhoz és replikációhoz a sejtplazmában.[38] A replikáció utolsó valamennyire ismert lépése a burok-glikoproteinek Golgi-készülékkel a membrán felhalmozódási zónáihoz való mozgatása, ahol a fertőzött sejtek felszínén csupasszá válnak.[38] Így a fertőzött sejtek virális fúziós fehérjék által egyesülnek a szomszédos sejtekkel, terjesztve a vírus genomját.[38] Az RNS- és vírusfehérje-szintézis utáni részek ismeretlenek, így további kutatást igényelnek.[8]
Virológia
[szerkesztés]A HMPV az orr és a tüdő epitél sejtjeit fertőzi. Feltehetően a glikoprotein és a heparán-szulfát és más glükózaminoglikánok közti kapcsolat útján fertőzi meg a sejteket. Az F-protein RGD-motívumot tartalmaz, mely aktiválja az RGD-kötő integrineket mint sejtreceptorokat,[39][40][41][42] majd a sejtmembrán és a vírusburok egyesülését pH-függetlenül, feltehetően endoszóma révén mediálja.[43][44] Ezután kemokin- és citokinválaszt – például IL–6, IFN–α, TNF–α, IL–2 és makrofág-gyulladásfehérjék – indukál, mely peribronchioláris és perivaszkuláris infiltrációt és gyulladást okoz.[45]
Kimutatás
[szerkesztés]
A HMPV azonosítása elsősorban reverz transzkriptázos polimeráz-láncreakciós technológián alapul, mely közvetlenül a légúti példányokból kinyert RNS sokszorosításán alapul. Költséghatékonyabb alternatív nukleinsav-alapú módszerek például:
- HMPV-antigének nasopharyngealis szekréciókból való kimutatása immunfluoreszcenciával
- immunfluoreszcens festés monoklonális antitestekkel a HMPV nasopharyngealis szekréciókból és víruskultúrákból való kimutatásához
- immunfluoreszcenciás assay-k HMPV-specifikus antitestek kimutatásához
- poliklonális antitestek használata és izolációja sejtkultúrákból.
Elterjedés és gazdák
[szerkesztés]Bár a HMPV-t 2001-ben fedezték fel és azonosították, szerológiai tanulmányok szerint az vagy egy közeli rokona legalább 50 évig már jelen volt.[5][46] Így nem egyszerűen „átugrott” a madarakról vagy más állati gazdáról az emberekre felfedezése előtt.[5]
2022-ben a legtööbb fertőzés az északi féltekén tél végén, tavasz elején van, de globálisan – minden kontinensen – megtalálható,[46] és elterjedése összetett és dinamikus.[5] Általában lokalizált, és közösségenként jelentősen eltérhet, így egy egy helyen egy évben kimutatott törzshöz legjobban hasonló lehet a következő évben máshol kimutatott törzs.[5] E jelenséget 2001-ben Ausztráliában, Franciaországban 2000-ben és 2002-ben, Izraelben 2002-ben és Hollandiában 2001-ben kimutatott törzsek F-gén alapján kimutatott nagyon közeli rokonságában észlelték.[5] Legalább 2 fő genotípusa van (A és B), melyek közösségekben megjelenő járványokban terjednek, és minden genotípus 2 altípusból áll,[5] de feltehetően egyik törzs se dominál a többi felett, és egyik se okoz változó súlyosságú tüneteket.[46]
Többnyire fertőzött személyektől terjed mások felé köhögéssel és tüsszentéssel kibocsátott részecskékkel, közeli kontakttal (például érintés, kézfogás) és vírussal rendelkező tárgyak érintését követő száj-, orr- vagy szemérintéssel.[6] 2023-ban még nem volt ismert megbízható antivirális terápia kezeléssel vagy oltással, de vannak ígéretes fejlesztések e téren.[5][6] Egyes oltáskísérletekben kimutatták, hogy az élő, HMPV-F-gén-tartalmú rekombináns humán parainfluenza-vírus indukálhat HMPV-specifikus antitesteket, és megvédheti a kísérleti állatokat a HMPV-től.[5] Egy másik hasonló tanulmány szerint a HMPV-F-gént expresszáló bovinus/humán parainfluenza-vírus 3-kiméra védhet a parainfluenzától és a HMPV-től.[5] E kísérletek több korlátozással rendelkeznek, például kis populációjú állatmodelleket használtak.[5] Így bár az oltások és antivirális kezelések készülnek, a legnagyobb nehézség a korlátozott adatmennyiség a HMPV természetes gazdában való fejlődéséről.[5]
Terjedés
[szerkesztés]Valószínűleg szennyezett szekréciókkal terjed csepp-, aeroszol- vagy fomitvektorral.[47] Kórházi fertőzésként is ismert.[48] Ősszel és télen egy altípus évente váltakozó predominanciájával jelenik meg.[37]
Kezelés
[szerkesztés]2008-ban nem volt ismert humán gyógyszer ellene.[49] Az RSV kezelésére használt ribavirin állatmodellben hatékonynak bizonyult.[50]
A Moderna klinikai kísérletet végzett egy lehetséges modRNS-vakcinával a metapneumovírus ellen.[51] 2019 októberében az oltásjelölt teljesítette az I. fázist, melynek beszámolói szerint az oltást minden dózis mellett jól tolerálja a szervezet, és immunválaszt okoz, mely növeli a hatástalanító antitestek termelését.[52]
Evolúció
[szerkesztés]A humán metapneumovírust először 2001-ben írták le, a madár-metapneumovírus az 1970-es években. Legalább 4 humánmetapneumovírus-ág van, az A1, az A2, a B1 és a B2. A madár-metapneumovírus is 4 csoporttal rendelkezik (A, B, C, D). Bayes-valószínűség-alapú becslések szerint a HMPV 1875–1889 közt alakulhatott ki, és 1800 körül válhatott le a madár-metpaneumovírusról.[53]
2024–2025-ös járvány
[szerkesztés]A Kínai Járványkontroll- és -megelőzési Központ adatai szerint jelentősen nőtt a légúti fertőzések száma 2024. december 16–22. közt,[54] a pozitív tesztek 6,2%-a és a légúti betegség miatti kórházi esetek 5,4%-a a HMPV-vel függött össze, több esettel, mint a Covid19, a rinovírus vagy az adenovírus.[55] Kan Biao, a Nemzeti Terjedőbetegség-irányítási és -megelőzési Központ vezetője szerint a HMPV gyakorisága 15 éven aluliak közt is jelentősen nőtt Kínában.[56] Hongkongban és más országokban, például Malajziában, Kazahsztánban és Indiában is voltak igazolt HMPV-esetek.[57][58][59][60]
Jegyzetek
[szerkesztés]- ↑ a b van den Hoogen (2001). „A newly discovered human pneumovirus isolated from young children with respiratory tract disease”. Nature Medicine 7 (6), 719–724. o. DOI:10.1038/89098. PMID 11385510. PMC 7095854.
- ↑ a b c d Williams (2004. január 29.). „Human Metapneumovirus and Lower Respiratory Tract Disease in Otherwise Healthy Infants and Children”. New England Journal of Medicine 350 (5), 443–450. o. DOI:10.1056/nejmoa025472. ISSN 0028-4793. PMID 14749452. PMC 1831873.
- ↑ ICTV Online (10th) Report
- ↑ (2017. április 7.) „Taxonomy of the order Mononegavirales: update 2017”. Archives of Virology 162 (8), 2493–2504. o. DOI:10.1007/s00705-017-3311-7. PMID 28389807. PMC 5831667.
- ↑ a b c d e f g h i j k l m n o Kahn JS (2006. július 1.). „Epidemiology of Human Metapneumovirus”. Clinical Microbiology Reviews 19 (3), 546–557. o. DOI:10.1128/cmr.00014-06. PMID 16847085. PMC 1539100.
- ↑ a b c d Human Metapneumovirus. Centers for Disease Control and Prevention , 2023. április 13.
- ↑ Human Metapneumovirus (HMPV): Causes & Treatment. Cleveland Clinic
- ↑ a b c d e f g h i Schildgen V, van den Hoogen B, Fouchier R, Tripp RA, Alvarez R, Manoha C, Williams J, Schildgen O (2011. október 1.). „Human Metapneumovirus: Lessons Learned over the First Decade”. Clinical Microbiology Reviews 24 (4), 734–754. o. DOI:10.1128/cmr.00015-11. PMID 21976607. PMC 3194831.
- ↑ Jain S, Williams DJ, Arnold SR, Ampofo K, Bramley AM, Reed C, Stockmann C, Anderson EJ, Grijalva CG (2015. február 25.). „Community-acquired pneumonia requiring hospitalization among U.S. children” (angol nyelven). New England Journal of Medicine 372 (9), 835–845. o. DOI:10.1056/nejmoa1405870. PMID 25714161. PMC 4697461.
- ↑ Williams JV, Wang CK, Yang CF, Tollefson SJ, House FS, Heck JM, Chu M, Brown JB, Lintao LD (2006. február 1.). „The Role of Human Metapneumovirus in Upper Respiratory Tract Infections in Children: A 20-Year Experience”. The Journal of Infectious Diseases 193 (3), 387–395. o. DOI:10.1086/499274. ISSN 0022-1899. PMID 16388486. PMC 1586246.
- ↑ Leung J, Esper F, Weibel C, Kahn JS (2005. március 1.). „Seroepidemiology of Human Metapneumovirus (hMPV) on the Basis of a Novel Enzyme-Linked Immunosorbent Assay Utilizing hMPV Fusion Protein Expressed in Recombinant Vesicular Stomatitis Virus” (angol nyelven). Journal of Clinical Microbiology 43 (3), 1213–1219. o. DOI:10.1128/jcm.43.3.1213-1219.2005. ISSN 0095-1137. PMID 15750086. PMC 1081231.
- ↑ a b Pavlin JA, Hickey AC, Ulbrandt N, Chan YP, Endy T, Boukhvalova MS, Chunsuttiwat S, Nisalak A, Libraty DH (2008. szeptember 15.). „Human Metapneumovirus Reinfection among Children in Thailand Determined by ELISA Using Purified Soluble Fusion Protein”. The Journal of Infectious Diseases 198 (6), 836–842. o. DOI:10.1086/591186. ISSN 0022-1899. PMID 18680407. PMC 2648801.
- ↑ Dunn SR, Ryder AB, Tollefson SJ, Xu M, Saville BR, Williams JV (2013. október 1.). „Seroepidemiologies of Human Metapneumovirus and Respiratory Syncytial Virus in Young Children, Determined with a New Recombinant Fusion Protein Enzyme-Linked Immunosorbent Assay” (angol nyelven). Clinical and Vaccine Immunology 20 (10), 1654–1656. o. DOI:10.1128/cvi.00750-12. ISSN 1556-6811. PMID 23945161. PMC 3807191.
- ↑ Howard LM, Edwards KM, Zhu Y, Griffin MR, Weinberg GA, Szilágyi PG, Staat MA, Payne DC, Williams JV (2017). „Clinical Features of Human Metapneumovirus Infection in Ambulatory Children Aged 5–13 Years”. Journal of the Pediatric Infectious Diseases Society 7 (2), 165–168. o. DOI:10.1093/jpids/pix012. PMID 28369564. PMC 5954304.
- ↑ a b c Falsey AR, Erdman D, Anderson LJ, Walsh EE (2003. március 1.). „Human Metapneumovirus Infections in Young and Elderly Adults”. The Journal of Infectious Diseases 187 (5), 785–790. o. DOI:10.1086/367901. ISSN 0022-1899. PMID 12599052.
- ↑ Williams JV, Maitre N (2016. július 28.). „Human metapneumovirus in the preterm neonate: current perspectives” (english nyelven). Research and Reports in Neonatology 6, 41–49. o. DOI:10.2147/rrn.s76270. PMID 27891060. PMC 5120728.
- ↑ Shahda S, Carlos WG, Kiel PJ, Khan BA, Hage CA (2011. június 1.). „The human metapneumovirus: a case series and review of the literature” (angol nyelven). Transplant Infectious Disease 13 (3), 324–328. o. DOI:10.1111/j.1399-3062.2010.00575.x. ISSN 1399-3062. PMID 21631655. PMC 3107511.
- ↑ Chu HY, Renaud C, Picken E, Thomson B, Kuypers J, Englund JA (2014. december 1.). „Respiratory Tract Infections Due to Human Metapneumovirus in Immunocompromised Children”. Journal of the Pediatric Infectious Diseases Society 3 (4), 286–293. o. DOI:10.1093/jpids/piu100. ISSN 2048-7193. PMID 25419459. PMC 4240341.
- ↑ Seo S, Gooley TA, Kuypers JM, Stednik Z, Jerome KR, Englund JA, Boeckh M (2016. július 15.). „Human Metapneumovirus Infections Following Hematopoietic Cell Transplantation: Factors Associated With Disease Progression”. Clinical Infectious Diseases 63 (2), 178–185. o. DOI:10.1093/cid/ciw284. ISSN 1058-4838. PMID 27143659. PMC 4928387.
- ↑ (2016) „Human metapneumovirus infections in hematopoietic cell transplant recipients and hematologic malignancy patients: A systematic review”. Cancer Letters 379 (1), 100–106. o. DOI:10.1016/j.canlet.2016.05.035. PMID 27260872. PMC 4935561.
- ↑ a b (2008. december 8.) „Human Metapneumovirus Infections in Adults: Another Piece of the Puzzle”. Archives of Internal Medicine 168 (22), 2489–2496. o. DOI:10.1001/archinte.168.22.2489. ISSN 0003-9926. PMID 19064834. PMC 2783624.
- ↑ a b (2012. július 1.) „Rates of Hospitalizations for Respiratory Syncytial Virus, Human Metapneumovirus, and Influenza Virus in Older Adults”. The Journal of Infectious Diseases 206 (1), 56–62. o. DOI:10.1093/infdis/jis309. ISSN 0022-1899. PMID 22529314. PMC 3415933.
- ↑ (2014. május 1.) „Respiratory syncytial virus- and human metapneumovirus-associated emergency department and hospital burden in adults” (angol nyelven). Influenza and Other Respiratory Viruses 8 (3), 347–352. o. DOI:10.1111/irv.12234. ISSN 1750-2659. PMID 24512531. PMC 3984605.
- ↑ (2005. október 1.) „Human Metapneumovirus Infection Plays an Etiologic Role in Acute Asthma Exacerbations Requiring Hospitalization in Adults”. The Journal of Infectious Diseases 192 (7), 1149–1153. o. DOI:10.1086/444392. ISSN 0022-1899. PMID 16136455. PMC 1476781.
- ↑ Williams JV, Tollefson SJ, Heymann PW, Carper HT, Patrie J, Crowe JE (2005). „Human metapneumovirus infection in children hospitalized for wheezing”. Journal of Allergy and Clinical Immunology 115 (6), 1311–1312. o. DOI:10.1016/j.jaci.2005.02.001. PMID 15940152. PMC 1476700.
- ↑ (2007. május 1.) „Human metapneumovirus bronchiolitis in infancy is an important risk factor for asthma at age 5” (angol nyelven). Pediatric Pulmonology 42 (5), 458–464. o. DOI:10.1002/ppul.20597. ISSN 1099-0496. PMID 17427899.
- ↑ (2007) „Prevalence of viral respiratory tract infections in children with asthma”. Journal of Allergy and Clinical Immunology 119 (2), 314–321. o. DOI:10.1016/j.jaci.2006.08.041. PMID 17140648. PMC 7112359.
- ↑ (2004. július 1.) „Human Metapneumovirus and Chronic Obstructive Pulmonary Disease”. Emerging Infectious Diseases 10 (7), 1338–1339. o. DOI:10.3201/eid1007.030633. ISSN 1080-6040. PMID 15338546. PMC 3323314.
- ↑ Martinello RA, Esper F, Weibel C, Ferguson D, Landry ML, Kahn JS (2006). „Human metapneumovirus and exacerbations of chronic obstructive pulmonary disease”. Journal of Infection 53 (4), 248–254. o. DOI:10.1016/j.jinf.2005.11.010. PMID 16412516. PMC 7112509.
- ↑ Kan-o K, Ramirez R, MacDonald MI, Rolph M, Rudd PA, Spann KM, Mahalingam S, Bardin PG, Thomas BJ (2017. május 15.). „Human Metapneumovirus Infection in Chronic Obstructive Pulmonary Disease: Impact of Glucocorticosteroids and Interferon”. The Journal of Infectious Diseases 215 (10), 1536–1545. o. DOI:10.1093/infdis/jix167. ISSN 0022-1899. PMID 28379462.
- ↑ (2007. május 1.) „An Outbreak of Severe Respiratory Tract Infection Due to Human Metapneumovirus in a Long-Term Care Facility”. Clinical Infectious Diseases 44 (9), 1152–1158. o. DOI:10.1086/513204. ISSN 1058-4838. PMID 17407031.
- ↑ (2007. szeptember 1.) „A Summer Outbreak of Human Metapneumovirus Infection in a Long-Term-Care Facility”. The Journal of Infectious Diseases 196 (5), 705–708. o. DOI:10.1086/519846. ISSN 0022-1899. PMID 17674312.
- ↑ (2012. június 1.) „Epidemiology of Human Metapneumovirus in a Pediatric Long-Term Care Facility”. Infection Control & Hospital Epidemiology 33 (6), 545–550. o. DOI:10.1086/665727. ISSN 0899-823X. PMID 22561708.
- ↑ Outbreaks of Human Metapneumovirus in Two Skilled Nursing Facilities — West Virginia and Idaho, 2011–2012 (angol nyelven). www.cdc.gov . (Hozzáférés: 2017. szeptember 16.)
- ↑ (2014. február 6.) „Outbreak of human metapneumovirus infection in a severe motor-and-intellectual disabilities ward in Japan”. Japanese Journal of Infectious Diseases 67 (4), 318–321. o. DOI:10.7883/yoken.67.318. ISSN 1884-2836. PMID 25056083.
- ↑ van den Hoogen BG, Bestebroer TM, Osterhaus ADME, Fouchier RAM (2002. március 30.). „Analysis of the genomic sequence of a human metapneumovirus”. Virology 295 (1), 119–132. o. DOI:10.1006/viro.2001.1355. ISSN 0042-6822. PMID 12033771.
- ↑ a b Perchetti GA, Wilcox N, Chu HY, Katz J, Khatry SK, LeClerq SC, Tielsch JM, Jerome KR, Englund JA, Kuypers J (2020. november 1.). „Human Metapneumovirus Infection and Genotyping of Infants in Rural Nepal”. Journal of the Pediatric Infectious Diseases Society 10 (4), 408–416. o. DOI:10.1093/jpids/piaa118. PMID 33137178.
- ↑ a b c d e f g h i Feuillet F, Lina B, Rosa-Calatrava M, Boivin G (2012. február 1.). „Ten years of human metapneumovirus research”. Journal of Clinical Virology 53 (2), 97–105. o. DOI:10.1016/j.jcv.2011.10.002. PMID 22074934.
- ↑ Cseke G, Maginnis MS, Cox RG, Tollefson SJ, Podsiad AB, Wright DW, Dermody TS, Williams JV (2009). „Integrin v 1 promotes infection by human metapneumovirus”. Proceedings of the National Academy of Sciences 106 (5), 1566–1571. o. DOI:10.1073/pnas.0801433106. PMID 19164533. PMC 2629439.
- ↑ Chang A, Masante C, Buchholz UJ, Dutch RE (2012). „Human Metapneumovirus (HMPV) Binding and Infection Are Mediated by Interactions between the HMPV Fusion Protein and Heparan Sulfate”. Journal of Virology 86 (6), 3230–3243. o. DOI:10.1128/JVI.06706-11. PMID 22238303. PMC 3302303.
- ↑ (2012) „The Human Metapneumovirus Fusion Protein Mediates Entry via an Interaction with RGD-Binding Integrins”. Journal of Virology 86 (22), 12148–12160. o. DOI:10.1128/JVI.01133-12. PMID 22933271. PMC 3486500.
- ↑ (2014) „Roles of the Putative Integrin-Binding Motif of the Human Metapneumovirus Fusion (F) Protein in Cell-Cell Fusion, Viral Infectivity, and Pathogenesis”. Journal of Virology 88 (8), 4338–4352. o. DOI:10.1128/JVI.03491-13. PMID 24478423. PMC 3993731.
- ↑ (2006) „Characterization of Human Metapneumovirus F Protein-Promoted Membrane Fusion: Critical Roles for Proteolytic Processing and Low pH”. Journal of Virology 80 (22), 10931–10941. o. DOI:10.1128/JVI.01287-06. PMID 16971452. PMC 1642150.
- ↑ (2015) „Human Metapneumovirus is Capable of Entering Cells by Fusion with Endosomal Membranes”. PLOS Pathogens 11 (12), e1005303. o. DOI:10.1371/journal.ppat.1005303. PMID 26629703. PMC 4667933.
- ↑ Uddin S, Thomas M. Human Metapneumovirus, StatPearls. StatPearls Publishing (2023. február 6.). Hozzáférés ideje: 2023. november 18.
- ↑ a b c Uddin S, Thomas M (2022. július 18.). „Human Metapneumovirus”. StatPearls [Internet]. PMID 32809745.
- ↑ About Human Metapneumovirus (amerikai angol nyelven). Human Metapneumovirus . CDC, 2024. augusztus 9. (Hozzáférés: 2025. január 7.)
- ↑ Peiris JS, Tang WH, Chan KH, Khong PL, Guan Y, Lau YL, Chiu SS (2003. június 1.). „Children with respiratory disease associated with metapneumovirus in Hong Kong”. Emerging Infectious Diseases 9 (6), 628–633. o. DOI:10.3201/eid0906.030009. PMID 12781000. PMC 3000155.
- ↑ Bao X, Liu T, Shan Y, Li K, Garofalo RP, Casola A (2008. május 1.). „Human Metapneumovirus Glycoprotein G Inhibits Innate Immune Responses”. PLOS Pathog 4 (5), e1000077. o. DOI:10.1371/journal.ppat.1000077. PMID 18516301. PMC 2386556.
- ↑ Deffrasnes C, Hamelin ME, Boivin G (2007. április 1.). „Human metapneumovirus”. Semin Respir Crit Care Med 28 (2), 213–221. o. DOI:10.1055/s-2007-976493. PMID 17458775.
- ↑ NCT03392389 számú (A clinical trial of a Human metapneumovirus (hMPV) vaccine in healthy adults) klinikai kísérlet a ClinicalTrials.gov oldalon
- ↑ (2019-10-02). "Moderna to Present Data from Two of Its Prophylactic mRNA Vaccines at IDWeek 2019". Sajtóközlemény.
- ↑ de Graaf M, Osterhaus AD, Fouchier RA, Holmes EC (2008). „Evolutionary dynamics of human and avian metapneumoviruses”. J. Gen. Virol. 89 (Pt 12), 2933–2942. o. DOI:10.1099/vir.0.2008/006957-0. PMID 19008378.
- ↑ „China steps up monitoring of emerging respiratory diseases: Report”, Hindustan Times, 2025. január 3.
- ↑ „HMPV: China's New Virus Outbreak Explained”, Newsweek, 2025. január 3.
- ↑ Viral disease HMPV is on the rise among kids in China — what is it?. Live Science, 2025. január 3.
- ↑ „HMPV levels remain low in HK amid mainland China outbreak”, Hong Kong Free Press HKFP, 2024. december 30. (Hozzáférés: 2025. január 4.)
- ↑ „Malaysia recorded 327 hMPV cases in 2024, disease not new – Ministry”, NST Online, 2025. január 4. (Hozzáférés: 2025. január 4.) (angol nyelvű)
- ↑ „HMPV in India: Two 3-month-old and 8-month-old babies detected with the virus, confirms government”, The Times of India, 2025. január 6. (Hozzáférés: 2025. január 6.)
- ↑ „Metapneumovirus detected and actively circulates in Kazakhstan - Ministry of Health”, kaztag.kz, 2025. január 5. (Hozzáférés: 2025. január 7.) (angol nyelvű)
Fordítás
[szerkesztés]Ez a szócikk részben vagy egészben a Human metapneumovirus című angol Wikipédia-szócikk ezen változatának fordításán alapul. Az eredeti cikk szerkesztőit annak laptörténete sorolja fel. Ez a jelzés csupán a megfogalmazás eredetét és a szerzői jogokat jelzi, nem szolgál a cikkben szereplő információk forrásmegjelöléseként.
További információk
[szerkesztés]- ICTV Virus Taxonomy Profile: Pneumoviridae (December 2017)
- hMPV EIA kit (Biotrin, archived 13 February 2007)
- Human Metapneumovirus, hMPV (Biotrin, archived 11 September 2007)
- Virus Pathogen Database and Analysis Resource (ViPR): Paramyxoviridae[halott link]

