Halohidrin


A halohidrin (más néven halogénalkohol vagy β-halogénalkohol) szerves kémiai funkciós csoport, amelyben egy halogén és egy hidroxilcsoport szomszédos szénatomokhoz kapcsolódik (β-helyen halogénezett alkohol), és amely szénatomokhoz csak hidrogén vagy szénhidrogéncsoport kapcsolódik (ilyen például a 2-klóretanol vagy a 3-klórpropán-1,2-diol).[1] A kifejezés csak telített csoportokra vonatkozik, a 2-klórfenolt például általában nem tekintik halohidrinnek. Egyes halohidrinekből, például propilén-klórhidrinből évente több millió tonnát gyártanak, ezeket polimerek készítéséhez használják fel.
A halohidrineket a halogénatom minősége szerint lehet csoportosítani, ez alapján vannak klórhidrinek, brómhidrinek, fluorhidrinek és jódhidrinek.
Előállításuk
[szerkesztés]A halohidrineket rendszerint alkén halogénnel történő kezelésével állítják elő, víz jelenlétében.[2] A reakció az elektrofil addíció egyik formája, hasonló a halogén addíciós reakcióhoz, és anti addíción keresztül játszódik le, így a molekulába az X és OH csoportok transz konfigurációban épülnek be. Az etilén etilén-klórhidrinné történő átalakításának egyenlete:
- H2C=CH2 + Cl2 + H2O → H2(OH)C-CH2Cl + HCl
Brómozási reakcióhoz elemi bróm helyett előnyösebb lehet az N-brómszukcinimid (NBS) alkalmazása, így kevesebb melléktermékek keletkezik.

Halohidrineket úgy is elő lehet állítani, hogy epoxidot reagáltatunk hidrogén-halogenid vizes oldatával vagy fém-halogeniddel.[3]
Ezt a reakciót ipari léptékben használják klórhidrin prekurzorok gyártására, melyekből két fontos epoxidot, epiklórhidrint és propilén-oxidot állítanak elő.[4]
Reakciói
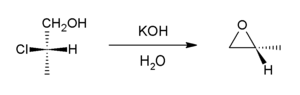
[szerkesztés]Bázis jelenlétében a halohidrin intramolekuláris SN2 reakcióban epoxiddá alakul. Az iparban bázisként kalcium-hidroxidot, laboratóriumi célra többnyire kálium-hidroxidot alkalmaznak.
Ez a reakció az epoxidból történő előállítás fordított reakciója, és a Williamson-féle éterszintézis egyik változatának tekinthető. A világ propilén-oxid termelésének nagy részét ezen az úton állítják elő.[5]
Ezek a reakciók bonyolultabb folyamatoknak is alapjául szolgálhatnak, az epoxidképződés például a Darzens-reakció egyik kulcslépése.
Halogénezett halohidrinek
[szerkesztés]
Bár szigorúan véve nem felelnek meg a IUPAC definíciónak, de hasonló kémiai tulajdonságaik miatt azon vegyületeket is halohidrineknek lehet tekinteni, amelyekben a hidroxilcsoporttal szomszédos szénatomon több geminális halogén is található – ilyen például a 2,2,2-triklóretanol. Ezek a vegyületek is képesek intramolekuláris gyűrűzáródásra, ekkor dihalogénepoxicsoport keletkezik. Ezek rendkívül reakcióképes anyagok, és szintetikus szempontból is fontosak, amit a Jocic-Reeve-, a Bargellini- és a Corey–Link-reakció során alkalmaznak.[6]
Toxicitásuk
[szerkesztés]Az egyszerű, kis molekulatömegű vegyületek általában mérgezőek és – mivel alkilezőszerek – karcinogének (pl. a 2-klóretanol, 3-MCPD). Ez a reakciókészség jó célra is felhasználható, erre példa a mitobronitol rákellenes szer. Számos szintetikus kortikoszteroidban található fluorhidrin rész (triamcinolon, dexametazon).
Helytelen elnevezések
[szerkesztés]Bár az epiklórhidrin név ezt sugallja, ez a vegyület valójában nem tartozik a halohidrinek közé.
Hivatkozások
[szerkesztés]- ↑ IUPAC, Compendium of Chemical Terminology, 2nd ed. (the "Gold Book") (1997). Online corrected version: (2006–) "halohydrins". [2019. december 24-i dátummal az eredetiből archiválva]. (Hozzáférés: 2018. szeptember 16.).
- ↑ William Reusch: Addition Reactions of Alkenes. Virtual Textbook of Organic Chemistry. [2012. december 14-i dátummal az eredetiből archiválva].
- ↑ Bonini, Carlo (1994. január 16.). „Regio- and Chemoselective Synthesis of Halohydrins by Cleavage of Oxiranes with Metal Halides”. Synthesis 1994 (03), 225–238. o. DOI:10.1055/s-1994-25445.
- ↑ Gordon Y. T. Liu, W. Frank Richey, Joanne E. Betso, Brian Hughes, Joanna Klapacz and Joerg Lindner "Chlorohydrins" in Ullmann's Encyclopedia of Industrial Chemistry, 2014 by Wiley-VCH, Weinheim. doi:10.1002/14356007.a06_565.pub2
- ↑ Dietmar Kahlich, Uwe Wiechern, Jörg Lindner “Propylene Oxide” in Ullmann's Encyclopedia of Industrial Chemistry, 2002 by Wiley-VCH, Weinheim. doi:10.1002/14356007.a22_239 Article Online Posting Date: June 15, 2000
- ↑ Snowden, T.S. (2012. február 28.). „Recent applications of gem-dichloroepoxide intermediates in synthesis”. Arkivoc 2012 (2), 24–40. o. DOI:10.3998/ark.5550190.0013.204.
Fordítás
[szerkesztés]Ez a szócikk részben vagy egészben a Halohydrin című angol Wikipédia-szócikk ezen változatának fordításán alapul. Az eredeti cikk szerkesztőit annak laptörténete sorolja fel. Ez a jelzés csupán a megfogalmazás eredetét és a szerzői jogokat jelzi, nem szolgál a cikkben szereplő információk forrásmegjelöléseként.