1,2-Diklóretán
| 1,2-diklóretán | |||
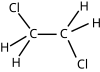 1,2-diklóretán |
 1,2-diklóretán | ||
| IUPAC-név | 1,2-diklóretán | ||
| Más nevek | etilén-diklorid 1,2-DCA DCE[1] etán-diklorid Freon 150 | ||
| Kémiai azonosítók | |||
|---|---|---|---|
| CAS-szám | 107-06-2 | ||
| PubChem | 11 | ||
| ChemSpider | 13837650 | ||
| KEGG | C06752 | ||
| ChEBI | 27789 | ||
| RTECS szám | KI0525000 | ||
| |||
| InChIKey | WSLDOOZREJYCGB-UHFFFAOYSA-N | ||
| UNII | 55163IJI47 | ||
| ChEMBL | 16370 | ||
| Kémiai és fizikai tulajdonságok | |||
| Kémiai képlet | C2H4Cl2 | ||
| Moláris tömeg | 98,96 g/mol | ||
| Megjelenés | színtelen folyadék | ||
| Szag | jellegzetes, kellemes, kloroformra hasonlító szagú[2] | ||
| Sűrűség | 1,253 g/cm³, folyadék | ||
| Olvadáspont | −35 °C | ||
| Forráspont | 84 °C | ||
| Oldhatóság (vízben) | 0,87 g/100 ml (20 °C) | ||
| Viszkozitás | 0,84 mPa·s 20 °C-on | ||
| Kristályszerkezet | |||
| Dipólusmomentum | 1,80 D | ||
| Veszélyek | |||
| Főbb veszélyek | mérgező, gyúlékony, karcinogén | ||
| NFPA 704 | |||
| R mondatok | R11 R45 R36/37/38 | ||
| S mondatok | S45 S53 | ||
| Robbanási határ | 6,2%-16%[2] | ||
| PEL | TWA 50 ppm C 100 ppm 200 ppm [5 perces csúcs bármely 3 órában][2] | ||
| Ha másként nem jelöljük, az adatok az anyag standardállapotára (100 kPa) és 25 °C-os hőmérsékletre vonatkoznak. | |||
Az 1,2-diklóretán, más néven etilén-diklorid a klórozott szénhidrogének közé tartozó szerves vegyület. Színtelen, kloroforméra emlékeztető szagú folyadék. Fő felhasználása a vinil-klorid előállítása, melyből aztán polivinil-klorid (PVC) csöveket, bútorokat, autókárpitokat, tapétát, háztartási cikkeket és járműalkatrészeket gyártanak.[4] Felhasználják továbbá más szerves vegyületek szintéziséhez és oldószerként is. Számos más oldószerrel, köztük a vízzel és más klórozott szerves vegyületekkel is azeotrópos elegyet képez (vizes azeotrópjának forráspontja 70,5 °C).[5]
Előállítása
[szerkesztés]Közel 20 millió tonnát gyártanak az Egyesült Államokban, Nyugat-Európában és Japánban.[6] Fő előállítási módja etén (etilén) és klór vas(III)-klorid katalizátor mellett végzett reakciója.
- H2C=CH2 + Cl2 → ClCH2−CH2Cl
Előállítható az etilén réz(II)-klorid által katalizált oxiklórozásával is:
- 2 H2C=CH2 + 4 HCl + O2 → 2 ClCH2−CH2Cl + 2 H2O
Felhasználása
[szerkesztés]Vinil-klorid monomer (VCM) gyártása
[szerkesztés]A világ 1,2-diklóretán-termelésének mintegy 95%-át vinil-klorid monomer előállításához használják fel, a reakció melléktermékeként hidrogén-klorid keletkezik. A VCM a polivinil-klorid gyártásának kiindulási anyaga.
- Cl−CH2−CH2−Cl → H2C=CH−Cl + HCl
A hidrogén-klorid – a fentebb leírt oxiklórozási reakcióval – újrahasznosítható további 1,2-diklóretán gyártásához.[7]
Egyéb alkalmazásai
[szerkesztés]Mivel jó poláris aprotikus oldószer, zsír- és festékoldóként alkalmazták, de ma mérgező és feltehetően karcinogén volta miatt ma már ezen felhasználását tiltják. Különböző szerves vegyületek, például etilén-diamin szintéziséhez is felhasználják mint „építőelemet”. Laboratóriumban esetenként klór forrásaként is használják, etén és klorid eliminációjával.
Az 1,1,1-triklóretán többlépéses előállításának kiindulási anyaga, ezt az anyagot száraztisztításhoz használják. Korábban az 1,2-diklóretánt ólmozott üzemanyagok kopogásgátló adalékaként használták, hogy megakadályozza az ólom felhalmozódását a hengerekben és a szelepeken.[8]
Hivatkozások
[szerkesztés]- ↑ Staff writer: Standard Abbreviations and Acronyms. The Journal of Organic Chemistry . „DCE: 1,2-dichloroethane”
- ↑ a b c d e NIOSH Pocket Guide to Chemical Hazards #0271. National Institute for Occupational Safety and Health (NIOSH)
- ↑ a b Ethylene dichloride. Immediately Dangerous to Life and Health Concentrations (IDLH). National Institute for Occupational Safety and Health (NIOSH)
- ↑ ATSDR - Toxic Substances - 1,2-Dichloroethane. www.atsdr.cdc.gov . (Hozzáférés: 2015. szeptember 23.)
- ↑ Manfred Rossberg, Wilhelm Lendle, Gerhard Pfleiderer, Adolf Tögel, Eberhard-Ludwig Dreher, Ernst Langer, Heinz Rassaerts, Peter Kleinschmidt, Heinz Strack, Richard Cook, Uwe Beck, Karl-August Lipper, Theodore R. Torkelson, Eckhard Löser, Klaus K. Beutel, Trevor Mann "Chlorinated Hydrocarbons" in Ullmann's Encyclopedia of Industrial Chemistry 2006, Wiley-VCH, Weinheim. doi:10.1002/14356007.a06_233.pub2
- ↑ J.A. Field (2004). „Biodegradability of chlorinated solvents and related chlorinated aliphatic compounds”. Rev. Environ. Sci. Biotechnol. 3 (3), 185–254. o. DOI:10.1007/s11157-004-4733-8.
- ↑ Ethylene Dichloride - Chemical Economics Handbook (CEH) - IHS Markit. www.ihs.com . (Hozzáférés: 2018. április 8.)
- ↑ Seyferth, D. (2003). „The Rise and Fall of Tetraethyllead. 2”. Organometallics 22 (25), 5154–5178. o. DOI:10.1021/om030621b.
Fordítás
[szerkesztés]Ez a szócikk részben vagy egészben a(z) 1,2-Dichloroethane című angol Wikipédia-szócikk ezen változatának fordításán alapul. Az eredeti cikk szerkesztőit annak laptörténete sorolja fel. Ez a jelzés csupán a megfogalmazás eredetét és a szerzői jogokat jelzi, nem szolgál a cikkben szereplő információk forrásmegjelöléseként.

