Dioxigenil
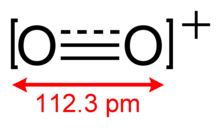
A dioxigenilion egy ritkán előforduló oxokation, melyben a két oxigénatom oxidációs száma +1/2. A pozitív töltés egyenletesen oszlik meg a két oxigénatom között. Képlete O+2. Oxigénmolekulából keletkezik egy elektron elszakadásával:
- O2 →O+2 + e−
Ennek a folyamatnak az energiaigénye – az oxigénmolekula első ionizációs energiája – nagyon magas: 1175 kJ/mol. Emiatt a keletkező O+2 nagyon reaktív részecske, erős oxidálószer.[1]
Szerkezete
[szerkesztés]Az O+2-ben a kötésrend 2,5, a kötés hossza 112,3 pm. Vegyértékelektronjainak száma megegyezik a nitrogén-monoxidéval. Kötési energiája 625,1 kJ·mol−1, nyújtórezgése 1858 cm−1-es hullámszámnál jelentkezik,[2] a molekulák többségéhez képest ezek magas értékek.
Előállítása
[szerkesztés]Oxigén és platina-hexafluorid egyesülésével dioxigenil-hexafluoroplatinát keletkezik:
- O2 + PtF6 → O+2[PtF6]−
A platina-hexafluorid egyike azon ritka oxidálószereknek, amelyek oxidálják az oxigént.
A dioxigenil-hexafluoroplatinát kulcsszerepet játszott a nemesgázvegyületek felfedezésében. Miután Neil Bartlett rájött, hogy a platina-hexafluorid oxidálja az oxigéngázt, elkezdte vizsgálni, hogy a platina-hexafluorid reakcióba lép-e a nemesgázokkal, és ekkor fedezte fel a xenon-hexafluoroplatinátot.
Az O+2 megtalálható más hasonló, O2XF6 általános összegképletű vegyületekben, ahol az X lehet: arzén,[3] arany,[4] nióbium, ruténium, rénium, ródium, vanádium,[5] foszfor.[6] További dioxigenilt tartalmazó vegyületek is ismertek, például a O2GeF5 és (O2)2SnF6.
A tetrafluoroborát és a hexafluorofoszfát sói úgy állíthatók elő, hogy −126 °C-on bór-trifluoridot vagy foszfor-pentafluoridot reagáltatnak dioxigén-difluoriddal:[6]
- 2 O2F2 + 2 BF3 → 2 O2BF4 + F2
- 2 O2F2 + 2 PF5 → 2 O2PF6 + F2
Ezek a vegyületek gyorsan elbomlanak szobahőmérsékleten:
- 2 O2BF4 → 2 O2 + F2 + 2 BF3
- 2 O2PF6 → 2 O2 + F2 + 2 PF5
Reakciói
[szerkesztés]Az O2BF4 és xenon −100 °C-on történő reakciójában fehér szilárd anyag keletkezik, ennek összetételét F−Xe−BF2-nak tartják, melyben igen ritka Xe−B kötés található:[7]
- 2 O2BF4 + 2 Xe → 2 O2 + F2 + 2 FXeBF2
A O2BF4 és O2AsF6 dioxigenil sók szén-monoxiddal oxalil-fluorid F–(C=O)–(C=O)–F képződése közben reagálnak, a reakció kitermelése magas.[8]
Fordítás
[szerkesztés]Ez a szócikk részben vagy egészben a Dioxygenyl című angol Wikipédia-szócikk ezen változatának fordításán alapul. Az eredeti cikk szerkesztőit annak laptörténete sorolja fel. Ez a jelzés csupán a megfogalmazás eredetét és a szerzői jogokat jelzi, nem szolgál a cikkben szereplő információk forrásmegjelöléseként.
Források
[szerkesztés]- ↑ Active oxygen in chemistry, Joel F. Liebman, A. Greenberg, Springer (1995). ISBN 0-412-03441-7
- ↑ J. Shamir, J. Binenboym, H. H. Claassen (1968). „The vibrational frequency of the O+2 cation”. J. Am. Chem. Soc. 90 (22), 6223−6224. o. DOI:10.1021/ja01024a054.
- ↑ A. R. Young, T. Hirata, S. I. Morrow (1964). „The Preparation of Dioxygenyl Salts from Dioxygen Difluoride”. J. Am. Chem. Soc. 86 (1), 20−22. o. DOI:10.1021/ja01055a006.
- ↑ Fluorine-carbon and fluoride-carbon materials: chemistry, physics, and applications. CRC Press (1995). ISBN 0-8247-9286-6
- ↑ Inorganic chemistry. Academic Press, 475. o. (2001). ISBN 0-12-352651-5
- ↑ a b (1964) „New Dioxygenyl Compounds”. Inorganic Chemistry 3 (3), 457. o. DOI:10.1021/ic50013a036.
- ↑ (1972) „Reaction of xenon with dioxygenyl tetrafluoroborate. Preparation of FXe-BF2”. Journal of the American Chemical Society 94 (9), 3018–3021. o. DOI:10.1021/ja00764a022.
- ↑ (2001) „The reaction of dioxygenyl salts with 13CO Formation of F13C(O)13C(O)F”. Journal of Fluorine Chemistry 112 (2), 277–590. o. DOI:10.1016/S0022-1139(01)00512-7.
