Aminogyök
| Aminogyök | |||
 |

| ||
| IUPAC-név | aminogyök | ||
| Szabályos név | Azanil[1] (szubsztitutív), dihidridonitrogén(•)[1] (additív) | ||
| Más nevek | Amidogén, aminilgyök, azanilgyök | ||
| Kémiai azonosítók | |||
|---|---|---|---|
| CAS-szám | 13770-40-6 | ||
| PubChem | 123329 | ||
| ChemSpider | 109932 | ||
| ChEBI | 29318 | ||
| |||
| InChIKey | MDFFNEOEWAXZRQ-UHFFFAOYSA-N | ||
| Kémiai és fizikai tulajdonságok | |||
| Kémiai képlet | H2N | ||
| Moláris tömeg | 16,0226 g mol−1 | ||
| Termokémia | |||
| Std. képződési entalpia ΔfH |
190,37 kJ mol−1 | ||
| Standard moláris entrópia S |
194,71 J K−1 mol−1 | ||
| Ha másként nem jelöljük, az adatok az anyag standardállapotára (100 kPa) és 25 °C-os hőmérsékletre vonatkoznak. | |||
Az aminogyök (·NH2), más néven aminilgyök vagy azanilgyök az amidion (NH−2) semleges változata. Az aminilgyökök erősen reakcióképesek, így – a legtöbb gyökhöz hasonlóan – rövid életűek, azonban fontosak a nitrogénkémia megértésében. Elég nagy koncentrációban az aminogyökök hidrazinná dimerizálódnak. Bár az NH2 funkciós csoport a természetben gyakori sok vegyület, például a fenetilaminok részeként, a gyök nem izolálható szabadon.[2]
Szintézis
[szerkesztés]Ammóniából
[szerkesztés]Az aminogyök előállítható hidroxilgyök ammóniával való reakciójával besugárzott vizes oldatokban. Ez a reakció hidrogénelvonási reakcióként írható le:[3]
A reakciósebességi együtthatóra impulzusradiolízissel mért érték , ezzel szemben az OH hasonló reakciója NH+4-nal sokkal lassabb. k1 értéket később kompetitív kétimpulzus-radiolízissel újra meghatározták benzoát- és tiocianátionokkal 11,4-es pH-n, mindkét esetben értéket kaptak. Savas közegben a hidroxilgyök ammóniumionnal az impulzusradiolízises észleléshez túl lassan reagál.[3]
Hidroxilaminból
[szerkesztés]Aminogyököt adhat szolvatált elektron (e−(aq)) és hidroxilamin (H2NOH) reakciója is. Több tanulmányban is ESR-spektroszkópiás, illetve polarográfiás módszerrel vizsgálták a Ti(III)/H2NOH rendszert.[3]
Ammóniumilból
[szerkesztés]A feltételezések szerint hidroxilamin és szolvatált elektronnal reakciójában is keletkezhet aminogyök. Ugyanakkor az alábbi egyensúly miatt:
az aminogyök reakcióképessége feltehetően pH-függő, a fenti változás 3-7-es pH között mehet végbe.[3]
Tulajdonságok
[szerkesztés]Elektronállapotok
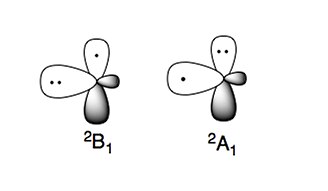
[szerkesztés]Az aminogyöknek két jellemző elektronállapota van:
A stabilabb elektronállapot a 2B1, amelyben a párosítatlan elektron a molekulasíkra merőleges p-pályán található (π-típusú gyök). A magasabb energiaszintű 2A1 állapotban két elektron a p-pályán, a párosítatlan elektron pedig sp2 pályán található (σ-típusú gyök).[4][5]
A központi atomként nitrogént tartalmazó vegyületek, például az aminok nukleofilok. Az aminogyökökben is megjelenik e jellemző, így ezek is nukleofilnak tekinthetők.[4][5]
Spektrumtulajdonságok
[szerkesztés]Az aminogyök csak nagyon kis mértékben nyel el látható fényt , míg az UV-tartományban (<260 nm) a OH-hoz hasonló az elnyelése. Ezért az aminogyök bomlásának követésével való reakciósebesség-meghatározás nem kivihető a gyakorlatban.
Reakciók
[szerkesztés]Az aminogyökök általában erősen reakcióképesek és élettartamuk rövid, azonban néhány szerves vegyülettel való reakcióban ez nincs így. Számos szerves vegyülettel megmérték az aminogyök relatív reakcióképességét, de a sebességi együtthatók abszolút értéke egyelőre nem ismert. Az ammóniából történő keletkezésben feltételezték, hogy az aminogyök gyorsabban reagál ammóniával, mint az OH, és talán savas oldatokban az ammóniumiont is aminogyökké oxidálhatja, feltéve, hogy a gyökök az OH-nál erősebb oxidálószerek. Ennek ellenőrzésére szulfát- és foszfátgyökanionokat használtak: a kapott eredmények alapján ezek lassabban reagáltak ammóniával, mint az aminogyök, elektrontranszfer helyett hidrogénelvonással oxidálják azt.[3]
Ha az aminogyök benzoáttal reagál, a sebességi állandó nagyon kicsi, és csak gyenge UV-elnyelés figyelhető meg – ez összhangban van más, korábbi eredményekkel, hogy az aminogyök nem reagál gyorsan a benzollal. Ezzel szemben a fenol gyorsabban reagál az aminogyökkel. 11,3-es és 12-es pH-n végzett kísérletekben 1,5 M koncentrációjú NH3 és 4-10 mM közti koncentrációjú fenololdatok mellett fenoxilgyök keletkezését figyelték meg sebességgel. Kétféle mechanizmust javasolnak: gyűrűre történő addíció, majd azt követő ammóniaelimináció, illetve közvetlen elektrontranszferes oxidáció.[3]

Míg az aminogyökök kevéssé reaktívak, hidrazinná történő dimerizációjuk az egyik leggyorsabb folyamat, így ez gyakran verseng más NH2-reakciókkal:
Kis nyomáson ez a leggyorsabb reakció, és így az elsődleges módja az NH2 eltűnésének.[6]
Jegyzetek
[szerkesztés]- ↑ a b aminyl (CHEBI:29318). Chemical Entities of Biological Interest (ChEBI). European Bioinformatics Institute
- ↑ die.net: Amidogen. [2013. február 21-i dátummal az eredetiből archiválva]. (Hozzáférés: 2012. május 16.)
- ↑ a b c d e f g Neta, P. (1978). „Formation and reactivity of the amino radical”. The Journal of Physical Chemistry 82 (17), 1875–1878. o. DOI:10.1021/j100506a004. ISSN 0022-3654.
- ↑ a b Amino Radical. NIST Chemistry WebBook. National Institute of Science and Technology, 2017. (Hozzáférés: 2018. június 15.)
- ↑ a b (1974) „Electronic configurations of amido radicals”. Journal of the American Chemical Society 96 (14), 4573–4577. o. DOI:10.1021/ja00821a036. ISSN 0002-7863.
- ↑ (1977. január 16.) „Pressure and temperature dependence of amino radical recombination rate constant”. The Journal of Physical Chemistry 81 (3), 210–214. o. DOI:10.1021/j100518a006.
Fordítás
[szerkesztés]Ez a szócikk részben vagy egészben az Amino radical című angol Wikipédia-szócikk ezen változatának fordításán alapul. Az eredeti cikk szerkesztőit annak laptörténete sorolja fel. Ez a jelzés csupán a megfogalmazás eredetét és a szerzői jogokat jelzi, nem szolgál a cikkben szereplő információk forrásmegjelöléseként.
Források
[szerkesztés]- Davies, P (2008. január 16.). „Detection of the amino radical NH2 by laser magnetic resonance spectroscopy”. The Journal of Chemical Physics 62 (9), 3739. o. DOI:10.1063/1.430970.
- Buttner, T (2005. január 16.). „A stable aminyl radical metal complex”. Science 307 (5707), 235–8. o. DOI:10.1126/science.1106070. PMID 15653498.
- John, Seely (1977. január 16.). „Temperature and Pressure Dependence of the Rate Constant for the HO2 + NO Reaction”. The Journal of Physical Chemistry 81 (10), 210–214. o. DOI:10.1021/jp952553f.
- Koenig, Hoobler (1974). „Electronic configurations of amino radicals”. Journal of the American Chemical Society 96 (14), 4573–4577. o. DOI:10.1021/ja00821a036.