Uroporfirinogén III-dekarboxiláz
| Uroporfirinogén III-dekarboxiláz | |
| Azonosítók | |
| Jel | UROD, PCT, UPD |
| Entrez | 7389 |
| OMIM | 613521 |
| RefSeq | NM_000374 |
| UniProt | P06132 |
| PDB | 1URO |
| Egyéb adatok | |
| Lokusz | 1. krom. p34.1 |
Az uroporfirinogén III-dekarboxiláz (uroporfirinogén-dekarboxiláz, UROD, EC 4.1.1.37) az UROD gén által kódolt enzim.[1]
Gén
[szerkesztés]A humán UROD gén az 1. kromoszómán található, az első exon elejétől az utolsó végéig 3430 bázispár hosszú. Az így létrejövő mRNS 1300 bázis hosszú, és transzláció és poszttranszlációs módosulás után 367 aminosavból álló enzim jön létre. [2]
Funkció
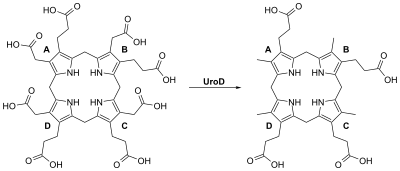
[szerkesztés]Az uroporfirinogén III-dekarboxiláz a hembioszintézis 5. lépését, az uroporfirinogén III acetátcsoportjain lévő karboxilcsoportok eltávolítását katalizáló homodimer enzim (PDB: 1URO):
- uroporfirinogén III ⇌ koproporfirinogén III + 4 CO2
Klinikai jelentőség
[szerkesztés]Az enzim mutációi és hiánya familiális porphyria cutanea tarda és hepatoeritropoetikus porphyria okai.[1] Legalább 65 betegségokozó mutációja ismert.[3]
Mechanizmus
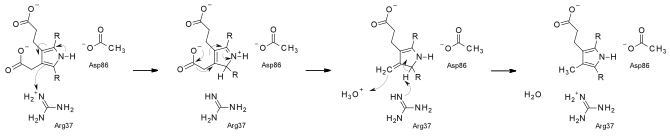
[szerkesztés]Alacsony szubsztrátkoncentráció esetén a reakció feltehetően rendezett – a CO2 a D, A, B és C gyűrűkről egymás után kerül le –, nagyobb koncentráció esetén véletlenszerűen történhet. Az enzim oldatban dimerként működik, és mind az ember, mind a dohány enzimjeit kristályosították és vizsgálták oldatban.
Az UroD a legtöbb dekarboxilázzal ellentétben nem használ kofaktort. A reakció feltehetően arginin általi szubsztrátprotonációval történik.[4] Egy 2008-as tanulmány szerint a katalizálatlan sebessége 10−19 s−1, így 10-es pH-n az UroD katalitikus aránya (a katalizálatlan sebességhez képest való sebességnövekedése) a legnagyobb az ismert enzimek közt – 6·1024 M-1.[5]

Jegyzetek
[szerkesztés]- ↑ a b Entrez Gene: UROD uroporphyrinogen decarboxylase
- ↑ Ensembl-bejegyzés az UROD génhez. (Hozzáférés: 2024. február 14.)
- ↑ Šimčíková D, Heneberg P (2019. december 1.). „Refinement of evolutionary medicine predictions based on clinical evidence for the manifestations of Mendelian diseases”. Scientific Reports 9 (1), 18577. o. DOI:10.1038/s41598-019-54976-4. PMID 31819097. PMC 6901466.
- ↑ Silva PJ, Ramos MJ (2005). „Density-functional study of mechanisms for the cofactor-free decarboxylation performed by uroporphyrinogen III decarboxylase”. J Phys Chem B 109 (38), 18195–200. o. DOI:10.1021/jp051792s. PMID 16853337.
- ↑ Lewis CA, Wolfenden R (2008. november 1.). „Uroporphyrinogen decarboxylation as a benchmark for the catalytic proficiency of enzymes”. Proc. Natl. Acad. Sci. U.S.A. 105 (45), 17328–33. o. DOI:10.1073/pnas.0809838105. PMID 18988736. PMC 2582308.
Fordítás
[szerkesztés]- Ez a szócikk részben vagy egészben az Uroporphyrinogen III decarboxylase című angol Wikipédia-szócikk ezen változatának fordításán alapul. Az eredeti cikk szerkesztőit annak laptörténete sorolja fel. Ez a jelzés csupán a megfogalmazás eredetét és a szerzői jogokat jelzi, nem szolgál a cikkben szereplő információk forrásmegjelöléseként.
- Ez a szócikk részben vagy egészben az Uroporphyrinogen-Decarboxylase című német Wikipédia-szócikk ezen változatának fordításán alapul. Az eredeti cikk szerkesztőit annak laptörténete sorolja fel. Ez a jelzés csupán a megfogalmazás eredetét és a szerzői jogokat jelzi, nem szolgál a cikkben szereplő információk forrásmegjelöléseként.
További információk
[szerkesztés]- Elder GH, Lee GB, Tovey JA (1978). „Decreased activity of hepatic uroporphyrinogen decarboxylase in sporadic porphyria cutanea tarda.”. N. Engl. J. Med. 299 (6), 274–8. o. DOI:10.1056/NEJM197808102990603. PMID 661926.
- de Verneuil H, Bourgeois F, de Rooij F, etal (1992). „Characterization of a new mutation (R292G) and a deletion at the human uroporphyrinogen decarboxylase locus in two patients with hepatoerythropoietic porphyria.”. Hum. Genet. 89 (5), 548–52. o. DOI:10.1007/bf00219182. PMID 1634232.
- Romana M, Grandchamp B, Dubart A, etal (1991). „Identification of a new mutation responsible for hepatoerythropoietic porphyria.”. Eur. J. Clin. Invest. 21 (2), 225–9. o. DOI:10.1111/j.1365-2362.1991.tb01814.x. PMID 1905636.
- Garey JR, Harrison LM, Franklin KF, etal (1990). „Uroporphyrinogen decarboxylase: a splice site mutation causes the deletion of exon 6 in multiple families with porphyria cutanea tarda.”. J. Clin. Invest. 86 (5), 1416–22. o. DOI:10.1172/JCI114856. PMID 2243121. PMC 296884.
- Garey JR, Hansen JL, Harrison LM, etal (1989). „A point mutation in the coding region of uroporphyrinogen decarboxylase associated with familial porphyria cutanea tarda.”. Blood 73 (4), 892–5. o. DOI:10.1182/blood.V73.4.892.892. PMID 2920211.
- Roméo PH, Raich N, Dubart A, etal (1986). „Molecular cloning and nucleotide sequence of a complete human uroporphyrinogen decarboxylase cDNA.”. J. Biol. Chem. 261 (21), 9825–31. o. DOI:10.1016/S0021-9258(18)67589-1. PMID 3015909.
- Dubart A, Mattei MG, Raich N, etal (1986). „Assignment of human uroporphyrinogen decarboxylase (URO-D) to the p34 band of chromosome 1.”. Hum. Genet. 73 (3), 277–9. o. DOI:10.1007/BF00401245. PMID 3460962.
- Romana M, Dubart A, Beaupain D, etal (1987). „Structure of the gene for human uroporphyrinogen decarboxylase.”. Nucleic Acids Res. 15 (18), 7343–56. o. DOI:10.1093/nar/15.18.7343. PMID 3658695. PMC 306252.
- de Verneuil H, Grandchamp B, Beaumont C, etal (1986). „Uroporphyrinogen decarboxylase structural mutant (Gly281----Glu) in a case of porphyria.”. Science 234 (4777), 732–4. o. DOI:10.1126/science.3775362. PMID 3775362.
- Roberts AG, Elder GH, De Salamanca RE, etal (1995). „A mutation (G281E) of the human uroporphyrinogen decarboxylase gene causes both hepatoerythropoietic porphyria and overt familial porphyria cutanea tarda: biochemical and genetic studies on Spanish patients.”. J. Invest. Dermatol. 104 (4), 500–2. o. DOI:10.1111/1523-1747.ep12605953. PMID 7706766.
- Maruyama K, Sugano S (1994). „Oligo-capping: a simple method to replace the cap structure of eukaryotic mRNAs with oligoribonucleotides.”. Gene 138 (1–2), 171–4. o. DOI:10.1016/0378-1119(94)90802-8. PMID 8125298.
- Meguro K, Fujita H, Ishida N, etal (1994). „Molecular defects of uroporphyrinogen decarboxylase in a patient with mild hepatoerythropoietic porphyria”. J. Invest. Dermatol. 102 (5), 681–5. o. DOI:10.1111/1523-1747.ep12374134. PMID 8176248.
- Moran-Jimenez MJ, Ged C, Romana M, etal (1996). „Uroporphyrinogen decarboxylase: complete human gene sequence and molecular study of three families with hepatoerythropoietic porphyria”. Am. J. Hum. Genet. 58 (4), 712–21. o. PMID 8644733. PMC 1914669.
- McManus JF, Begley CG, Sassa S, Ratnaike S (1996). „Five new mutations in the uroporphyrinogen decarboxylase gene identified in families with cutaneous porphyria”. Blood 88 (9), 3589–600. o. DOI:10.1182/blood.V88.9.3589.bloodjournal8893589. PMID 8896428.
- Suzuki Y, Yoshitomo-Nakagawa K, Maruyama K, etal (1997). „Construction and characterization of a full length-enriched and a 5'-end-enriched cDNA library”. Gene 200 (1–2), 149–56. o. DOI:10.1016/S0378-1119(97)00411-3. PMID 9373149.
- Whitby FG, Phillips JD, Kushner JP, Hill CP (1998). „Crystal structure of human uroporphyrinogen decarboxylase”. EMBO J. 17 (9), 2463–71. o. DOI:10.1093/emboj/17.9.2463. PMID 9564029. PMC 1170588.
- Mendez M, Sorkin L, Rossetti MV, etal (1998). „Familial porphyria cutanea tarda: characterization of seven novel uroporphyrinogen decarboxylase mutations and frequency of common hemochromatosis alleles”. Am. J. Hum. Genet. 63 (5), 1363–75. o. DOI:10.1086/302119. PMID 9792863. PMC 1377546.
- Wang H, Long Q, Marty SD, etal (1998). „A zebrafish model for hepatoerythropoietic porphyria”. Nat. Genet. 20 (3), 239–43. o. DOI:10.1038/3041. PMID 9806541.
- McManus JF, Begley CG, Sassa S, Ratnaike S (1999). „Three new mutations in the uroporphyrinogen decarboxylase gene in familial porphyria cutanea tarda. Mutation in brief no. 237. Online”. Hum. Mutat. 13 (5), 412–413. o. DOI:<412::AID-HUMU13>3.0.CO;2-N 10.1002/(SICI)1098-1004(1999)13:5<412::AID-HUMU13>3.0.CO;2-N. PMID 10338097.
- Christiansen L, Ged C, Hombrados I, etal (1999). „Screening for mutations in the uroporphyrinogen decarboxylase gene using denaturing gradient gel electrophoresis. Identification and characterization of six novel mutations associated with familial PCT”. Hum. Mutat. 14 (3), 222–32. o. DOI:<222::AID-HUMU5>3.0.CO;2-V 10.1002/(SICI)1098-1004(1999)14:3<222::AID-HUMU5>3.0.CO;2-V. PMID 10477430.
