Szerkesztő:Filipanits/Extracelluláris mátrix
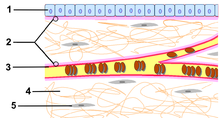
Az extracelluláris mátrix (ECM) a kötőszöveti sejteket körülvevő, fehérjékből és szénhidrátokból felépülő hálózat. A kötőszövet intercelluláris állományaként lényegesen nagyobb térfogatot foglal el a kötőszöveti sejteknél. Kötőszöveti rostokból és kocsonyás természetű, proteoglikánokból és erősen vízkötő alapállományból áll. Jelentős szerepe van a kötőszövet fizikai tulajdonságainak kialakításában, sejt közötti vázat alkot a szöveti sejtek számára; a szövetek és szervek embrionális formálódása, kialakulása során felszínt biztosít a sejtmozgások, átrendeződések számára, de fontos a sejtek élettani működésének szabályozásában is. illetve szerepet játszik a jelátviteli folyamatokban és hatással van a sejtek génexpressziójára is.
Komponensei
[szerkesztés]Az ősszetevőket az ECM sejtes elemei termelik.
Kötőszöveti rostok
[szerkesztés]- Rostszerű fehérjék: kollagén-, rugalmas-, rácsrost és fibrillin.
Kollagén
[szerkesztés]Általános jellemzők
A kollagénrostok változó vastagságú (2-20 µm), jellegzetesen hullámos rostok, a legelterjedtebb és legtömegesebb rosttípusa a kötőszövetnek. Ezek a fehérjék vízben oldhatatlan, fibrilláris proteinek, emberben egy nagy géncsalád tagjai kódolják őket. A kollagénláncok hármasával felcsavarodva tripla-hélix struktúrát alkotnak, a polipeptidláncokat hidroxilált aminosavak (hidroxilizin, hidroxiprolin) között kialakuló hidrogénkötések tartják össze. A lánc minden harmadik aminosava glicin, ez teszi lehetővé hármas hélix fehérjeszerkezet létrejöttét. A glicinek kölcsönzik a kollagénnek a különleges hajlékonyságát. Húzással szemben rendkívül ellenállók, egy négyzetmilliméter átmérőjű rost húzási és szakítási szilárdsága a 6 kg-ot is eléri.

Szintézise
A durva felszínű endoplazmatikus retikulum (DER)felszínén történik. Az itt szintetizált prokollagén fehérje különböző poszttranszlációs módosulásokon esik keresztül (hidroxiláció prolin és lizin oldalláncon; glikoziláció), majd hidroxiláltan a rostok felveszik a tripla-helikális szerkezetet, köztük diszulfidhidak is létesülnek. Transzportvezikulákkal a Golgi-komplexbe jut a prokollagén, befejeződik a glikozilációja és exocitózissal a sejtfelszínre kerül. Itt az N- és C-terminális propeptidek lehasításával tropokollagén egységek képződnek, köztük kovalens keresztkötések alakulnak ki, így összeáll a kollagénrost.
Típusai

A korábban egyetlen fehérjének hitt kollagénről ma már tudjuk, hogy egy kb. 25 tagból álló nagy molekulacsaládot alkot. A létrejövő különböző kollagénmolekula-típusokat római számokkal jelölik. A szervezetünkben megtalálható kollagének több, mint 90%-a I-es típusú.
- Fibrilláris típusú kollagének: I, II, III, V, VI, VII, XI, XVI
- Fibrillumhoz asszociált kollagének: IX, XII, XIV
- Hálózatképző kollagének: IV, VIII, X
Rugalmas rostok
[szerkesztés]Más néven elasztikus rostoknak nevezzük. A kollagénrostoknál vékonyabb, drótszerűen kihúzódó rostok, melyek helyenként villaszerűen elágaznak, majd újra egyesülnek és ezzel rugalmas hálózatokat képeznek. Leginkább ott fordul elő a szervezetben, ahol a szervek jelentős alakváltozásnak vannak kitéve, például a tüdőben, nagy erek falában. Elektronmikroszkópos képen megfigyelhető, hogy egy sűrű, belső amorph állományból és egy finom, fibrilláris szerkezetű széli zónából tevődnek össze. A belső rész tartalmazza az elasztikus rost gumiszerűen rugalmas anyagát, az elasztint, ami egy tropoelasztin nevű monomerből épül fel. A széli fibrilláris allomány fibrillin microfibrillumokból áll.
Rácsrostok
[szerkesztés]A sejtképző szövetek jellegzetes rosttípusa, így a csontvelő, lép, tonsillák, és nyirokcsomók finom támasztókészülékét alkotják, de kis mennyiségben a kötőszövetben mindenütt megtalálhatóak. Lényegében finom kollagénrostoknak tekinthetők, fő komponensük a III-as típusú kollagén. A rácsrostot alkotó kb. 20 nm-es fibrillumok harántcsíkolatot mutatnak. A rostok anyagát a reticulumsejt termeli a reticuláris kötőszövetben, de a fibroblastokon és reticulumsejteken kívül simaizomsejtek és Schwann-sejtek is képesek rácsrost alapanyagot termelni.
Fibrillin
[szerkesztés]Vékony fibrillumok, melyek 8-10 nm vastagságúak. Kb. 350 kDa tömegű glikoprotein. Immuncitokémiával szinte mindenütt kimutatható kötőszövetben, izmokban, szaruhártya Descemet-membránjában, a szem lencsefüggesztő rostjaiban.
Amorph alapállomány
[szerkesztés]Fénymikroszkópban homogén, szerkezet nélküli masszaként látható, innen kapta nevét.
Az ECM jelentős mennyiségben tartalmaz összetett szénhidrátokat. A glükózaminoglikánok (GAG) ismétlődő diszacharid egységekből épülnek fel, amelynek egyik alkotóeleme az N-acetilglukózamin vagy N-acetilgalaktózamin, a másik pedig egy savas cukor. A GAG-ok gyakori oldalláncai a szulfátcsoportok is. Kémiailag erősen hidrofil jellegűek, meghatározzák a mátrix konzisztenciáját.
Proteoglikánok és glükózaminoglikánok
[szerkesztés]- Hyaluronsav (hialuronán): Szabad állapotban létezik, felelős a porcszövet rugalmas teherbírásáért.
- Szindekán: Integráns membránfehérje, lényegében membránba épített proteoglikán.
- Kondroitin-, heparán-, dermatánszulfát: proteoglikánok
- stb.
Az extracelluláris mátrix (ECM) fontos komponensei azok a fehérjék, melyek sejtfelszíni receptorokkal, kollagén rostokkal, proteoglikánokkal egyaránt kapcsolatot létesítenek, ezeket adhéziós gliproteineknek nevezzük.
Adhéziós glikoproteinek
[szerkesztés]- Fibronektin: Két, hosszú láncból felépülő dimer, többféle kötőhellyel az integrin, kollagén, heparin, fibrin számára. A kötőszöveti sejteket köti a kollagén rostokhoz vagy más ECM komponensekhez.
- Laminin: Három peptidláncból épül fel. A multiadhezív fehérjék egyik fontos képviselője, mely a bélhám, a kapillárisfal, a veseglomerulusok lamina basalisanak "ragasztóanyaga".
Integrinek
[szerkesztés]A szövetek organizációjának, integritásának kialakításában játszanak szerepet. Transzmembrán fehérjék, melyek az ECM molekuláit felismerő receptorként működnek. αß heterodimerek, mindkét alegységcsalád több, szövetspecifikus tagból áll, kombinációik több, mint 20-féle integrin dimert eredményeznek. A sejtmembrán külső felszínén mátrixfehérjékkel (kollagén, laminin, fibronektin) kapcsolódnak, a citoszól felől pedig vagy aktinfilamentumok végződnek rajtuk fokális adhéziót alkotva vagy intermedier filamentumokkal hemidezmoszómát képeznek.
Szerepe és feladatai
[szerkesztés]Az extracelluláris mátrix szerkezetéből adódóan számos létfontosságú feladatot lát el, például meghatározó szerepe van a kötőszövet fizikai tulajdonságait illetően. Mechanikai támaszt nyújt a sejteknek, befolyásolja a sejt polaritását, növekedését, differenciálódását, a sejtvándorlást. Biztosítja a szöveteknek a fejlődéshez és kifogástalan működéshez szükséges mikrokörnyezetet. A szöveti megújulás támasza, emellett pedig szabályozó fehérjéket termel és raktároz. Hatással van a sejtek génexpressziójára, illetve a komponensei által megkötött hormonok, növekedési faktorok szignáltranszdukciós hatásait segíti, modulálja. Képződése elengedhetetlen például a megfelelő növekedéshez, de a sebgyógyuláshoz is szükséges. Tanulmányozásával jobban megérthető a dinamikája a tumoroknak és az áttéteknek, mivel az ilyenfajta megbetegedés gyakran az ECM pusztulásával jár.
Felépülése és lebomlása
[szerkesztés]A mátrix minden komponense állandó megújulásban van: szintézisük után bizonyos ideig vannak jelen, majd lebontódnak. A lebontást az ún. metalloproteázok (mátrix-metalloproteáz: MMP) végzik, amelyek nevüket a katalitikus centrumban található Zn-atomról kapták. Általában ez egy peptid által fedve van, így ezek gátolt állapotban vannak és aktiválásukhoz ezt a fedő peptidet el kell távolítani. A metalloproteázok többféle szabályozás alatt állnak, a kontroll lényeges elemei a tissue inhibitor of metalloproteases (TIMP), különböző glikoproteinek, melyek gátolják a metalloproteázokat. A felépülés és lebomlás így egyensúlyban van, de a lebontás képes fiziológiásan fokozódni, ha szükséges (pl.: emlő tejtermelés utáni visszafejlődése, ovulatio, embrionalis fejlődés során). Kóros esetben az egyensúly a lebomlás felé tolódhat, ami degenerációhoz vezet.
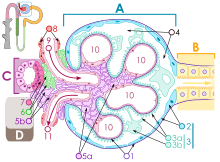
Lamina basalis
[szerkesztés]Hámrétegek, endothel, glia kötőszöveti határán vékony határréteg van, melyet basalis membránnak (alaphártyának) neveztek el. Összekötő elemnek tekinthető az epithelium és a kötőszövet között. Klasszikus szövettani leírások szerint szénhidrátokban gazdag struktúra. A basalis membrán két szerekezeti elemből áll:
- Lamina basalis
- Lamina fibroreticularis
A lamina basalis vékony (40-120 nm vastag) összefüggő réteg, mely a rajta fekvő sejtnek a terméke. További két részre bontható:
- lamina rara: közvetlenül a sejtmembrán mentén üresnek cagy igen laza szerkezetűnek látszó, vékony, folyamatos réteg.
- lamina densa: tömött, filamentaris szerkezetű, egyenletes, folyamatos réteg.
A lamina fibroreticularis főként rácsrostokból (III-as típusú kollagén) álló lapos hálózat, amely a lamina basalishoz illeszkedik hozzá, elemeit kötőszöveti sejtek termelik. Különösebb átmenet nélkül átmegy a kötőszöveti állományba, korábban ezt a réteget hívták basalis membránnak.
Szerkezeti felépítés
[szerkesztés]- Lamina basalis
A lamina densa vázát IV-es típusú kollagén alkotja. A molekulák a felszínnel párhuzamosan halózatos rétegeket alkotnak és szorosan egymásra épülnek. Ebbe az alapszerkezetbe ágyazódnak a lamininmolekulák, egyik végükkel a sejtmembrán lamininreceptorához kapcsolódnak, másik végük a lamina rara állományába ágyazódik bele. A sejthártya és a lamina basalis összekötéséhez hozzájárul még a XVII-es típusú transzmembrán kollagén is. A lamina densa szerkezetét stabilizálják még a nidogén adhéziós molekulák vagy például a lamina basalishoz kötődő proteoglikánok (pl.: perlekán). A lamina rarában húzódnak a lamina densát, a sejtfelszínhez kötő molekuláris részletek (integrinek kinyúló végei, lamininrészletek, szindekán GAG-láncai, XVII-es kollagén)
- Lamina fibroreticularis
A lamina fibroreticularis III-as típusú kollagénrostjait horgonyzó filamentumok (VII-es típusú kollagén) és fibrillin mikrofibrillumok kötik a lamina densához.
Jelentősége
[szerkesztés]- Mechanikai jellegű - a lamina basalis ellenálló, hajlékony struktúra
- Barrier a hám és kötőszövet között
- Sejtbiológiai funkció - jelátviteli folyamatokat indít a sejt belseje felé
- Vezető felületet képez a hámsejtek vándorlásakor a hámregenerációban
- Molekuláris szűrő elsősorban a vese glomerulus-kapillárisaiban
Klinikai jelentőség
[szerkesztés]Az extracelluláris mátrix defektusai különböző betegségekhez vezethetnek. Bizonyos integrinek örökletes defektusa például leukocita-adhéziós deficienciát okoz: a fehérvérsejtek képtelenek a sérülés, gyulladás helyszínére vándorolni és életveszélyes fertőzések léphetnek fel.

Kollagén betegségek
[szerkesztés]- Skorbut
- Ehlers-Danlos-szindróma
- Osteogenesis imperfecta
- Chondrodysplasia

Elasztikus rost betegségek
[szerkesztés]- Marfan-szindróma
- Cutis laxa
Tumoros megbetegedések
[szerkesztés]Daganatsejtekben az integrinek eltűnése baljós jel, mert a sejtek elvesztik kapcsolatukat a mátrixszal, a daganat invazívvá válik és áttétet képez, megnő a metasztatizáló képessége.
Források
[szerkesztés]- Röhlich Pál (szerk.): Szövettan, 4. kiadás,Semmelweis Kiadó és Multimédia Stúdió, Budapest, 2014.
- Szeberényi József: Molekuláris sejtbiológia, 3., átdolg. kiad., Dialóg Campus Kiadó, Budapest-Pécs, 2011.
- Ádám-Dux-Faragó-Fésüs-Machovich-Mandl-Sümegi: Orvosi biokémia, 3. kiadás, Medicina Könyvkiadó Rt., Budapest, 2004.
- David L. Nelson, Michael M. Cox: Lehninger Principles of Biochemistry, 6th ed., W.H. Freeman and Company, 2013.
