Szénkörforgás

A szénkörforgás vagy szénciklus az a biogeokémiai ciklus, amely által a szén, mint kémiai elem kicserélődik a bioszféra, az atmoszféra, a tengerek, a talaj és a litoszféra között. A szén a biológiai eredetű anyagok legfontosabb összetevője, de nagy mennyiségben jelen van egyes kőzetekben (mint a mészkő) is. Működése – a nitrogénkörforgással és a vízkörforgással együtt – kulcsfontosságú a földi élet fennmaradása szempontjából. A körforgásba egyaránt beletartozik a bioszférában gyors tempóban újrahasznosított szén, de annak hosszú távú raktározása a talajban, a kőzetekben vagy az óceánban is. Az ember éves szénkibocsátásának mintegy negyede kerül a hasonló szénraktárakba.
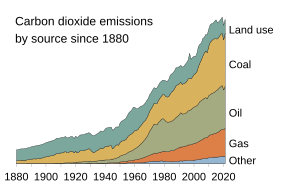
Az emberek a mezőgazdaság terjedésével évezredek óta beleavatkoznak a szénkörforgásba, és az ipari forradalmat követően a fosszilis tüzelőanyagok (kőszén, kőolaj, földgáz) égetésével és a cementgyártással jelentős szénáramlást indítottak el a geoszférából az atmoszférába.[1][2] A szén-dioxid koncentrációja azóta 52%-kal növekedett a légkörben, az üvegházhatás által egyre inkább felmelegítve a Föld felszínét.[3][4] A magas CO2-koncentráció elsavasítja az óceánokat, károsítva a tengeri élővilágot és annak szénmegkötő képességét.[5][6]
Főbb összetevői
[szerkesztés]
A szénkörforgást először Antoine Lavoisier és Joseph Priestley írta le, de Humphry Davy is sokat tett a fogalom megismertetéséért.[7] A globális szénciklus alapvető részei a gyűjtőhelyek (rezervoárok) amelyek között a szén kicserélődhet. A jelentősebb rezervoárok a következők:[8]:5–6
- Az atmoszféra
- A szárazföldi bioszféra
- A világóceán (benne az oldott állapotú szervetlen szénvegyületek és a tengeri élőlények)
- Az üledékek (beleértve a fosszilis tüzelőanyagokat, az édesvízi rendszereket és az élettelen szerves anyagokat)
- A Föld belseje (a földköpeny és a földkéreg)
A rezervoárok között a szén különféle kémiai, fizikai, geológiai és biológiai folyamatok által közlekedik. A legnagyobb aktív szénmennyiség a Föld felszínén az óceánokban található.[9] Az atmoszféra, az óceán, a szárazföldi ökoszisztémák és az üledék közötti szénmozgás nagyjából kiegyensúlyozott és az ember beavatkozása nélkül stabil marad.[3][10]
Az atmoszféra
[szerkesztés]A szén a Föld atmoszférájában elsősorban szén-dioxid és metán formájában van jelen. Mindkettő elnyeli az infravörös sugárzást és visszatartja a hőt, így részben ők felelősek a légkör üvegházhatásáért.[9] A metán hatékonyabb, de jóval kevesebb van belőle, mint a szén-dioxidból és élettartama is rövidebb; így ebből a szempontból a kettő közül a szén-dioxid a jelentősebb.[12]
A szén-dioxidot leginkább a fotoszintetizáló növények vonják ki a levegőből, így kerül a szárazföldi vagy óceáni bioszférába. Ezenkívül közvetlenül is oldódik a vizekben (óceán, tavak stb.), de az esőcseppekben is. Oldott állapotban a vízzel reagálva szénsavat képez, amely csökkenti a víz pH-ját, savasabb lesz tőle. A savas eső a kőzetekbe (pl. mészkő) szivárogva elősegíti azok mállását. Általánosságban savasítja a felszíneket vagy onnan bemosódik az óceánba.[13]
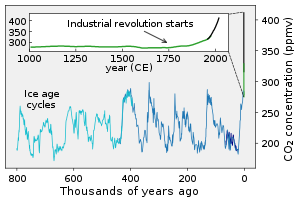
Az utóbbi két évszázadban az emberi tevékenység közel 50%-kal növelte a légkör széntartalmát (2020-as állapot szerint), elsősorban a szén-dioxid koncentrációjának növelése által, amit főleg a fosszilis tüzelőanyagok égetésével, cementgyártással, illetve az ökoszisztémák pusztításával (erdőirtás) ért el.[4][9]
A felszíni kőzetek szilikátos ásványai természetes úton fokozatosan karbonátos kőzetekké alakulnak át, ez az ún. karbonát-szilikát ciklus. Nagyon hosszú távon (több milliárd év múlva) a naptevékenység erősödésével ez az átalakulás, a szilikátok mállása várhatóan fokozódni fog[14] és kivonja az atmoszférából a szén-dioxid többségét.[15][16] Amikor majd a CO2 koncentrációja 50 ppm alá esik, a fotoszintézis lehetetlenné válik majd.[16] Ennek időpontja egyes modellek szerint 600 millió év múlva következik be.[17] Mintegy 1,1 milliárd év múlva az óceánok elpárolognak[14] és a víz súrlódáscsökkentő hatásának hiányában leáll a lemeztektonika. A vulkanikus aktivitás megszűnik és nem kerül több szén-dioxid a légkörbe, amitől a szénciklus teljesen leáll; mindez 1-2 milliárd év múlva várható.[18]
A szárazföldi bioszféra
[szerkesztés]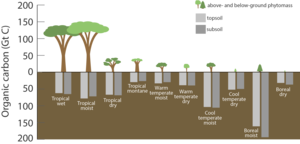
A szárazföldi bioszféra valamennyi itteni élőlény (legyen az élő vagy holt) testében, illetve a talajban lekötött szerves szenet foglalja magába. A növényekben és állatokban összesen kb. 500 gigatonna szén,[3] míg a talajban 1500 gigatonna található.[20] Ez a szén főleg szerves vegyületek formájában van jelen,[21] de nagyjából a harmada szervetlen formában van lekötve, pl. kalcium-karbonátban.[22] A szén az élőlények testének egyik alapvető összetevője. A növények és egyes baktériumok (autotróf szervezetek) kivonják a légkörből a szén-dioxidot és szerves vegyületekké alakítják át, míg az állatok és gombák (heterotrófok) más élőlények lebontása révén jutnak az életfenntartáshoz szükséges szénhez.
Mivel a szén felvétele a növények életműködésétől függ, ezért mértéke napi és éves ciklus szerint változik. Ez a hatás jól megfigyelhető a légkör CO2-tartalmát mutató Keeling-görbén. Mértéke az északi féltekén jóval erősebb, mert a nagyobb szárazföldterület miatt ebben a régióban erősebbek az évszakváltozások hatásai a növények életfunkcióira (télen a mérsékelt övben és északabbra a növények nagy része felfüggeszti a fotoszintézist).

A szén különféle módokon léphet ki a szárazföldi bioszférából. Leggyorsabb módja a szerves anyag direkt elégetése vagy az élőlények sejtlégzése révén; ilyenkor CO2 formájában a légkörbe távozik. A folyók bemoshatják az óceánokba vagy hosszú időre nyugvó állapotba kerülhet a talajban.[23] A talajban tárolt szén akár több ezer évig is ott maradhat, míg az erózió belemossa a folyókba vagy a talajlégzéssel bekerül az atmoszférába. 1989 és 2008 között a hőmérséklet emelkedése miatt a talajlégzés mértéke évente mintegy 0,1%-kal nőtt.[24] 2008-as becslés szerint a talajlégzés által kibocsátott CO2 nagyjából 98 milliárd tonna volt, háromszor annyi, mint amennyi a fosszilis tüzelőanyagok égetése révén kerül a légkörbe (ez nem a nettó anyagforgalmat jelenti, mert közben hasonló mennyiségű szén kötődik meg a talajban). A jelenség pontos magyarázata nem ismert, de egyik oka lehet hogy a magas hőmérséklet miatt fokozódott a talaj szerves anyagainak bomlása. Feltételezhető hogy a klímaváltozás hatására megváltozik a szén talajban való tartózkodásának ideje is.[25]
| Helyszín | Mennyiség (gigatonna) |
|---|---|
| Atmoszféra | 720 |
| Ócean (összes) | 38 400 |
| szervetlen | 37 400 |
| szerves | 1000 |
| felszíni réteg | 670 |
| mélyréteg | 36 730 |
| Litoszféra | |
| Üledékes karbonátkőzet | > 60 000 000 |
| Kerogének | 15 000 000 |
| Szárazföldi bioszféra (összes) | 2000 |
| Élő biomassza | 600 – 1000 |
| Holt biomassza | 1200 |
| Vízi bioszféra | 1 – 2 |
| Fosszilis tüzelőanyagok (összes) | 4130 |
| Kőszén | 3510 |
| Kőolaj | 230 |
| Földgáz | 140 |
| Egyéb (tőzeg) | 250 |
Az óceán
[szerkesztés]Az óceánt ebből a szempontból érdemes felosztani egy felszíni rétegre (amely rendszeresen kapcsolatban áll a légkörrel) és egy mélyrétegre (amely a mintegy száz méternyi keveredési zóna alatt helyezkedik el). Az oldott szervetlen szén a felszíni réteg és a légkör között gyors ütemben cserélődik, fenntartva a kettő közti egyensúlyt. Ennek a rétegnek a szervetlen széntartalma kb. 15%-kal magasabb,[26] de jóval nagyobb térfogata miatt a mélytenger sokkal több szenet foglal magába; itt található a világ legnagyobb aktívan forgatott széntartaléka, amely 50%-szer annyi szenet tartalmaz, mint az egész atmoszféra.[9] A rétegek közötti lassú kicserélődés miatt azonban egy új egyensúlyi állapot beállása több száz évig is eltarthat.[9]
A légkörből az óceánba a szén leginkább a szén-dioxid oldódása révén lép be; ennek egy kis hányada karbonáttá alakul át. Egy másik forrás a folyók által szállított oldott szerves szén. A szervetlen szént az élőlények fotoszintézis útján szerves szénné alakítják át, aminek egy része bennmarad a tengeri táplálékláncban, a többi pedig lesüllyed az üledékbe, ahol halott szövetként fokozatosan lebomlik, vagy a csigaházakba, kagylóhéjakba, algavázakba épülve kalcium-karbonátként kiülepszik. A mélytengeri szén hosszú ideig cirkulálhat míg végül végleg az üledékbe kerül vagy a termohalin körfogás révén visszakerül a felszíni vizekbe.[3] Az óceán összességében enyhén bázikus pH-jú (~pH 8,2), így a CO2-okozta savasodás a semleges felé tolja az egyensúlyt.
A szén-dioxid óceánok általi elnyelése a szénraktározás egyik legfontosabb formája, amely korlátozza az ember által a légkörbe kibocsátott szén hatásait. Azonban az elnyelésnek is megvannak a maga korlátai. A CO2 beoldódásától az óceán savasabbá váli, rontva a tengeri élőlények életkörülményeit. Minél savasabb a víz, annál kevesebb szenet tudnak beépíteni kalcium-karbonát formájában a vázakba és héjakba és ezzel csökken az óceán szén-dioxid elnyelő képessége is.[27][28]
Geoszféra
[szerkesztés]
A szénkörforgás többi részéhez képest a geológiai komponens igen lassan működik. Ennek ellenére ez a légkör széntartalmának egyik fő forrása, így alapvető szerepet játszik a globális éghajlat szabályozásában.[29]
A Föld széntartalmának döntő többségét a litoszféra raktározza.[9] A földköpeny szenének legnagyobb része a bolygó keletkezése óta nem is szabadult ki onnan.[30] Egy másik része a bioszférából került bele üledékként.[31] A biológiai eredetű szén mintegy 80%-át a mészkő és annak származékai rejtik, amelyek a tengeri élőlények kalcium-karbonátból álló mészvázából keletkeznek. A maradék 20%-ot a kerogén alkotja, amely a leülepedő elpusztult élőlények szerves széntartalmából jön létre (ennek egyik formája a kőolaj és a földgáz) a mélyebb kőzetrétegekben uralkodó nagy nyomáson és hőmérsékleten. A geoszférában tárolt szerves szén sok millió éven át ott maradhat.[29]
A szén különféle módokon távozhat a geoszférából. Amikor a karbonátos kőzetek a lemeztektoknika során lesüllyednek a földköpenybe, metamorfózison mennek át és eközben szén-dioxid szabadul fel. Ez a szén-dioxid vulkánok, tektonikus hasadékok és egyéb geológialag aktív helyek révén kerülhet ki az atmoszférába.[30] Ezenkívül az ember közvetlenül is kivonja a kerogéneket (kőolaj, földgáz) a kőzetekből, amiket aztán eléget.
A szén- és vízkörforgás kapcsolódása
[szerkesztés]
A víz körforgása során szén is vándorol a különböző rezervoárok között, ezt mutatja be a jobb oldali ábra.[32]
- A légkörben lévő apró szilárd részecskék kondenzációs magvakként elősegítik a felhőképződést.[33][34]
- A lehulló esőcseppek összegyűjtik az apró részecskéket és a gőzöket/gázokat, bennük pedig a szerves és szervetlen eredetű szenet is.[35][36]
- Az égés és a vulkanikus tevékenység során CO2, valamint magas széntartalmú korom és pernye kerül a levegőbe.[37][38]
- A növények fotoszintézissel megkötik a levegő CO2-ját, ennek azonban egy része sejtlégzésük következtében visszakerül a légkörbe.[39] A lignin és a cellulóz mintegy 80%-át teszi ki az erdő szerves szénkészletének; a réteken ez 60%.[40][41]
- Az elpusztult növények és növényi részek, gyökerek a talajra kerülnek, ahol a gombák és mikrobák átalakítják a talaj szerves vegyületeivé.[42][43][44]
- Az eső a levegőben összegyűjtött szénen felül a növényekről is lemossa az oldható szerves és szervetlen szenet[45] és magával viszi azt a talajba és a talajvízbe, ahol biogeokémiai folyamatok révén a szénvegyületek átalakulnak.[46][47] Az átalakult szén visszajuthat a felszínre ha erős esőzések hatására a víz átitatja a talajt.[48][49]
- A folyókban, patakokban termelődő vagy oda bekerülő szerves szénvegyületek fizikai (fotooxidáció) vagy a mikroorganizmusok biológiai hatására lebomlanak, ezáltal CO2 kerül a levegőbe. Ennek mennyisége ugyanabb a nagyságrendbe tartozik, mint amennyi szenet a szárazföldi bioszféra évente elraktároz.[50][51][52]
- A folyók, víztározók, árterek nagy mennyiségű szerves szenet raktároznak üledék formájában. A vizükben szintén zajlik a szervas anyagok bontása, de ennek mértéke egy nagyságrenddel kisebb a folyókénál.[52][53] Az oxigénszegény iszapban, üledékben metántermelő baktériumok élnek.[54]
- A folyótorkolatokban a folyó által szállított tápanyagoknak köszönhetően erős a biológiai tevékenység.[55][56] Ennek ellenére a folyódelták vizei inkább kibocsátják, mint elnyelik a CO2-ot.[57]
- A tengerparti mocsarak, mangroveerdők tárolják és ki is bocsáthatják a szenet.[58][59][60] A lápok és mocsarak feltehetően globálisan nagyjából ugyanannyi szenet kötnek meg és bocsátanak ki, mint a folyók.[61]
- A tenger jellemzően elnyeli a légkörből a CO2-ot.[57]
- A tengeri biológiai pumpa az elnyelt szén egy részét továbbítja az üledékbe, ahol az elraktározódik.[32][62]
A tengeri biológiai pumpa
[szerkesztés]
A tengeri biológiai pumpa az a folyamat, melynek során a légkörből és a folyókból az óceánba érkező szén a tengeri élőlények segítségével gyorsított tempóban kerül a mélytengerbe, illetve az üledékbe.[63] Valójában nem egyetlen folyamatról van szó, hanem számos folyamat eredőjéről, amelyek közül mindegyik befolyásolhatja a biológiai pumpa hatékonyságát. A pumpa évente mintegy 11 milliárd tonna szenet továbbít az óceán mélyére. Nélküle a légkör mai CO2-koncentrációja kb. 400 ppm-mel lenne magasabb.[64][65][66]
A szén elsősorban a felszíni rétegekben épül bele a szerves és szervetlen biológiai anyagokba, majd utána lassan lesüllyed az aljzatra. A mélytenger a tápanyagok döntő többségét felülről kapja, ahová az az ún. "tengeri havazás" formájában érkezik. Ez a "hó" halott mikroszkopikus vagy nagyobb állatokból és növényekből, ürülékből, homokból és egyéb szervetlen anyagokból tevődik össze.[67]
A biológiai pumpa az oldott szervetlen szenet szerves biomasszává alakítja és részecskék vagy oldott anyag formájában a mélytenger felé továbbítja. A folyamat során a fitoplankton magába építi a szén-dioxidot és a szervetlen tápanyagokat, aztán a plankton pusztulásával vagy oldott szerves anyag lesz belőle vagy a növényevő zooplanktonokba kerül. A nagyobb zooplanktonok, pl. az evezőlábú rákok ürüléket bocsátanak ki, amelyet más állatok megesznek vagy nagyobb csomókba aggregálódva gyorsabb ütemben lesüllyed az aljzatig. Az oldott szerves anyagokat vagy a baktériumok használják fel életműködésükhöz vagy lassan lesüllyed a mélybe. A mélytengerben a lesüllyedő szervesanyag-részecskéket vagy oldott anyagokat az ottani élőlények ismét felhasználják, míg végül végleg bele nem kerül az üledékbe.[68]
Egyetlen fitoplankton-sejt naponta nagyjából egy méternyit süllyed. Figyelembe véve a világóceán négy kilométeres átlagmélységét, négy évbe is telhet amíg eléri a tengerfeneket. Ha azonban a fenti folyamatok révén aggregátumokba csomósodik, süllyedése egy nagyságrenddel gyorsabb lehet és napok alatt elérheti az aljzatot.[69]
A mélytengeri vizekben feloldott szenet a termohalin körforgás több ezer év alatt ismét visszaviheti a felszínre. Az üledékbe temetett szén a tektonikai szubdukció folytán lesüllyed a földköpenybe ahol az ún. lassú szénkörforgás során évmilliókig megmarad.[68]
Gyors és lassú körforgások
[szerkesztés]
Létezik a gyors és a lassú szénciklus. A gyors körforgás a bioszférában, a lassú pedig a litoszférában működik. A gyors vagy biológiai ciklus néhány éves időtartamon belül körbejár, a szén a légkörből a bioszférába kerül, majd vissza. A lassú, vagy geológiai ciklus több millió évig is eltarthat, itt a szén a földkéreg, a kőzetek, a talaj, az óceán és az atmoszféra között mozog.[70]
A gyors szénkörforgás viszonylag rövid időtartamú biogeokémiai folyamatokkal operál, amelyek az élőlények és környezetük között működnek (lásd az ábrát a cikk bevezetőjénél). Ezek által a szén a légkörből a szárazföldi és tengeri ökoszisztémákba, valamint a talajba és a tengeri üledékbe jut. A gyors körforgás része a fotoszintézis éves szintű változása, valamint a növényzet növekedésének és pusztulásnak, lebomlásának évtizedekben mérhető ciklusa. A gyors szénkörforgás és az emberi tevékenység kölcsönhatása azonnali hatást gyakorolhat a klímaváltozásra.[71][72][73][74]
A lassú szénkörforgást közép- és hosszútávú geokémiai folyamatok működtetik, mint a kőzetek átalakulása és a tektonikus mozgások. Az óceán és a légkör közötti széncsere évszázadokig, a kőzetek mállása évmillióig tarthat. Az óceán szene leülepedik a tengerfenékre, ahol üledékes kőzet válik belőle, ami a tektonikus szubdukció folytán lekerül a földköpenybe. A hegységek keletkezésével a szén visszakerül a földfelszínre. A kőzetek mállásával a szén egyrészt az atmoszférába, másrészt a folyók segítségével az óceánba kerül vissza. Valamennyi szén a kalcium hidrotermális kiválasztása során is visszakerülhet az óceánba. A lassú ciklus évente mintegy 10-100 millió tonna szenet mozgat; ebbe beletartozik a vulkánokból CO2 formájában közvetlenül a légkörbe jutó litoszférikus szén is, amely azonban csak alig 1%-a fosszilis tüzelőanyagok égetéséből származó CO2-nak.[70][71]
Mély szénciklus
[szerkesztés]
A mélyszénckilus során a szén a Föld köpenyében és magjában mozog. Bár igen fontos folyamat, részletei közel sem ismertek annyira, mint a légkör, a bioszféra, az óceán vagy a kőzetek folyamatai.[75] A mély szénciklus szorosan kapcsolódik a Föld felszínén és légkörében folyó szénmozgásokhoz. Ha ez a folyamat nem létezne, a szén a légkörben halmozódna fel, idővel extrém magas koncentrációt érve el.[76] Mivel azonban a szén így visszatérhet a Föld belsejébe, a mély ciklus alapvető szerepet játszik az életnek kedvező körülmények fenntartásában.
A folyamat már csak azért is rendkívül fontos, mert hatalmas mennyiségű szenet mozgat a bolygó belsejében. A bazaltmagma összetétele és a vulkánok CO2-kibocsátása alapján úgy becsülik, hogy a földköpeny mintegy ezerszer több szenet tartalmaz, mint a földfelszín.[77] A közvetlen megfigyelés természetesen rendkívüli nehézségekbe ütközik, tekintve, hogy a földköpeny alsó rétege 660–2990 km mélyen, míg a mag 2990–6400 km mélyen helyezkedik el. Ennek megfelelően a szén szerepéről a földmélyi folyamatokban, ottani formáiról igen hiányosan az ismereteink, és azok elsősorban laboratóriumi szimulációkon alapulnak. A szeizmológiai megfigyelések további információkat nyújthatnak arról, hogy milyen mértékben van jelen a szén a Föld magjában.
Szén a földköpeny alsó rétegeiben
[szerkesztés]
A szén alapvetően a karbonátokban gazdag üledékkel borított óceáni kéreglemezek tektonikus mozgása és szubdukciója révén kerül a földköpenybe. A köpenyen belüli széncirkulációról – különösen a mélyebb rétegekben – nincs sok közvetlen információnk, de számos vizsgálattal próbálták már bővíteni elképzeléseinket a szén mozgásáról és felvett alakjairól ebben a régióban. Egy 2011-es vizsgálat, amely brazíliai, egészen mélyről származó gyémántokat vizsgált, kimutatta, hogy a szénkörforgás egészen a köpeny alsó rétegéig nyúlik.[79] Eszerint, az óceáni bazaltkéreg egyes darabjai eljuthatnak egészen a köpeny mélyére és az általa szállított karbonátok kölcsönhatásba lépve a szilikátokkal olyan gyémánttá alakulnak, melynek tulajdonságai tükrözik az ott uralkodó hőmérsékleti és nyomásviszonyokat.[80]
Laboratóriumi szimulációs vizsgálatok szerint az alsó köpenybe jutó karbonátok nem csak gyémánttá alakulhatnak, hanem magnezitet, szideritet vagy különböző grafitváltozatokat is alkothatnak.[81] Más kísérletek és kőzettani megfigyelések szerint magas olvadási hőmérséklete miatt feltehetőn a magnezit a legstabilabb karbonátszármazék a köpeny legtöbb régiójában.[82] A karbonátok lefelé haladva fokozatosan redukálódnak és grafittá alakulnak át, a folyamatot pedig magnézium, vas és egyéb fémes elemek pufferolják.[83]
A szén hosszú ideig a földköpeny alsó térségeiben marad, de egy része időnként feltörhet a litoszférába. A szénben gazdag köpenyanyag helyi nyomáscsökkenés során megolvad és oszlopszerűen felemelkedve visszaszállítja a szenet a földkéregbe.[84] Útja során a szén ismét oxidálódik, hogy redox státusza megfeleljen a környező bazalténak és szén-dioxiddá alakul, majd a geológiailag aktív pontokon kiszabadulhat az atmoszférába.[85]

Szén a földmagban
[szerkesztés]Egyes feltételezések szerint a Föld magjában is nagy szénraktárak lehetnek. A belső magban mozgó rétegen belüli hullámok sebessége nagyjából a fele annak, mint amennyit egy vasban gazdag fémes közegtől elvárnánk.[86] Mivel jelenlegi tudásunk szerint a mag alapvetően kristályos vas és egy kevés nikkel elegyéből áll, ez a szeizmikus anomália könnyű elemek, többek között szén jelenlétére utal. Gyémántsatuval végzett, a magban uralkodó körülményeket modellező kísérletek szerint a vas-karbid(Fe7C3) felel meg leginkább a megfigyelt hullámsebességnek. Ha a modell helytálló, akkor a mag raktározhatja a Föld összes széntartalmának mintegy 67%-át.[87] Más vizsgálatok is arra utalnak, hogy a belső mag nyomásán és hőmérsékletén a szén feloldódik a vasban és hasonló összetételű (Fe7C3) bár más szerkezetű keveréket alkot.[88]
Az ember hatása a szénkörforgásra
[szerkesztés]
Az ipari forradalom elndulása óta, de különösen a második világháborút követően, az ember jelentős módon beleavatkozik a szénkörforgásba azzal, hogy a geoszférából nagy mennyiségű szenet irányít át a légkörbe.[1] Ezenfelül a mezőgazdaság terjedésével és az erdőirtásokkal megváltoztatták a bioszféra működését.[9] Nagy mennyiségű szintetikus anyagot (műanyagot) készített, amelyek több évtizedig vagy akár több évezredig megmaradnak a levegőben, a vízben, az üledékekben.[89][90]
A mezőgazdaság
[szerkesztés]Az emberek a mezőgazdaság feltalálása óta beleavatkoznak a szénkörforgásba a szárazföldi bioszféra vetegációjának eleinte lassú, az utóbbi időkben azonban egyre gyorsuló megváltoztatásával.[91] Az utóbbi évszázadokban a természetes növénytakaró közvetlen vagy közvetett pusztítása révén jelentősen csökkent a biodiverzitás és ezzel párhuzamosan visszaesett az ökoszisztémák szénmegkötő kapacitása, valamint ellenállóképessége a környezeti káros hatásokkal szemben. Sok esetben a sérült ökoszisztémák szenet bocsátanak ki a légkörbe.
A mezőgazdaság terjeszkedése során kiirtják az erdőket, amelyek nagy mennyiségű szenet kötnek meg és a helyüket szántóföldek és városok, falvak veszik át, amelyek azonban jóval kevesebb szenet tartanak kötött formában. A különbség az atomszférába távozik. Ez a hatás az erdők újratelepítésével megfordítható.
A növényevő állatok
[szerkesztés]A növényevő állatok elszaporodása egy ökoszisztémában szintén befolyásolhatja annak szénmérlegét. A nagytermetű állatok a túllegeléssel, taposással, túltrágyázással károsítják mind a növényzetet, mind a talajt.[92] A növények túllegelésével csökken azok szénmegkötő képessége és a növényfajok közötti egyensúly is felborul. A taposott talaj összetömörödik, csökken oxigéntartalma és kevesebb talajbeli élőlényt képes eltartani.[92] A trágyával nagyobb mennyiségű szén jut a légkörbe.[93] Összességében a növényevő állatok túlszaporodásával egy ökoszisztéma nettó szénelnyelőből szénkibocsátóvá válhat. Ilyen hatást többek között a sarkkörön túli erdőkben mutattak ki.[94]
Fosszilis tüzelőanyagok
[szerkesztés]Az ember a legnagyobb és leggyorsabban növekvő hatást a szénciklusra a fosszilis tüzelőanyagok (kőszén, kőolaj, földgáz) bányászatával és elégetésével gyakorolja. Ezzel a tevékenységével közvetlenül transzportálja a geoszféra szenét az atmoszférába. Szintén jelentős szén-dioxid kibocsátást jelent a mészkő égetése és cementté való átalakítása.[95]
2020-ig mintegy 450 gigatonnányi szenet bányásztunk ki, ami nem sokkal marad el a Föld valamennyi szárazföldi biomasszájában lekötött széntől.[2] A légkörbe való szénkibocsátás már meghaladja azt a mennyiséget, amennyit az óceán és a növényzet elnyelni képes.[96][97][98][99] Ezek a légköri extra szénnek nagyjából a felét képesek megkötni és ehhez is kb. egy évszázadnyi időre lenne szükségük.[2][91][100] Az óceán rövid időn belül túltelítődhet és az ember által kibocsátott szén-dioxidnak egy jelentős (20-35%-a, a használt modelltől függően) hosszú időre, több évszázadra vagy évezredre a légkörben marad.[101][102]
Vegyi anyagok
[szerkesztés]Az ember által gyártott, fosszilis szenet tartalmazó petrolkémiai anyagok előre nem látott jelentős hatással lehetnek a szénkörforgásra. Ennek egyik oka, hogy szándékosan lassan lebomlóknak tervezték őket, így viszont hajlamosak felhalmozódni a bioszférában. Helyük és szerepük a szénforgásban sok esetben még nem teljesen feltárt.

Műanyagok
[szerkesztés]Egyedül 2018-ban közel 400 millió tonna műanyagot gyártottak a Földön és ez a mennyiség évi 10%-kal növekedni látszik. 1950 óta több mint 6 gigatonna műanyag készült.[90] A műanyagok lebomlásának első lépcsője a darabokra esésük, ami viszont lehetővé teszi, hogy a szél és a vízáramlatok nagy területen szétterítsék az aptó részecskéket. Az állatok belélegzik vagy lenyelik a mikro- és nanoműanyagokat, amely aztán felhalmozódhat a testükben. A napfény hatására szétbomló műanyagok is szén-dioxidot és más üvegházhatású gázokat bocsátanak ki a levegőbe.[103] Történtek lépések biológiailag lebomló műanyagok elterjesztésére, ezek azonban szintén szén-dioxiddá és metánná bomlanak le.[104] Egy 2019-es vizsgálat szerint a jelenlegi műanyagmennyiség egyelőre nem jelent komoly kockázatot a társadalomra, azonban a jelenlegi trendek alapján a veszély a következő évszázad során jelentőssé válik.[105] Történnek erőfeszítések bioműanyagok előállítására is, amelyek biológiai eredetű anyagokból készülnek és így használatuk nem jár extra szénkibocsátással.[106]
Halogénezett szénvegyületek
[szerkesztés]A halogénezett szénhidrogéneket az iparban elsősorban oldószereként és hűtőközegként alkalmazzák. Bár igen kis mennyiségben vannak jelen a légkörben, a hosszú élettartamú gázok üvegházhatásának mintegy 10%-áért ők felelősek.[107] A klórozott és fluorozott szénhidrogének csökkentik a sztratoszféra ózontartalmát is, ezért ezek használatát nemzetközi szerződésekkel korlátozzák. Helyettük az ózonpajzsot nem károsító hidrofluoroolefineket vezetik be.[108]

A klímaváltozás visszacsatolási mechanizmusai
[szerkesztés]A pozitív visszacsatolási mechanizmusok egyik példája, hogy a magas CO2-koncentráció a légkörben az óceán elsavasodását és felmelegedését vonja maga után. Ez rombolja a tengeri ökoszisztémákat, amely csökkenti azok szénelnyelő kapacitását.[110] Különösen az olyan érzékeny rendszerek, mint a korallzátonyok, szenvednek nagy károkat, pedig a korallok jelentős mennyiségű szenet kötnek meg karbonátok formájában.[111] Fokozódó felmelegedést okozhat az is, ha a sarkvidéki fagyott talajból nagy mennyiségű metán szabadul fel.
A negatív visszacsatolások a fölös szén elnyelésével csökkentik az ember szénkibocsátásásának hatását az éghajlatra. Az óceán és a szárazföldi bioszféra, valamint a kőzetek az antripogén szénemisszió mintegy negyedét nyelik el.[109][112] A tompító hatások a pufferelő kapacitás telítődésével és a bioszféra pusztulásával a jövőben várhatóan gyengülni fognak és az éghajlat melegedése felgyorsul.[113] A gyengülés mértéke egyelőre bizonytalan, mert a különféle modellek jóslatai nagymértékben különböznek egymástól.[109][114][115]
Jegyzetek
[szerkesztés]- ↑ a b c The Carbon Cycle. Earth Observatory . NASA, 2011. június 16. [2016. március 5-i dátummal az eredetiből archiválva]. (Hozzáférés: 2018. április 5.)
- ↑ a b c d Friedlingstein, P., Jones, M., O'Sullivan, M., Andrew, R., Hauck, J., Peters, G., Peters, W., Pongratz, J., Sitch, S., Le Quéré, C. and 66 others (2019) "Global carbon budget 2019". Earth System Science Data, 11(4): 1783–1838. doi:10.5194/essd-11-1783-2019
- ↑ a b c d Prentice, I.C.. The carbon cycle and atmospheric carbon dioxide, Climate change 2001: the scientific basis: contribution of Working Group I to the Third Assessment Report of the Intergouvernmental Panel on Climate Change (2001)
- ↑ a b The NOAA Annual Greenhouse Gas Index (AGGI) - An Introduction. NOAA Global Monitoring Laboratory/Earth System Research Laboratories. (Hozzáférés: 2020. október 30.)
- ↑ What is Ocean Acidification?. National Ocean Service, National Oceanic and Atmospheric Administration. (Hozzáférés: 2020. október 30.)
- ↑ Report of the Ocean Acidification and Oxygen Working Group, SCOR Biological Observatories Workshop. scor-int.org/ . International Council for Science's Scientific Committee on Ocean Research (SCOR), 2009. szeptember 30.
- ↑ Holmes, Richard (2008). "The Age Of Wonder", Pantheon Books. ISBN 978-0-375-42222-5.
- ↑ The global carbon cycle. Princeton: Princeton University Press (2010. december 7.). ISBN 9781400837076
- ↑ a b c d e f g h (2000) „The Global Carbon Cycle: A Test of Our Knowledge of Earth as a System”. Science 290 (5490), 291–296. o. DOI:10.1126/science.290.5490.291. PMID 11030643.
- ↑ An Introduction to the Global Carbon Cycle. University of New Hampshire, 2009. [2016. október 8-i dátummal az eredetiből archiválva]. (Hozzáférés: 2016. február 6.)
- ↑ A Year In The Life Of Earth’s CO2 NASA: Goddard Space Flight Center, 17 November 2014.
- ↑ (2007) „Changes in atmospheric constituents and in radiative forcing”. Climate Change 2007: The Physical Basis. Contribution of Working Group I to the Fourth Assessment Report of the Intergovernmental Panel on Climate Change.
- ↑ „Many Planets, One Earth // Section 4: Carbon Cycling and Earth's Climate”. Many Planets, One Earth 4. (Hozzáférés: 2012. június 24.)
- ↑ a b (2012. december 7.) „Swansong Biospheres: Refuges for life and novel microbial biospheres on terrestrial planets near the end of their habitable lifetimes”. International Journal of Astrobiology 12 (2), 99–112. o. DOI:10.1017/S147355041200047X.
- ↑ (1981. december 7.) „A negative feedback mechanism for the long-term stabilization of Earth's surface temperature” (angol nyelven). Journal of Geophysical Research 86 (C10), 9776. o. DOI:10.1029/JC086iC10p09776. ISSN 0148-0227.
- ↑ a b Heath, Martin J.; Doyle, Laurance R. (2009-12-13). "Circumstellar Habitable Zones to Ecodynamic Domains: A Preliminary Review and Suggested Future Directions". arXiv:0912.2482 [astro-ph.EP].
- ↑ (2001. május 1.) „Biotic feedback extends the life span of the biosphere” (angol nyelven). Geophysical Research Letters 28 (9), 1715–1718. o. DOI:10.1029/2000GL012198.
- ↑ Planetary habitability on astronomical time scales, Heliophysics: Evolving Solar Activity and the Climates of Space and Earth. Cambridge University Press, 94. o. (2010. december 7.). ISBN 978-0-521-11294-9
- ↑ a b The Global Carbon Cycle, Considering Forest and Grassland Carbon in Land Management. United States Department of Agriculture, Forest Service, 3–9. o.. DOI: 10.2737/WO-GTR-95 (2017)
- ↑ (2002. január 1.) „Storing carbon in soil: Why and how?”. Geotimes 47 (1), 14–17. o. (Hozzáférés: 2018. április 5.)
- ↑ (2016) „Investigating the biochar effects on C-mineralization and sequestration of carbon in soil compared with conventional amendments using the stable isotope (δ13C) approach”. GCB Bioenergy 9 (6), 1085–1099. o. DOI:10.1111/gcbb.12401.
- ↑ Lal, Rattan (2008). „Sequestration of atmospheric CO2 in global carbon pools”. Energy and Environmental Science 1, 86–100. o. DOI:10.1039/b809492f.
- ↑ (2017) „The carbon flux of global rivers: A re-evaluation of amount and spatial patterns”. Ecological Indicators 80, 40–51. o. DOI:10.1016/j.ecolind.2017.04.049.
- ↑ (2010) „Temperature-associated increases in the global soil respiration record”. Nature 464 (7288), 579–582. o. DOI:10.1038/nature08930. PMID 20336143.
- ↑ (2020. november 2.) „A spatial emergent constraint on the sensitivity of soil carbon turnover to global warming” (angol nyelven). Nature Communications 11 (1), 5544. o. DOI:10.1038/s41467-020-19208-8. ISSN 2041-1723. PMID 33139706. PMC 7608627.
- ↑ Ocean Biogeochemical Dynamics. Princeton University Press, Princeton, New Jersey, USA (2006)
- ↑ (1999) „Geochemical Consequences of Increased Atmospheric Carbon Dioxide on Coral Reefs”. Science 284 (5411), 118–120. o. DOI:10.1126/science.284.5411.118. PMID 10102806.
- ↑ (2000) „Effect of calcium carbonate saturation state on the calcification rate of an experimental coral reef”. Global Biogeochemical Cycles 14 (2), 639. o. DOI:10.1029/1999GB001195.
- ↑ a b The Slow Carbon Cycle. NASA, 2011. június 16. [2012. június 16-i dátummal az eredetiből archiválva]. (Hozzáférés: 2012. június 24.)
- ↑ a b The Carbon Cycle and Earth's Climate Information sheet for Columbia University Summer Session 2012 Earth and Environmental Sciences Introduction to Earth Sciences I
- ↑ (1999. november 1.) „A New Look at the Long-term Carbon Cycle”. GSA Today 9 (11), 1–6. o.
- ↑ a b c (2017) „Where Carbon Goes when Water Flows: Carbon Cycling across the Aquatic Continuum”. Frontiers in Marine Science 4. DOI:10.3389/fmars.2017.00007.
- ↑ (2000) „Secondary organics and atmospheric cloud condensation nuclei production”. Journal of Geophysical Research: Atmospheres 105 (D7), 9255–9264. o. DOI:10.1029/1999JD901203.
- ↑ (2011) „Organic condensation: A vital link connecting aerosol formation to cloud condensation nuclei (CCN) concentrations”. Atmospheric Chemistry and Physics 11 (8), 3865–3878. o. DOI:10.5194/acp-11-3865-2011.
- ↑ (2006) „Export of organic carbon in run-off from an Amazonian rainforest blackwater catchment”. Hydrological Processes 20 (12), 2581–2597. o. DOI:10.1002/hyp.6217.
- ↑ (2016) „Dissolved Organic and Inorganic Carbon Flow Paths in an Amazonian Transitional Forest”. Frontiers in Marine Science 3. DOI:10.3389/fmars.2016.00114.
- ↑ (2004) „Cycling and composition of organic matter in terrestrial and marine ecosystems”. Marine Chemistry 92 (1–4), 39–64. o. DOI:10.1016/j.marchem.2004.06.016.
- ↑ (2016) „Signatures of Biomass Burning Aerosols in the Plume of a Saltmarsh Wildfire in South Texas”. Environmental Science & Technology 50 (17), 9308–9314. o. DOI:10.1021/acs.est.6b02132. PMID 27462728.
- ↑ (1998) „Primary Production of the Biosphere: Integrating Terrestrial and Oceanic Components”. Science 281 (5374), 237–240. o. DOI:10.1126/science.281.5374.237. PMID 9657713.
- ↑ (2004) „Soil organic carbon content and composition of 130-year crop, pasture and forest land-use managements”. Global Change Biology 10 (1), 65–78. o. DOI:10.1046/j.1529-8817.2003.00722.x.
- ↑ (2009) „Lignin content versus syringyl to guaiacyl ratio amongst poplars”. Bioresource Technology 100 (4), 1628–1633. o. DOI:10.1016/j.biortech.2008.08.046. PMID 18954979.
- ↑ (2000) „Soil respiration and the global carbon cycle”. Biogeochemistry 48, 7–20. o. DOI:10.1023/A:1006247623877.
- ↑ (2011) „Persistence of soil organic matter as an ecosystem property”. Nature 478 (7367), 49–56. o. DOI:10.1038/nature10386. PMID 21979045.
- ↑ (2015) „The contentious nature of soil organic matter”. Nature 528 (7580), 60–68. o. DOI:10.1038/nature16069. PMID 26595271.
- ↑ (1992) „Biodegradability of Dissolved Organic Matter in Forest Throughfall, Soil Solution, and Stream Water”. Soil Science Society of America Journal 56 (2), 578–586. o. DOI:10.2136/sssaj1992.03615995005600020038x.
- ↑ (1992) „Biodegradability of dissolved organic carbon in groundwater from an unconfined aquifer”. Science of the Total Environment 117-118, 241–251. o. DOI:10.1016/0048-9697(92)90091-6.
- ↑ (2001) „Relationship between DOC concentration and vadose zone thickness and depth below water table in groundwater of Cape Cod, U.S.A.”. Biogeochemistry 55 (3), 247–268. o. DOI:10.1023/A:1011842918260.
- ↑ Solutions Manual to Accompany Hydrology for Engineers, 1975
- ↑ (1933) „The Rôle of infiltration in the hydrologic cycle”. Transactions, American Geophysical Union 14 (1), 446. o. DOI:10.1029/TR014i001p00446.
- ↑ (2002) „Outgassing from Amazonian rivers and wetlands as a large tropical source of atmospheric CO2”. Nature 416 (6881), 617–620. o. DOI:10.1038/416617a. PMID 11948346.
- ↑ (2007) „Plumbing the Global Carbon Cycle: Integrating Inland Waters into the Terrestrial Carbon Budget”. Ecosystems 10, 172–185. o. DOI:10.1007/s10021-006-9013-8.
- ↑ a b (2013) „Global carbon dioxide emissions from inland waters”. Nature 503 (7476), 355–359. o. DOI:10.1038/nature12760. PMID 24256802.
- ↑ (2009) „Lakes and reservoirs as regulators of carbon cycling and climate”. Limnology and Oceanography 54 (6part2), 2298–2314. o. DOI:10.4319/lo.2009.54.6_part_2.2298.
- ↑ (2004) „Methane emissions from lakes: Dependence of lake characteristics, two regional assessments, and a global estimate”. Global Biogeochemical Cycles 18 (4), n/a. o. DOI:10.1029/2004GB002238.
- ↑ (2007) „Seasonal variations in the Amazon plume-related atmospheric carbon sink”. Global Biogeochemical Cycles 21 (3), n/a. o. DOI:10.1029/2006GB002831.
- ↑ (2008) „Amazon River enhances diazotrophy and carbon sequestration in the tropical North Atlantic Ocean”. Proceedings of the National Academy of Sciences 105 (30), 10460–10465. o. DOI:10.1073/pnas.0710279105. PMID 18647838. PMC 2480616.
- ↑ a b (2011) „Estuarine and Coastal Ocean Carbon Paradox: CO2Sinks or Sites of Terrestrial Carbon Incineration?”. Annual Review of Marine Science 3, 123–145. o. DOI:10.1146/annurev-marine-120709-142723. PMID 21329201.
- ↑ Ecological Processes in Coastal and Marine Systems (2012. december 6.). ISBN 9781461591467
- ↑ (2001) „River or mangrove? Tracing major organic matter sources in tropical Brazilian coastal waters”. Marine Chemistry 73 (3–4), 253–271. o. DOI:10.1016/s0304-4203(00)00110-9.
- ↑ (2011) „Radium-based pore water fluxes of silica, alkalinity, manganese, DOC, and uranium: A decade of studies in the German Wadden Sea”. Geochimica et Cosmochimica Acta 75 (21), 6535–6555. o. DOI:10.1016/j.gca.2011.08.037.
- ↑ (2013) „Conduits of the carbon cycle”. Nature 503 (7476), 346–347. o. DOI:10.1038/503346a. PMID 24256800.
- ↑ (2016) „Deciphering ocean carbon in a changing world”. Proceedings of the National Academy of Sciences 113 (12), 3143–3151. o. DOI:10.1073/pnas.1514645113. PMID 26951682. PMC 4812754.
- ↑ Sigman DM & GH Haug. 2006. The biological pump in the past. In: Treatise on Geochemistry; vol. 6, (ed.). Pergamon Press, pp. 491–528
- ↑ (2014) „The Biological Carbon Pump in the North Atlantic”. Progress in Oceanography 129, 200–218. o. DOI:10.1016/j.pocean.2014.05.005.
- ↑ (2015) „Toward quantifying the response of the oceans' biological pump to climate change”. Frontiers in Marine Science 2. DOI:10.3389/fmars.2015.00077.
- ↑ (2018) „Phytoplankton as Key Mediators of the Biological Carbon Pump: Their Responses to a Changing Climate”. Sustainability 10 (3), 869. o. DOI:10.3390/su10030869.
- ↑ (2002) „Zooplankton vertical migration and the active transport of dissolved organic and inorganic nitrogen in the Sargasso Sea”. Deep-Sea Research Part I 49 (8), 1445–1461. o. DOI:10.1016/S0967-0637(02)00037-7. ISSN 0967-0637.
- ↑ a b Ducklow, H.W., Steinberg, D.K. and Buesseler, K.O. (2001) "Upper Ocean Carbon Export and the Biological Pump". Oceanography, 14(4): 50–58. doi:10.5670/oceanog.2001.06
- ↑ De La Rocha C.L. (2006) "The Biological Pump". In: Treatise on Geochemistry; vol. 6, Pergamon Press, pp. 83–111.
- ↑ a b Libes, Susan M. (2015). Blue planet: The role of the oceans in nutrient cycling, maintain the atmosphere system, and modulating climate change In: Routledge Handbook of Ocean Resources and Management, Routledge, pages 89–107. ISBN 9781136294822.
- ↑ a b Climate Change and Renewable Energy, 109–141. o.. DOI: 10.1007/978-3-030-15424-0_3 (2020). ISBN 978-3-030-15423-3
- ↑ (2002) „Atmospheric carbon dioxide levels for the last 500 million years”. Proceedings of the National Academy of Sciences 99 (7), 4167–4171. o. DOI:10.1073/pnas.022055499. PMID 11904360. PMC 123620.
- ↑ (2019) „Correlation between the Fluctuations in Worldwide Seismicity and Atmospheric Carbon Pollution”. Sci 1, 17. o. DOI:10.3390/sci1010017.
- ↑ Rothman, Daniel (2015. január 1.). „Earth's carbon cycle: A mathematical perspective” (angol nyelven). Bulletin of the American Mathematical Society 52 (1), 47–64. o. DOI:10.1090/S0273-0979-2014-01471-5. ISSN 0273-0979.
- ↑ (2019) „Deep Carbon Cycling over the Past 200 Million Years: A Review of Fluxes in Different Tectonic Settings”. Frontiers in Earth Science 7, 263. o. DOI:10.3389/feart.2019.00263.
- ↑ The Deep Carbon Cycle and our Habitable Planet | Deep Carbon Observatory. deepcarbon.net . [2020. július 27-i dátummal az eredetiből archiválva]. (Hozzáférés: 2019. február 19.)
- ↑ (2003) „Where do Carbon Atoms Reside within Earth's Mantle?”. Physics Today 56 (10), 21–22. o. DOI:10.1063/1.1628990.
- ↑ Dasgupta, Rajdeep: From Magma Ocean to Crustal Recycling: Earth's Deep Carbon Cycle, 2011. december 10. [2016. április 24-i dátummal az eredetiből archiválva]. (Hozzáférés: 2019. március 9.)
- ↑ Carbon cycle reaches Earth's lower mantle: Evidence of carbon cycle found in 'superdeep' diamonds From Brazil. ScienceDaily . (Hozzáférés: 2019. február 6.)
- ↑ (2015. február 5.) „The oxygen fugacity at which graphite or diamond forms from carbonate-bearing melts in eclogitic rocks”. Contributions to Mineralogy and Petrology 169 (2), 16. o. DOI:10.1007/s00410-015-1111-1. ISSN 1432-0967.
- ↑ (2011. március 29.) „New host for carbon in the deep Earth”. Proceedings of the National Academy of Sciences 108 (13), 5184–5187. o. DOI:10.1073/pnas.1016934108. ISSN 0027-8424. PMID 21402927. PMC 3069163.
- ↑ (2018. május 1.) „Carbonate stability in the reduced lower mantle”. Earth and Planetary Science Letters 489, 84–91. o. DOI:10.1016/j.epsl.2018.02.035. ISSN 0012-821X.
- ↑ (2013. június 14.) „Redox Heterogeneity in Mid-Ocean Ridge Basalts as a Function of Mantle Source”. Science 340 (6138), 1314–1317. o. DOI:10.1126/science.1233299. ISSN 0036-8075. PMID 23641060.
- ↑ (2010. szeptember 15.) „The deep carbon cycle and melting in Earth's interior”. Earth and Planetary Science Letters 298 (1), 1–13. o. DOI:10.1016/j.epsl.2010.06.039. ISSN 0012-821X.
- ↑ (2008) „The Redox State of Earth's Mantle”. Annual Review of Earth and Planetary Sciences 36, 389–420. o. DOI:10.1146/annurev.earth.36.031207.124322.
- ↑ Does Earth's Core Host a Deep Carbon Reservoir? | Deep Carbon Observatory. deepcarbon.net . [2020. július 27-i dátummal az eredetiből archiválva]. (Hozzáférés: 2019. március 9.)
- ↑ (2014. december 16.) „Hidden carbon in Earth's inner core revealed by shear softening in dense Fe7C3”. Proceedings of the National Academy of Sciences 111 (50), 17755–17758. o. DOI:10.1073/pnas.1411154111. ISSN 0027-8424. PMID 25453077. PMC 4273394.
- ↑ (2015. március 1.) „High Poisson's ratio of Earth's inner core explained by carbon alloying”. Nature Geoscience 8 (3), 220–223. o. DOI:10.1038/ngeo2370. ISSN 1752-0908.
- ↑ Overview of greenhouse gases. U.S. Environmental Protection Agency, 2015. december 23. (Hozzáférés: 2020. november 2.)
- ↑ a b „The known unknowns of plastic pollution”, The Economist , 2018. március 3. (Hozzáférés: 2018. június 17.)
- ↑ a b Chapter 9 the Current Carbon Cycle and Human Impact, Geochemistry of Sedimentary Carbonates, Developments in Sedimentology, 447–510. o.. DOI: 10.1016/S0070-4571(08)70338-8 (1990). ISBN 9780444873910
- ↑ a b (2020. november 1.) „Herbivore Impacts on Carbon Cycling in Boreal Forests” (english nyelven). Trends in Ecology & Evolution 35 (11), 1001–1010. o. DOI:10.1016/j.tree.2020.07.009. ISSN 0169-5347. PMID 32800352.
- ↑ (2017. december 13.) „Feces nitrogen release induced by different large herbivores in a dry grassland”. Ecological Applications 28 (1), 201–211. o. DOI:10.1002/eap.1640. ISSN 1051-0761. PMID 29034532.
- ↑ (2013. július 1.) „Thresholds in plant–herbivore interactions: predicting plant mortality due to herbivore browse damage” (angol nyelven). Oecologia 172 (3), 751–766. o. DOI:10.1007/s00442-012-2523-5. ISSN 1432-1939. PMID 23188054.
- ↑ IPCC (2007) 7.4.5 Minerals Archiválva 2016. május 25-i dátummal a Wayback Machine-ben. in Climate Change 2007: Working Group III: Mitigation of Climate Change,
- ↑ A Breathing Planet, Off Balance. NASA , 2015. november 12. [2015. november 14-i dátummal az eredetiből archiválva]. (Hozzáférés: 2015. november 13.)
- ↑ Audio (66:01) - NASA News Conference - Carbon & Climate Telecon. NASA , 2015. november 12. [2015. november 17-i dátummal az eredetiből archiválva]. (Hozzáférés: 2015. november 12.)
- ↑ St. Fleur, Nicholas. „Atmospheric Greenhouse Gas Levels Hit Record, Report Says”, The New York Times, 2015. november 10.. [2015. november 11-i dátummal az eredetiből archiválva] (Hozzáférés: 2015. november 11.)
- ↑ Ritter, Karl. „UK: In 1st, global temps average could be 1 degree C higher”, AP News, 2015. november 9.. [2015. november 17-i dátummal az eredetiből archiválva] (Hozzáférés: 2015. november 11.)
- ↑ Figure 8.SM.4, Intergovernmental Panel on Climate Change Fifth Assessment Report, 8SM-16. o.
- ↑ Archer, David (2009). „Atmospheric lifetime of fossil fuel carbon dioxide”. Annual Review of Earth and Planetary Sciences 37 (1), 117–34. o. DOI:10.1146/annurev.earth.031208.100206.
- ↑ (2013) „Carbon dioxide and climate impulse response functions for the computation of greenhouse gas metrics: A multi-model analysis”. Atmospheric Chemistry and Physics 13 (5), 2793–2825. o. DOI:10.5194/acpd-12-19799-2012.
- ↑ (2019. november 12.) „Sunlight Converts Polystyrene to Carbon Dioxide and Dissolved Organic Carbon”. Environmental Science & Technology Letters 6 (11), 669–674. o. DOI:10.1021/acs.estlett.9b00532.
- ↑ Basic Information about Landfill Gas. United States Environmental Protection Agency , 2016. április 15.
- ↑ A scientific perspective on microplastics in nature and society. Scientific Advice for Policy by European Academies (2019). ISBN 978-3-9820301-0-4
- ↑ Carrington, Damian: Researchers race to make bioplastics from straw and food waste. The Guardian , 2018. július 5.
- ↑ The NOAA Annual Greenhouse Gas Index (AGGI). NOAA Global Monitoring Laboratory/Earth System Research Laboratories, 2020
- ↑ „The Transition from HFC- 134a to a Low -GWP Refrigerant in Mobile Air Conditioners HFO -1234yf”, General Motors Public Policy Center, 2013. október 29. (Hozzáférés: 2018. augusztus 1.)
- ↑ a b c (2018) „Analytically tractable climate–carbon cycle feedbacks under 21st century anthropogenic forcing”. Earth System Dynamics 9 (2), 507–523. o. DOI:10.5194/esd-9-507-2018.
 Material was copied from this source, which is available under a Creative Commons Attribution 4.0 International License.
Material was copied from this source, which is available under a Creative Commons Attribution 4.0 International License.
- ↑ (2002) „Global sea–air CO2 flux based on climatological surface ocean pCO2, and seasonal biological and temperature effects”. Deep Sea Research Part II: Topical Studies in Oceanography 49 (9–10), 1601–1622. o. DOI:10.1016/S0967-0645(02)00003-6.
- ↑ (2005) „Anthropogenic ocean acidification over the twenty-first century and its impact on calcifying organisms”. Nature 437 (7059), 681–686. o. DOI:10.1038/nature04095. PMID 16193043.
- ↑ (2016) „Global Carbon Budget 2016”. Earth System Science Data 8 (2), 605–649. o. DOI:10.5194/essd-8-605-2016.
- ↑ Carbon and Other Biogeochemical Cycles, Climate Change 2013 - the Physical Science Basis, 465–570. o.. DOI: 10.1017/CBO9781107415324.015 (2014). ISBN 9781107415324
- ↑ (2013) „Carbon dioxide and climate impulse response functions for the computation of greenhouse gas metrics: A multi-model analysis”. Atmospheric Chemistry and Physics 13 (5), 2793–2825. o. DOI:10.5194/acp-13-2793-2013.
- ↑ Analysis: How 'carbon-cycle feedbacks' could make global warming worse (angol nyelven). Carbon Brief , 2020. április 14. [2020. április 16-i dátummal az eredetiből archiválva]. (Hozzáférés: 2022. január 4.)
Fordítás
[szerkesztés]- Ez a szócikk részben vagy egészben a Carbon cycle című angol Wikipédia-szócikk ezen változatának fordításán alapul. Az eredeti cikk szerkesztőit annak laptörténete sorolja fel. Ez a jelzés csupán a megfogalmazás eredetét és a szerzői jogokat jelzi, nem szolgál a cikkben szereplő információk forrásmegjelöléseként.