Dihidrogén-trioxid
| Dihidrogén-trioxid | |||
A trioxidán szerkezeti képlete hidrogénatomokkal | |||
| IUPAC-név | trioxidán | ||
| Más nevek | dihidrogén-trioxid hidrogén-trioxid víz-levegő dihidroxi-éter | ||
| Kémiai azonosítók | |||
|---|---|---|---|
| CAS-szám | 14699-99-1 | ||
| PubChem | 166717 | ||
| ChemSpider | 145859 | ||
| ChEBI | 46736 | ||
| |||
| |||
| InChIKey | JSPLKZUTYZBBKA-UHFFFAOYSA-N | ||
| Gmelin | 200290 | ||
| Kémiai és fizikai tulajdonságok | |||
| Kémiai képlet | H2O3 | ||
| Moláris tömeg | 50,01 g/mol | ||
| Ha másként nem jelöljük, az adatok az anyag standardállapotára (100 kPa) és 25 °C-os hőmérsékletre vonatkoznak. | |||
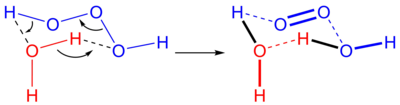
A dihidrogén-trioxid vagy trioxidán a hidrogén-polioxidok közé tartozó instabil szervetlen vegyület, képlete H2O3 vagy HOOOH. Vizes oldatban vízre és szingulett oxigénre bomlik:
A fordított reakció, azaz amikor szingulett oxigénből és vízből H2O3 keletkezik, ritka, részben, mert a szingulett oxigén nem fordul gyakran elő. Az élőlényekben ugyanakkor ismert egy olyan reakció, melynek során szingulett oxigénből ózon keletkezik. A feltételezett mechanizmus szerint szingulett oxigénből antitest katalízis hatására trioxidán keletkezik.[1]
Előállítása
[szerkesztés]Csekély, de kimutatható mennyiségű H2O3 keletkezik ózon és hidrogén-peroxid reakciójában vagy víz elektrolízise során. Nagyobb mennyiség állítható elő ózon és szerves redukálószerek alacsony hőmérsékleten, különböző szerves oldószerekben (az antrakinon-eljáráshoz hasonlóan) végzett reakciójával. Szerves hidrotrioxidok (ROOOH) bomlása során is keletkezik.[2]
Hidrogén-peroxid és ózon keverékét használják szerves anyagokkal szennyezett talajvizek fertőtlenítésére, előbbiek reakciójában H2O3 és H2O5 is keletkezik.[3]
Szerkezete
[szerkesztés]Spektroszkópiai vizsgálat szerint a dihidrogén-trioxid ferde, lineáris molekula, melyben az O−O kötések rövidebbek mint a hidrogén-peroxidban. Valószínűleg előfordul dimerként és trimerként is. A hidrogén-peroxidnál valamivel erősebb sav, H+ és OOOH− ionokra disszociál.[4]
Reakciói
[szerkesztés]A H2O3 könnyen vízre és szingulett oxigénre bomlik. Szobahőmérsékleten szerves oldószerekben 16 perc a felezési ideje, vízben csak a másodperc törtrészéig létezik. Tioéterekkel szulfoxidokat (X−SO−X) képez.
A legújabb kutatások szerint a dihidrogén-trioxid felelős az ózon/hidrogén-peroxid keverék antimikrobiális hatásáért. Mivel utóbbi két vegyület a biológiai rendszerekben is megtalálható, valószínűsítik, hogy az egyik emberi antitest dihidrogén-trioxidot állít elő oxidálószerként a betolakodó baktériumok ellen.[1][5]
A biológiai rendszerekben a dihidrogén-trioxid szingulett oxigén és víz közötti reakcióban keletkezik (a reakció iránya a koncentrációviszonyoktól függően változhat), a szingulett oxigént az immunsejtek állítják elő.[2][6]
Kísérletileg először 2005-ben vizsgálták, mikrohullámú spektroszkópiával. A molekula transz konformációjú, benne az O−O kötés hossza 142,8 pikométer, szemben a hidrogén-peroxidra jellemző 146,4 pikométeres értékkel. Elméleti számítások szerint további oxigén láncmolekulák vagy hidrogén-polioxidok léteznek (általános összegképletük H2On), és kis nyomású gázban akár végtelenül hosszú oxigénlánc is létezhet. Ezen spektroszkópiai bizonyítékok birtokában elkezdhető e molekulák keresése a csillagközi anyagban.[4]
Jegyzetek
[szerkesztés]- ↑ a b Paul T. Nyffeler, Nicholas A. Boyle, Laxman Eltepu, Chi-Huey Wong, Albert Eschenmoser, Richard A. Lerner, Paul Wentworth Jr. (2004). „Dihydrogen Trioxide (HOOOH) Is Generated during the Thermal Reaction between Hydrogen Peroxide and Ozone”. Angewandte Chemie International Edition 43 (35), 4656–4659. o. DOI:10.1002/anie.200460457. PMID 15317003.
- ↑ a b Božo Plesničar (2005). „Progress in the Chemistry of Dihydrogen Trioxide (HOOOH)” (PDF). Acta Chim. Slov 52, 1–12. o. (Hozzáférés: 2012. április 23.)[halott link]
- ↑ Xin Xu and William A. Goddard III. Peroxonechemistry:Formation of H2O3 and ring-(HO2)(HO3) from O3/H2O2
- ↑ a b Kohsuke Suma, Yoshihiro Sumiyoshi, and Yasuki Endo (2005). „The Rotational Spectrum and Structure of HOOOH”. J. Am. Chem. Soc. 127 (43), 14998–14999. o. [2013. május 23-i dátummal az eredetiből archiválva]. DOI:10.1021/ja0556530. PMID 16248618. (Hozzáférés: 2018. július 22.)
- ↑ A Time-Honored Chemical Reaction Generates an Unexpected Product, News & Views, September 13, 2004
- ↑ Roald Hoffmann (2004). „The Story of O”. American Scientist. [2016. március 3-i dátummal az eredetiből archiválva]. DOI:10.1511/2004.1.23. (Hozzáférés: 2013. július 6.)
Fordítás
[szerkesztés]Ez a szócikk részben vagy egészben a Trioxidane című angol Wikipédia-szócikk ezen változatának fordításán alapul. Az eredeti cikk szerkesztőit annak laptörténete sorolja fel. Ez a jelzés csupán a megfogalmazás eredetét és a szerzői jogokat jelzi, nem szolgál a cikkben szereplő információk forrásmegjelöléseként.