Difoszfor
| Difoszfor | |||
 A difoszfor vonalváza |
 A difoszfor kalottamodellje | ||
| IUPAC-név | difoszfor | ||
| Szabályos név | difoszfin[1] | ||
| Kémiai azonosítók | |||
|---|---|---|---|
| CAS-szám | 12185-09-0 | ||
| PubChem | 5460700 | ||
| ChemSpider | 4574176 | ||
| ChEBI | 33472 | ||
| |||
| |||
| InChIKey | FOBPTJZYDGNHLR-UHFFFAOYSA-N | ||
| Gmelin | 1400241 | ||
| Kémiai és fizikai tulajdonságok | |||
| Kémiai képlet | P2 | ||
| Moláris tömeg | 61,95 g/mol | ||
| Ha másként nem jelöljük, az adatok az anyag standardállapotára (100 kPa) és 25 °C-os hőmérsékletre vonatkoznak. | |||
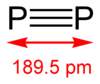
A difoszfor P2 a foszfor egyik allotrop módosulata.[2] A stabil, hármas kötést tartalmazó N2 molekulával ellentétben a P2 reakciókészsége nagy. A foszfor a tetraéderes P4 formában stabilabb, mivel a P2-ben a pi-kötések gyengék. Disszociációs energiája 117 kcal/mol vagy 490 kJ/mol, ami a dinitrogénének a fele. A P2-ben a kötési távolság 1,8934 Å.[3]
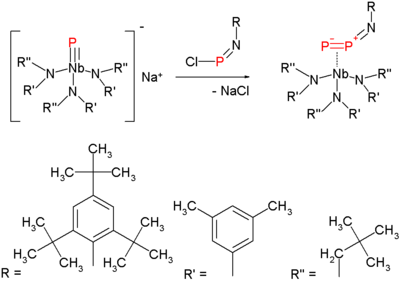
Difoszfort fehérfoszfor 1100 K hőmérsékletre hevítésével lehet előállítani. Mindemellett előrelépések történnek a molekula szobahőmérsékleten, normál körülmények között homogén oldatban történő előállítása terén is, valamilyen – például volfrám vagy nióbium centrumú – átmenetifém-komplex segítségével.[4][5]
A molekula iránt 2006-ban bontakozott ki nagy érdeklődés, amikor egy új szintézismódszert dolgoztak ki az előállítására, mely már enyhébb körülmények között is elvégezhető.[6]
Ez a módszer a nitrogén azidokból – nitrénképzésen keresztül – történő kiűzésének egyik változata. A difoszfor prekurzorának szintézise terminális nióbium-foszfid és klóriminofoszfán reakcióján alapul:
Ha ezt a vegyületet 1,3-ciklohexadiénben, mint oldó- és csapdázószerben 50 °C-ra melegítik, akkor reaktív difoszfor lép ki, mely kettős Diels–Alder-adduktumot és nióbium-imido vegyületet képez:
Ugyanez az imido vegyület keletkezik akkor is, ha a hőbontást toluolban végzik, de a keletkező difoszfor sorsa ekkor nem ismert.
Felmerült, hogy a P4 fotolízise során köztitermékként P2 keletkezik,[7] és hogy 2,3-dimetilbutadién jelenlétében újra difoszfán képződik.[8] Mindezidáig azonban nincs közvetlen bizonyíték arra nézve, hogy a P4 fotolízise során P2 keletkezne.
Fordítás
[szerkesztés]Ez a szócikk részben vagy egészben a Diphosphorus című angol Wikipédia-szócikk ezen változatának fordításán alapul. Az eredeti cikk szerkesztőit annak laptörténete sorolja fel. Ez a jelzés csupán a megfogalmazás eredetét és a szerzői jogokat jelzi, nem szolgál a cikkben szereplő információk forrásmegjelöléseként.
Források
[szerkesztés]- ↑ Diphosphorus (CHEBI:33472). Chemical Entities of Biological Interest (ChEBI). European Bioinformatics Institute
- ↑ Russell, C. A. (2010), PP, a Laboratory Reagent?. Angewandte Chemie International Edition, 49: 9572–9573. doi:10.1002/anie.201006243
- ↑ {{{title}}}. ISBN 0442233949
- ↑ Triple-Bond Reactivity of Diphosphorus Molecules Nicholas A. Piro, Joshua S. Figueroa, Jessica T. McKellar, Christopher C. Cummins Science 1 September 2006:Vol. 313. no. 5791, pp. 1276–1279 10.1126/science.1129630
- ↑ http://www.sciencemag.org/cgi/reprint/313/5791/1276.pdf
- ↑ Nicholas A. Piro, Joshua S. Figueroa, Jessica T. McKellar, Christopher C. Cummins (2006. szeptember 1.). „Triple-Bond Reactivity of Diphosphorus Molecules”. Science 313 (5791), 1276–1279. o. DOI:10.1126/science.1129630. PMID 16946068.
- ↑ Optische und photochemische versuche mit phosphor G. Rathenau Physica Volume 4, Issue 6, June 1937, Pages 503-514 doi:10.1016/S0031-8914(37)80084-1
- ↑ Tofan, D. and Cummins, C. C. (2010), Photochemical Incorporation of Diphosphorus Units into Organic Molecules. Angewandte Chemie International Edition, 49: 7516–7518. doi:10.1002/anie.201004385