Aminok
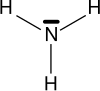
Az aminok olyan szerves vegyületek, melyek nitrogént tartalmaznak a funkciós csoportjukban. Az aminok formálisan az ammóniából származtathatók úgy, hogy az ammónia egy vagy több hidrogénatomját egy alkilcsoport (rövidítése: R) helyettesíti.
Csoportosításuk
[szerkesztés]Amennyiben csak egy hidrogénatom van lecserélve a széntartalmú alkilcsoportra, akkor primer aminoknak, vagy egyszerűen csak aminoknak nevezik őket.
Természetesen a nitrogénhez kapcsolódó többi hidrogén is helyettesíthető a fentiek szerint. Ekkor a szekunder illetve tercier aminok elnevezés használandó.

Ezeket az aminokat sokszor amidoknak is nevezik, bár az elnevezés nem mindig pontos és következetes. Amidoknak elsősorban azon aminokat hívjuk, ahol a nitrogénhez karbonil funkciós csoport (C=O) kapcsolódik.
A széntartalmú csoport felől vizsgálva az aminok elnevezhetők azok tulajdonságai alapján is (pl.: aromás aminok). Aromás és nyílt szénláncot is tartalmazó amin például az amfetamin.
Az egy molekulában több aminocsoportot tartalmazó aminokat di-, tri-, tetraminoknak stb. hívják. (Az egy aminocsoportot tartalmazó molekulák természetesen a monoaminok.)
Az aminokkal rokon vegyületek a kvaterner ammóniumvegyületek, ezek szerkezete az ammóniumionból vezethető le, ha a hidrogénatomok más csoportokkal vannak helyettesítve.
-
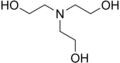
A trietanolamin (TEA) is tercier amin
-
Az etiléndiamin az egyik legegyszerűbb diamin
-
Kvaterner ammóniumkation
Fizikai tulajdonságaik
[szerkesztés]A kisebb szénatomszámú alkil-aminok gáz halmazállapotúak, szaguk általában az ammóniára emlékeztet. A nagyobb szénatomszámúak folyadékok vagy szilárd vegyületek. A kisebb szénatomszámúak – a primer aminok például 5 szénatomig – vízben jól, a nagyobbak rosszul oldódnak. Az etanol és a dietil-éter általában jól oldja az aminokat. Az aminok sói színtelen, szagtalan, kristályos vegyületek.
Kémiai tulajdonságaik
[szerkesztés]Bázisos jelleg
[szerkesztés]Az aminok nitrogénatomjának van egy szabad, nemkötő elektronpárja, így az ammóniához hasonlóan képesek protont megkötni, emiatt bázisos tulajdonságú vegyületek. Mivel képesek a víztől protont felvenni, az oldatukban a hidroxidionok kerülnek túlsúlyba, az oldat lúgos kémhatású lesz. A reakcióegyenlet (primer aminokra felírva):
Az alifás aminok általában az ammóniánál erősebb bázisok, a disszociációállandójuk többnyire legalább egy nagyságrenddel nagyobb. Ez a nitrogénatomhoz kapcsolódó alkilcsoportok elektronküldő hatásával magyarázható. Az adott alkilcsoportot tartalmazó aminok közül a szekunder aminok erősebb bázisok, mint a primer és a tercier aminok.
Az aminok savakkal sókat képeznek. Mivel gyenge bázisok, a sóik vizes oldatban hidrolizálnak. Erős savakkal alkotott sóik oldata savas kémhatású. A sókból az aminok erősebb bázisokkal felszabadíthatók. Például:
Acilezés
[szerkesztés]A primer és a szekunder aminok acilezhetők. Ez azt jelenti, hogy valamelyik nitrogénatomhoz kapcsolódó hidrogén helyére savgyök építhető be, savamidok keletkeznek. A karbonsavak amidjaiban a karbonilcsoporthoz kapcsolódó nitrogénatom már nem bázisos jellegű. Amidok állíthatók elő például savkloridokból (ahol az acilcsoport klóratomhoz kapcsolódik).
Hasonló reakció játszódik le karbonsavanhidridek és karbonsavészterek hatására is. Az amidok jól kristályosítható vegyületek, az aminok identifikálására használhatók. Az acilezés felhasználható az aminok átmeneti megvédésére.
Reakció salétromossavval
[szerkesztés]A primer, a szekunder és a tercier aminok salétromossavval (HNO2) szemben eltérően viselkednek, így megkülönböztethetők egymástól. A primer, alifás aminok és a salétromossav reakciójában átmenetileg egy instabil diazóniumvegyület keletkezik, amely nitrogénre és alkoholokra bomlik, de keletkeznek más vegyületek (például alkének) is. A fejlődő nitrogéngáz térfogatát mérve a reakció felhasználható a primer, alifás aminok térfogatos meghatározására (van Slyke-féle aminonitrogén-meghatározás).
Az aromás, primer aminokból (ahol az aminocsoport közvetlenül az aromás gyűrűhöz kapcsolódik) salétromossav (és sósav) hatására keletkező diazóniumion azonban stabilabb, alacsony hőmérsékleten (0 °C) nem bomlik el. Ez a reakció a diazotálás. A reakcióban keletkező diazóniumsók fenolok vagy aromás aminok hatására azovegyületekké alakulnak. Számos azovegyületet szerves festékként alkalmaznak (azofestékek).
A szekunder aminokból salétromossav hatására nitrózaminok keletkeznek, a tercier aminok nem reagálnak salétromossavval.
Biogén aminok
[szerkesztés]Biogén aminok az aminosavak dekarboxileződése során jönnek létre. Néhányuk a szervezetben ingerületátvivő anyagként működik (szerotonin, hisztamin). A biogén aminok az élelmiszerek természetes alkotói, fontos szerepük van az ételek ízvilágának kialakításában. Bizonyos biogén aminok túlzott bevitele allergiához hasonló tüneteket okozhat.
- tiramin - sajtok, bor
- triptamin - hallucinogén
- hisztamin - sajtok, borok, pezsgők, sörök, savanyúságok, halak, paradicsom, paprika, spenót, olajos magvak
- kadaverin - lizinből képződik rothadáskor, büdös, toxikus
- putreszcin - argininből keletkezik rothadáskor, büdös, toxikus
- α-alanin
- β-alanin
- szerotonin - banán, dió, paradicsom
Források
[szerkesztés]- Bruckner Győző. Szerves kémia I-1 kötet. Budapest: Tankönyvkiadó (1961)
- Bot György. A szerves kémia alapjai. Budapest: Medicina Könyvkiadó (1980). ISBN 963 240 150 6



![{\displaystyle \mathrm {[CH_{3}{-}NH_{3}]^{+}Cl^{-}+NaOH\rightarrow CH_{3}{-}NH_{2}+H_{2}O+NaCl} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/a8b740981b7d30773dab9e40d5d5037ef78a8ce8)


