Genetika

A genetika vagy örökléstan az élőlények tulajdonságainak öröklődését, a tulajdonságokat kialakító géneket tanulmányozó tudományág. A biológia egyik alapvető ága, mivel az öröklődés ismerete létfontosságú az élőlények evolúciójának megértéséhez. Alapvető törvényszerűségeit Gregor Mendel brünni szerzetes ismerte fel először a 19. században; megfigyelte, hogy az élőlények tulajdonságaikat különálló "öröklődési egységek" (ma géneknek nevezzük) révén adják az utódaiknak.
A tulajdonságok öröklődése és a gének molekuláris öröklődési mechanizmusainak megértése továbbra is a genetika elsődleges feladata, de a 20. század közepétől teendői kibővültek a gének működésének és viselkedésének tanulmányozásával. A tudományág számos részterületre bomlott, ide tartozik többek között a molekuláris genetika, az epigenetika vagy a populációgenetika. A genetika az élővilág valamennyi csoportját (beleértve az eukariótákat, prokariótákat, sőt a nem mindig élőnek tekintett vírusokat is) tanulmányozza.
A genetikai folyamatok az élőlény környezetével együttesen befolyásolják annak tulajdonságait vagy viselkedését. A gének kifejeződését a sejten belüli vagy kívüli környezeti tényezők egyaránt növelhetik vagy visszafoghatják.
Története
[szerkesztés]
A genetika szó az ógörög γενετικός (genetikosz, jelentése nemző, létrehozó) kifejezésből ered, amely a "származás" jelentésű γένεσις-ből (geneszisz) származtatott.[1][2]
Ősidők óta ismert, hogy az utódok öröklik szüleik tulajdonságait. A jelenséget a mezőgazdaságban az állatok és növények háziasítása, nemesítése során széleskörűen felhasználták.[3][4] A modern, tudományos alapokon nyugvó genetika a 19. század közepén, a morvaországi Gregor Mendel ágostonos szerzetes munkásságával kezdődött.[5]
Mendelt megelőzően a magyar Festetics Imre már felismerte az öröklődés egyes törvényszerűségeit és ő használta mai értelemben először a genetika kifejezést. 1819-ben közzétett, juhnemesítési tapasztalatait összegző művében A természet genetikai törvényei-ben (Die genetischen Gesetze der Natur) ő is megfogalmazza Mendel második törvényét a nagyszülői tulajdonságok újra felbukkanásáról, valamint a mutációk megjelenéséről is számot ad.[6][7]
A 19. században úgy vélték, hogy a szülők tulajdonságai az utódban elkeverednek, átlagolódnak (Darwin is ezt a modellt követte A fajok eredeté-ben).[8] A gyakorlati tapasztalat valóban ezt mutatja számos esetben (pl. testmagasság, bőrszín, stb.), Mendel a munkájában azonban számos olyan példát mutatott, ahol a tulajdonságok egyáltalán nem keveredtek és a következő nemzedékekben teljes mivoltukban újra feltűntek. A látszólagos vegyülés csak a sokgénes tulajdonságoknál lép fel. A másik, akkoriban népszerű öröklődésmodell Jean-Baptiste Lamarck nevéhez fűződik; ő azt állította, hogy a szerzett tulajdonságok is öröklődhetnek, az izmos kovács gyerekei izmosabbak lesznek az átlagnál, a lombért nyújtózkodó zsiráf utódainak hosszabb lesz a nyaka. Elméletét August Weismann kísérletekkel cáfolta.[9] Darwin és követője, Francis Galton is kidolgozta a maga pángenetikus elméletét, miszerint a testrészek és szervek apró, gemmuláknak nevezett részecskéket bocsátanak ki, amelyek az ivarsejtekben koncentrálódnak és így kerülnek át a tulajdonságok a következő nemzedékbe.[10]
Mendeli genetika
[szerkesztés]
A modern genetika Gregor Mendel munkájával kezdődött. 1865-ben "Növényhibridekkel végzett kísérletek" (Versuche über Pflanzenhybriden) címmel bemutatta a brünni Természettudományos Társaságnak (Naturforschender Verein) addigi kutatásainak összegzését. Mendel a borsó bizonyos tulajdonságainak öröklődését vizsgálta nemzedékeken keresztül és eredményeit matematikai módszerekkel is feldolgozta. Bár az általa felfedezett törvényszerűségek nem minden minden tulajdonság esetében voltak megfigyelhetők, de azt bebizonyította, hogy a tulajdonságok különálló "csomagokban" adódnak át, nem keverednek és átadódásuk egyszerű matematikai képletekkel leírható.[11]
A tudományos közvélemény nem ismerte fel azonnal Mendel eredményeinek jelentőségét, csak halála után ismerték el, amikor 1900-ban Hugo de Vries és más kutatók újrafelfedezték törvényeit. A genetika kifejezés is ekkor terjedt el, miután William Bateson 1905-ben javasolta használatát.[12][13]
A Mendel-törvények újrafelfedezését követően a kutatók azt próbálták kideríteni, hogy a sejt mely molekulái felelősek az öröklődését. Az amerikai Nettie Stevens 1905-ben felfedezte, hogy a lisztbogarak nőstényeinek csak X, míg a hímeknek X és Y kromoszómái vannak. Megállapította, hogy a nemet a kromoszómák határozzák meg és az attól függ, hogy a hím milyen spermiuma termékenyíti meg a petesejtet. 1911-ben Thomas Hunt Morgan kijelentette, hogy a gének a kromoszómákon kell hogy legyenek, ugyanis megfigyelte, hogy a muslicák fehérszem-mutációja nemhez kötött, azzal együtt öröklődik.[14] Tanítványa, Alfred Sturtevant 1913-ban a génkapcsoltság tanulmányozásával bebizonyította, hogy a gének sorban helyezkednek el a kromoszómán.[15]
Molekuláris genetika
[szerkesztés]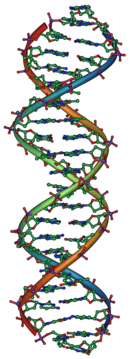
Bár azt már tudták, hogy a gének a kromoszómákon találhatóak, rejtély maradt hogy azok két komponense, a fehérjék és a nukleinsavak közül melyik felelős az öröklődésért. 1928-ban a brit Frederick Griffith felfedezte a transzformáció jelenségét: elpusztult baktériumokból genetikai anyagot átvive élőkre, az utóbbiak megkaptak az előbbiek tulajdonságait, átváltoztak ("transzformálódtak"). Tizenhat évvel később, 1944-ben Oswald Avery bebizonyította, hogy a transzformációt a DNS okozza.[16] 1943-ban Joachim Hämmerling egysejtű algakísérleteivel kimutatta, hogy az eukariótákban a genetikai anyag a sejtmagban található.[17] 1952 Alfred Hershey és Martha Chase bakteriofágokkal dolgozva megerősítette, hogy a vírusok esetében is a DNS (nem pedig a fehérje) az örökletes tulajdonságok hordozója.[18]
1953-ban James Watson és Francis Crick röntgenkrisztallográfiás felvételek segítségével meghatározta a DNS-molekula szerkezetét: kiderült, hogy az két, spirálisan egymás köré tekeredő, rendkívül hosszú polimerszálból áll.[19][20] A polimerszálak alapegységei, a négyféle nukleotid befelé nézve, egymást kiegészítve kapcsolódtak, mint egy megcsavart létra fokai.[21] A szerkezetből magától értetődően következett, hogy a genetikai információ a nukleotidok sorrendjében (szekvenciájában) rejlik. Egyúttal azt is megmagyarázta, hogy hogyan kettőződik meg a DNS a sejtosztódás során; a széttekeredő szálak saját maguk szolgáltak mintául (templátul) a kiegészítő új szálnak. A leányDNS-ek egyik szála mindig a régi DNS-ből származik, míg a másik újonnan szintetizálódik (a DNS szemikonzervatív).[22]
Bár a DNS szerkezete magyarázta az öröklődés általános működését, továbbra is rejtély volt, hogy milyen módon befolyásolja a sejt működését. Az elkövetkező években a kutatás elsősorban arra irányult, hogy hogyan szabályozza a DNS a proteinek termelését.[23] Felfedezték, hogy a DNS egyik száláról RNS (ribonukleinsav, ami kémiailag nagyon hasonlít a DNS-re) másolat készül, az ún. hírvivő RNS (mRNS). Ennek nukleotidsorrendje a genetikai kódnak megfelelően fordítódik le a sejt citoplazmájában a fehérje aminosavszekvenciájára.[24]
Az öröklődés és sejtműködés alapelveinek tisztázása számtalan új felfedezés felé nyitotta meg az utat.[25] 1968-ban a japán Kimura Motó megfogalmazta a molekuláris evolúció semleges elméletét, miszerint az evolúció DNS-szinten a semleges (aminosavszekvenciában nem mutatkozó) mutációk felhalmozódásával is folyhat.[26] 1977-ben Frederick Sanger kifejlesztette a technikát a DNS nukleotidsorrendjének leolvasására (szekvenálására).[27] 1983-ban Kary Mullis felfedezett egy módszert, a polimeráz-láncreakciót a DNS egyes szakaszainak felszaporítására, lehetővé téve ezzel a specifikus részek gyors detektálását.[28] 2003-ra számos kutatócsoport nemzetközi együttműködésével (illetve velük párhuzamosan a Celera Genomics magáncég révén) sikeresen befejeződött a Human Genome Project, meghatározták az ember DNS-ének teljes bázissorrendjét.[29][30]
Az öröklődés alapjai
[szerkesztés]A Mendel-törvények
[szerkesztés]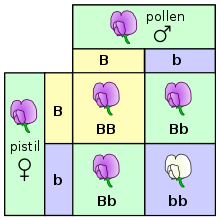
Egyszerűen fogalmazva az öröklődés úgy zajlik, hogy a szülőkről az utódokra különálló öröklődési egységek, úgynevezett gének szállnak át.[31] Ezt a jelenséget először Gregor Mendel figyelte meg, aki borsónövényeken tanulmányozta az öröklődő tulajdonságok szétválását, és többek között kimutatta, hogy egy növény virágai vagy lilák vagy fehérek, de sohasem köztes színűek. Ugyanannak a génnek az adott megfigyelhető tulajdonságot (fenotípust) irányító különálló változatait alléloknak nevezzük.[11][32]
A borsó esetében (amely egy diploid faj) a növény minden egyes génből két példányt tartalmaz, véletlenszerűen egy-egy példányt örökölt mindkét szülőjétől.[33] Az állatok és növények többsége (köztük az ember is) hasonlóan működik. Ez a Mendel-törvények között a szétválás szabálya, az allélok egymástól elválva kerülnek az ivarsejtekbe. Azt az élőlényt, amely egy adott gén esetében ugyanazt az allélt örökölte mind a két szülőtől, homozigótának nevezzük (erre a génre vonatkoztatva), míg azokat amelyekben két különböző allél található, heterozigótának hívjuk. Az élőlény teljes génkészletének neve genotípus, míg a megfigyelhető tulajdonságaié fenotípus. A heterozigótáknál sok esetben csak az egyik allél hatása figyelhető meg a fenotípusban, a domináns allél elnyomja a recesszívet (a fenti példában a virág lilaságát meghatározó allél elnyomja a fehér szín allélját). Máskor a dominancia nem teljes és köztes fenotípus mutatkozik meg vagy kodomináns állapot lép fel, amikor mindkét allél egyformán kifejeződik.[34]
A domináns és recesszív allélok miatt azonban a fenotípus eltérhet a genotípustól. Mendel kísérleteiben kiderült, hogy a virágszínt vizsgálva az első nemzedék teljes egészében lila lett, míg ha ezeket egymás között tovább keresztezte, a második generáció növényeiben 3:1 arányban ismét megjelent a fehér szín.
Génkölcsönhatások
[szerkesztés]
Az élőlényeknek több ezer vagy tízezer génjük van, és az ivarosan szaporodó szervezetekben ezek a gének általában egymástól függetlenül rendeződnek; vagyis a borsószem sárga vagy zöld színét meghatározó allél öröklődése nincs kapcsolatban a fehér vagy lila virágok alléljának öröklődésével. Ezt a jelenséget Mendel második törvényének vagy a "független öröklődés törvényének" nevezik. Ennek hatására a gének alléljai az utódokban különféle kombinációkat hozhatnak létre. A gének sokszor egymással kölcsönhatva befolyásolják ugyanazt a tulajdonságot. A tavaszi békaszemnek (Omphalodes verna) például van egy génje, amelynek alléljai meghatározzák a virágok színét: kék vagy lila lehet. Egy másik gén viszont azt szabályozza, hogy a virágok egyáltalán színesek vagy inkább pigment nélküli fehérek legyenek. Ha egy növénynek két példánya van a fehér allélből, akkor a virágai fehérek lesznek, függetlenül attól, hogy az első gén kék vagy lila alléllal rendelkezik-e. Az efféle gének közötti kölcsönhatást episztázisnak nevezzük, a második gén episztatikusan hat az elsőre.[35]
Sok tulajdonság nem "bináris" jellegű (pl. vagy lila vagy fehér virág), hanem értéke folytonos skála mentén változik (ilyen pl. az ember magassága vagy bőrszíne). Ezeket általában sok gén befolyásolja egyszerre, ún. multigénes tulajdonságok.[36] A helyzetet tovább bonyolítja, hogy a végső tulajdonságra a környezet is jelentős hatást gyakorolhat (pl. gyerekkori éhezés a testmagasságra). Azt, hogy egy élőlény génjei mekkora mértékben járulnak hozzá egy tulajdonsághoz, heritabilitásnak nevezzük.[37] A heritabilitás értéke is különböző külső hatásoktól függhet, pl. a testmagasságnak az Egyesült Államokban 89%-os a heritabilitása, míg Nigériában (ahol a gyerekek élelmiszerhez és egészségügyi ellátáshoz való hozzáférése sokkal inkább függ a társadalmi helyzettől) mindössze 62%.[38]
Az öröklődés molekuláris alapjai
[szerkesztés]A DNS és a kromoszómák
[szerkesztés]
A gének molekuláris szempontból a dezoxiribonukleinsavban (röviden DNS) testesülnek meg. A DNS egy hosszú lánc, amely egymással váltakozó dezoxiribóz (egyfajta cukormolekula) és foszfát molekuláiból áll és a cukorhoz oldalvást nitrogéntartalmú bázisok kapcsolódnak. Négy ilyen bázis létezik: az adenin (A), citozin (C), guanin (G) és a timin (T). A láncok oldalsó bázisai hidrogénkötésekkel egymáshoz kapcsolódnak (az adenin csak timinnel, a guanin csak citozinnal), hosszú kétszálú, létraszerű struktúrát hozva létre, amely állandó átmérővel csavarodik: ez a híres kettős hélix.[39] A genetikai információ a bázisok sorrendjében (szekvenciájában) rejlik, a gének gyakorlatilag a hosszú DNS-lánc egyes szakaszainak felelnek meg.[40] A sejtben a rendkívül hosszú DNS-molekulák hisztonfehérjékre feltekeredve helyezkednek el, hogy kevesebb helyet foglaljanak. Az így felcsavart egyetlen DNS-molekula a kromoszóma.[41] Egyes vírusok DNS helyett a kémiailag igen hasonló ribonukleinsavat (RNS) használják genetikai információik tárolására.[42]
Mivel a kettős spirál szálain a szemben levő bázisok kiegészítik egymást, mindkét szál külön-külön is magában hordozza a teljes genetikai információt. A DNS másolásakor a szálak szétválnak és mindkettő mintaként (templátként) szolgál az új kiegészítő szál szintéziséhez.[43]

A gének lineárisan, egymást követően helyezkednek el a DNS hosszú szálain. A baktériumok génjei jellemzően egyetlen, kör alakú DNS-en találhatók, míg az eukarióták (mint az állatok és növények) sejtjei több, különböző hosszúságú DNS-láncon (kromoszómán) tárolják génjeiket. A DNS-szálak sokszor rendkívül hosszúak; például a legnagyobb emberi kromoszóma (az I-es) 247 millió bázispár hosszú.[44] A kromoszóma DNS-éhez fehérjék kapcsolódnak, amelyek segítenek kezelhető méretűre csomagolni azt és szabályozni az egyes génszakaszok hozzáférhetőségét, átírhatóságát. A DNS-fehérje komplexet kromatinnak hívják; az eukarióták esetében ennek alapegysége a nukleoszóma, a hisztonfehérjék köré tekert DNS.[45] A szervezet teljes genetikai információjának összességét (általában kromoszómáinak összesített szekvenciáját) genomnak hívjuk.
A DNS leggyakrabban a sejtmagban található, de egyes sejtszervecskék, mint a mitokondriumok vagy a növények kloroplasztiszai is tartalmaznak valamennyit belőle.
A legtöbb állat és növény minden kromoszómából két példányt tartalmaz, vagyis diploidok (léteznek egy kromoszómakészlettel rendelkező, ún. haploid eukarióták is, mint pl. a mohák). Az egyik példány az anyától, a másik az apától származik.[33]
Sok faj rendelkezik nemi kromoszómával, amelyek megléte vagy hiánya határozza meg az egyed nemét.[46] Az emlősök (és így az ember) esetében a nőstényeknek két egyforma nemi kromoszómájuk (XX) van, míg a hímek XY készlettel rendelkeznek; az Y kromoszómán találhatók meg azok a gének, amelyek elindítják a rájuk jellemző tulajdonságok kifejlődését. Az evolúció során az Y kromoszóma elvesztette génjei többségét és jóval kisebb lett az X-nél, amely átlagos méretű. Emiatt a nőstények a rajta található génekből két példánnyal rendelkeznek, míg a hímek csak eggyel. Hogy az ezzel járó biokémiai problémákat kiküszöböljék, a nőstények sejtjeiben az egyik, véletlenszerűen kiválasztott X kromoszóma kikapcsolódik (az összezsugorodott X kromoszóma a Barr-test).[47] Mivel a hímek az X kromoszóma génjeire haploidok, ezért náluk jóval gyakrabban manifesztálódnak az ezekhez kapcsolódó genetikai betegségek is.[47] Más élőlények nemmeghatározó rendszere másképp működik, pl. a madaraknál a hímeknek vannak egyforma nemi kromoszómáik (ZZ), a tojóké pedig különböző (ZW).
A szaporodás
[szerkesztés]
A sejtosztódás során a teljes genom lemásolódik és mindegyik leánysejt kap belőle egy példányt. Ez a mitózisnak nevezett folyamat a szaporodás legegyszerűbb formája, ezen alapszik a vegetatív (aszexuális) reprodukció. Elsősorban az egysejtűek szaporodnak így, de előfordulhat soksejtű élőlényeknél is; ilyenkor az utód genetikailag azonos a szülővel és annak klónjának nevezik.[48]
Az eukarióták jellemzően ivarosan szaporodnak, utódjuk két szülő genetikai anyagának keverékét tartalmazza. Ennek folyamán haploid ivarsejtek jönnek létre, majd egyesülésükkel visszaáll a diploid állapot.[33] A haploid ivarsejtek olyan osztódással (ún. meiózis) alakulnak ki, amelyet nem előz meg a DNS megkettőződése és a leánysejtek a kromoszómapárokból random módon egy-egy darabot örökölnek. Az állatok döntő többsége és a legtöbb növény életciklusa nagy részében diploid és csak ivarsejtjei (a spermium és a petesejt) haploidok.[49]
A baktériumok nem használják a klasszikus ivaros szaporodás módszerét, de megvan a maguk eszköze arra, hogy új genetikai információt szerezzenek. Sok baktériumfaj képes a konjugációra, melynek során kis, kör alakú DNS-ek (plazmidok) jutnak át egyik egyedből a másikba.[50] Ezenkívük képesek DNS-molekulákat felvenni a környezetből és beépíteni azt a genomjukba; ezt transzformációnak nevezik.[51] Ezen folyamatok eredménye az ún. horizontális géntranszfer (ellentéte a nemzedékek közötti "vertikális génátadás"), amely során a genetikai információ egymással rokonságban nem álló egyedek között is képes terjedni.[52]
Rekombináció és genetikai kapcsoltság
[szerkesztés]
A diploidia miatt a külön kromoszómán elhelyezkedő gének egymástól függetlenül öröklődnek és számos különféle kombinációt alkothatnak az új nemzedékben. Az egyazon kromoszómán lévő gének elvben mindig együtt adódnak át, a gyakorlatban azonban kisebb gyakorisággal ugyan, de rekombinálódnak. A kromoszómák ugyanis az ún. crossing over során kicserélik egymás között nagyobb darabjaikat, újrarendezve ezzel génjeik kombinációját.[53] Ez a folyamat a meiózis folyamán, a haploid ivarsejtek kialakulásakor játszódik le.
Annak a valószínűsége, hogy a meiózis során két, ugyanazon kromoszómán elhelyezkedő gén között crossing over zajlik le, a távolságuktól függ. Kellően nagy távolság esetén a crossing over esélye szinte 100%, vagyis a gének ugyanúgy egymástól függetlenül öröklődnek, mintha más-más kromoszómán lennének.[54] A közeli gének azonban genetikailag kapcsoltak; kapcsoltságuk mértéke a távolságuktól függ. Keresztezéses kísérletekkel megállapítható a kapcsoltság mértéke, így relatív távolságuk is. A genetika korai időszakában ezzel a módszerrel határozták meg a gének sorrendjét a kromoszómán, így készítettek genetikai térképeket.[55]
Génkifejeződés
[szerkesztés]A genetikai kód
[szerkesztés]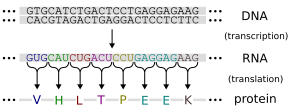
A gének úgy fejezik ki hatásukat a szervezetre, hogy fehérjék íródnak át róluk, amelyek aztán elvégzik a konkrét feladatot a sejtben vagy azon kívül. A fehérjék elsődleges szerkezete a DNS-hez hasonlóan lineáris, vagyis a DNS egy adott szakasza (szekvenciája) megfeleltethető a fehérje aminosavsorrendjének. A gének fehérjévé történő átírása nem közvetlenül történik, hanem a DNS-ről először egy kémiailag hozzá igen hasonló ribonukleinsav (RNS) másolat íródik át (ezt nevezik transzkripciónak), az ún. hírvivő RNS (elterjedt angol kifejezéssel messenger RNS vagy mRNS).
Az mRNS kikerül a sejtmagból a citoplazmába és a riboszómák a szekvenciája alapján összeállítják a fehérje aminosavláncát (ez az ún. transzláció). Az RNS minden három nukleotidja (kodonja) a genetikai kód szerint megfeleltethető egy aminosavnak.[56] Az információ itt csak egy irányba halad, a nukleinsavak szekvenciájától az fehérjék aminosavsorrendje felé; visszafelé soha, a fehérjék szekvenciáját a sejtek nem tudják visszakódolni nukleotidsorrenddé.[57]
A fehérjék ezután az aminosavsorrendjük alapján olyan háromdimenziós szerkezetekbe gombolyodnak, amellyel már el tudják látni feladatukat.[58][59] Vannak amelyek egyszerű szálakat képeznek a mechanikai struktúrákhoz, mint pl. a kollagén. Mások képesek molekulákat megkötni (akár más fehérjéket) hogy aztán enzimként valamilyen kémiai reakciót katalizáljanak velük, esetleg felismerjék az immunrendszer számára.
A DNS egyetlen nukleotidjának megváltozása módosíthatja a róla készült protein aminosavsorrendjét, és ennek megfelelően annak háromdimenziós szerkezetét is; kulcsfontosságú helyen teljesen tönkre is teheti azt. Példának okáért a sarlósejtes anémia egy olyan örökletes betegség, amelyet a hemoglobin egyik alegységének egyetlen nukleotidmódosulása okoz.[60] A módosult hemoglobinmolekulák hajlamosak összetapadni, megváltoztatva ezzel a vörösvértest alakját. A sarló alakú vértestek nem képesek gyorsan áramlani a hajszálerekben, gyakran összetapadnak, gyorsabban lebomlanak, különféle egészségügyi problémákat okozva.
Egyes DNS-szakaszokról készül ugyan RNS-kópia, de arról nem íródik át fehérje: ezek a nemkódoló RNS-ek. Ilyenek a riboszómák RNS-komponensei, az aminosavakat szállító transzfer RNSek, valamint a gének működését szabályozó molekulák (pl. mikroRNS-ek).
A környezet hatása az öröklődésre
[szerkesztés]
Bár a gének minden információt tartalmaznak a szervezet felépítéséhez és működéséhez, a végső tulajdonságok (fenotípus) a környezeti hatásokkal kölcsönhatásban jönnek létre. Ennek egy példája a sziámi macskák bundájának színe, ahol a környezeti hatást az állat testhőmérséklete jelenti. A macska génjei sötét szőrzetet kódolnak, de az általuk termelt fehérje hőérzékeny (pontosabban egy hőérzékeny mutációt hordoz) és test magasabb hőmérsékletű területein denaturálódik, míg a kiálló testrészek (végtagok, farok, fülek, arc) hűvösebb részein működőképes marad és sötétre színezi a szőrszálakat.[61]
Külső, környezeti hatásokkal módosítható egyes öröklődő betegségek kifejeződése. Az embereknél is előforduló fenilketonuria esetében a szervezet nem tudja teljesen lebontani a fenilalanin aminosavat és felhalmozódik annak toxikus bomlásterméke. Az aminosavat nem tartalmazó diéta mellett viszont a mutáció hordozója egészséges életet élhet.[62]
Annak megállapítására, hogy egy tulajdonságot genetikai vagy környezeti faktorok határoznak-e meg inkább, az emberek esetében gyakran használják az ikerkutatást.[63] Az egypetéjű ikrek genetikailag azonosak, míg a kétpetéjű ikrek (vagy testvérek) csak hasonlítanak egymásra. Ha összehasonlítják hogy egy adott tulajdonság, betegség milyen gyakorisággal fordul elő az egy- és többpetéjű ikrek tagjai között, következtetni lehet arra, hogy azt a gének vagy a hasonló környezet váltja-e ki. Így bizonyították be a skizofrénia genetikai hátterét is, miután egy amerikai vizsgálatban négyesikrek minden tagjánál kialakult a betegség.[64]
A gének szabályozása
[szerkesztés]
A genom több tízezer gént tartalmaz, de egy adott sejtben csak egy kis részüknek kell működnie. A sejtnek számos módszere van arra, hogy elindítsa vagy leállítsa az mRNS átírását az adott génről. Az egyik ilyen szabályzók a transzkripciós faktorok; olyan fehérjék, amelyek a DNS adott szakaszához kötődve segítik vagy gátolják a transzkripciót.[65] Például az Escherichia coli baktérium rendelkezik olyan enzimekkel, amelyek a triptofán aminosav szintézisét végzik, de ha a környezetből elegendő tud felvenni belőle, a szintézisre nincs szükség. Magas triptofánszint esetén az aminosav kötődik a triptofánrepresszorhoz (ami egy transzkripciós faktor), annak megváltozik a szerkezete és az enzimek génjéhez kapcsolódva leállítja azok működését.[66]
A génkifejeződés szabályozása különösen fontos a soksejtű élőlények esetében, amelyek sejtjei nagyon különbözőek lehetnek és működésükhöz más-más géngarnitúra szükséges. Minden szervezet egyetlen sejtből fejlődik ki, az embrionális fejlődés során a külső és belső hatásokra más gének kapcsolnak be és egymással kölcsönhatásban hozzák létre a különféle szöveteket és szerveket.
A gének szabályozása a DNS kémiai módosítása (általában metilációja) által is történhet. Sejtosztódáskor a metilációs mintázat megmarad, az utódsejtek megöröklik azt, így DNS-ben nem kódolt, ún. epigenetikus információ is átjut egyik sejtből a másikba.[67] Például az apa és az anya epigenetikus mintázata különbözik egymástól és a magzat csak akkor fejlődik normálisan ha mindkettővel rendelkezik (ez az ún. génimprinting). Az egyedfejlődés során a metilációs minta változik, ritka esetekben (pl. paramutációk) nemzedékek között is átadódhat.[68]
Mutációk
[szerkesztés]
A DNS másolása során időnként hibák keletkeznek az újonnan szintetizált második szálban. Ha ezek a mutációknak nevezett hibák a fehérjéket kódoló régiókban történnek, képesek megváltoztatni az élőlény fenotípusát. A hibaarány a másolást végző DNS-polimeráz enzim ellenőrző funkciójának hála igen alacsony, nagyjából minden 10-100 milliomodik bázist ront el.[69][70] Egyes – ún. mutagén – hatások jelentősen megnövelhetik a mutációk gyakoriságát; ide tartoznak pl. egyes vegyszerek, a szabad gyökök vagy a molekuláris szerkezetet rongáló elektromágneses sugárzás (UV-, röntgen- vagy gammasugárzás).[71] A sejt rendelkezik olyan javító enzimekkel, amelyek rendbehozzák a sérült vagy törött DNS-t. A javítás során azonban nem mindig áll helyre az eredeti bázissorrend.[72]
A kromoszómák crossing overe során még nagyobb léptékű mutációk keletkezhetnek. A crossing over során rendszerint a kromoszómák homológ, nagyon hasonló szekvenciájú régiói cserélődnek ki. Néha azonban hiba történik és egy nagyobb régió a másik kromoszóma kisebb részével cserél helyet; ilyenkor az egyik sejtben génduplikáció, a másikban pedig – sokszor letális kimenetelű – génhiány (deléció) lép fel.[73]
Az öröklődés szerepe az evolúcióban
[szerkesztés]A legtöbb mutáció viszonylag "csendes", nem vagy alig van hatással az élőlény külső megjelenésére, egészségére, szaporodási képességére.[74] Egyes mutációk súlyos károkat okoznak a szervezetben és ritkán előfordulnak olyanok is, amelyek hatása előnyös.[75] Az ecetmuslicával végzett kísérletek szerint a mutációk mintegy 70%-a káros, a többi vagy semleges vagy pedig enyhén előnyös.[76]

Az új mutációk hatásuktól függően (vagy néha véletlenszerűen) idővel elterjedhetnek a populációban; ezeket a változásokat a populációgenetika tanulmányozza.[77] Ha az új allél jó hatással van az egyedek túlélésére vagy szaporodásuk hatékonyságára, a természetes szelekció hatására gyakorisága megnő.[78] Az allélgyakoriságot befolyásolhatja a genetikai sodródás, a genetikai stoppolás,[79] a mesterséges szelekció vagy a vándorlás is.[80]
Számos generáció során ezek a kis változások felhalmozódhatnak, igen jelentőssé válhatnak, hatásukra az élőlények fejlődnek, az evolúció alanyaivá válnak. Az előnyös mutációk felhalmozódásával a fajok képesek jobban alkalmazkodni a környezetükhöz.[81] Idővel új fajok is kialakulnak, különösen olyan kisebb populációkban, amelyek földrajzilag is el vannak vágva a többi egyedtől.[82]
A rokon fajok genomját összehasonlítva meg lehet állapítani, hogy milyen régen váltak el egymástól. Az ilyen molekuláris genetikai összehasonlítás általában megbízhatóbb eredményt ad a rokonság fokának meghatározásában, mint a klasszikus, fenotípus alapján történő osztályozás. Sok faj összehasonlításával rokonsági fákat lehet összeállítani, amelyek megmutatják, hogy az evolúció során hogyan változtak az eredeti fajok és keletkeztek az új evolúciós ágak. A mikroorganizmusok esetén, ahol a horizontális géntranszfer jelentős szerepet kap, a hasonló rokonsági fák kevésbé megbízhatóak.[83]
Modellszervezetek
[szerkesztés]
A genetikusok eredetileg a fajok széles skáláján tanulmányozták az öröklődést, idővel azonban a vizsgált élőlények köre leszűkült. Ennek egyik oka az, hogy ha egy adott fajra vonatkozóan már léteznek releváns eredmények, a további kutatók nagyobb valószínűséggel választják azt tanulmányozásra. Így mára a legtöbb genetikai kutatás csak néhány modellszervezetből választ. A gyakori kutatási témák közé tartozik a génszabályozás vizsgálata, a géneknek az egyedfejlődésre vagy a tumorképződése gyakorolt hatása. A fajokat részben a kényelmi szempontok miatt választották; ilyen például a nemzedékek gyors váltakozása vagy a könnyű molekuláris genetikai manipuláció lehetősége. A széles körben használt modellszervezetek közé tartozik az Escherichia coli bélbaktérium, az Arabidopsis thaliana növény, a sörélesztő (Saccharomyces cerevisiae), a Caenorhabditis elegans fonálféreg, az ecetmuslica (Drosophila melanogaster), a zebradánió (Danio rerio) vagy a házi egér (Mus musculus).[84]
Orvostudományi alkalmazása
[szerkesztés]Az orvosi genetika a genetikai változatosságnak az emberi egészségre, a betegségek kialakulására gyakorolt hatását tanulmányozza.[85] Amikor egy öröklődő betegség ismeretlen génjét keresik, a kutatók általában a más génekkel való genetikai kapcsoltságra fókuszálnak, hasonló tüneteket vizsgálnak a rokonság körében. Ha már van egy jelölt, többnyire a modellszervezetek homológ génjein végeznek további kutatásokat. Az öröklődő betegségek tanulmányozása mellett a genotipizálási módszerek a farmakogenetikában is nagy jelentőséggel bírnak; azt vizsgálják, hogy a genotípus hogyan befolyásolja a szervezet gyógyszerekre adott válaszait.[86]
A rák genetikai betegség és az emberek különböznek a tumorok kialakulását befolyásoló öröklött hajlamaikban. A tumor létrejötte egy többlépéses folyamat és minden lépéshez adott mutációknak kell kialakulnia a genomban. Bár ezek a mutációk nem örökítődnek tovább az utódokra, befolyásolják a sejtek viselkedését, elsősorban az osztódásukat. A szervezetnek is megvannak a maga mechanizmusai, hogy időben megállítsa a tumor kifejlődését és programozott sejthalállal (apoptózissal) elpusztítja a hordozó sejtet; ám olyan mutációk is léteznek, amelyek megkerülik ezeket a mechanizmusokat. Tulajdonképpen egyfajta sejten belüli természetes szelekció zajlik, melynek végén a mutációk felhalmozódnak, hogy elősegítsék a sejt gyors osztódását és így rákos daganat jöjjön létre.
Normális esetben a sejt csak a növekedési faktorok hatására osztódik és ha kontaktusba kerül a szomszédos sejtekkel, akkor a növekedése megáll. Többnyire csak néhányszor osztódik, utána elpusztul. A tumor létrejöttéhez több (három-hét) mutáció szükséges. A tumorsejt aztán növekedési faktorok nélkül is képes osztódni és figyelmen kívül hagyja a gátló szignálokat. Az osztódások száma sincs már limitálva és akkor sem áll le, ha érintkezik szomszédaival. A leánysejtek kiszabadulhatnak az eredeti szövetből és a vérárammal eljutnak más szervekbe. Megtelepedve másodlagos áttéteket hoznak létre, amely végül a szervezet pusztulásához vezet. Bár a rákos megbetegedések egy kis hányadában van genetikai hajlam, nagyobbik hányaduk a testi sejtekben megjelenő új mutációk eredménye. A tumorképződést elősegítő leggyakoribb mutációk a szupresszor p53 fehérje kikapcsolását vagy az onkogének (pl. Ras proteinek) aktiválódását okozzák.[87][88]
Kutatási módszerek
[szerkesztés]
A DNS laboratóriumban módosítható. Ennek egyik módja, hogy restrikciós enzimekkel adott helyeken elvágják, előre tervezhető méretű darabokra.[89] Ezeket a darabokat gélelektroforézissel lehet méret szerint elkülöníteni egymástól;[forrás?] ligáz enzimmel pedig végeik összeköthetők. A különböző élőlényektől származó DNS-darabok "összeligálásával" rekombináns DNS vagy génmódosított élőlény hozható létre. A baktériumok és vírusok génmanipulálásakor gyakran alkalmaznak plazmidokat, rövid, cirkuláris DNS-darabokat, amelyeken csak néhány gén fér el. A molekuláris klónozás során a vizsgált gént plazmidba helyezik, majd azt baktériumba juttatva és a baktériumot felszaporítva nagy tömegben előállítható a kívánt DNS-szakasz. A klónozás kifejezést állatok vagy növények genetikailag azonos másolatainak létrehozásakor is használják.[90]
Rövidebb DNS-szakaszokat polimeráz-láncreakcióval (angol rövidítéssel PCR) is fel lehet szaporítani.[91] A módszer nagyon érzékeny, nagyon kis mennyiségből detektálásra, szekvenálásra alkalmas mennyiséget lehet létrehozni, így gyakran használják az orvosi diagnosztikában vagy a törvényszéki orvostanban is.[forrás?]
DNS-szekvenálás, genomika
[szerkesztés]A DNS-szekvenálás, a genomok tanulmányozására kifejlesztett egyik legalapvetőbb technológia lehetővé teszi a kutatók számára, hogy meghatározzák a DNS-szakaszok nukleotidsorrendjét. Az első módszert Frederick Sanger csoportja kísérletezte ki 1977-ben. Ma már rutinszerűen alkalmazzák egészen hosszú molekulák szekvenálására is. A technológia segítségével a kutatók képesek tanulmányozni az emberi betegségekkel összefüggő nukleotidsorrendeket.[92]
Ahogy a szekvenálás olcsóbbá vált, lehetőség nyílt egész genomok meghatározására. A genom kis darabjait egyesével megszekvenálják, aztán számítógép segítségével összeillesztik az egymásnak megfelelő szakaszokat.[93] Ennek segítségével a Humán Genom Projekt során 2003-ra meghatározták az emberi genom teljes bázissorrendjét.[29] A továbbfejlesztett módszerekkel a szekvenálás költségei drasztikusan lecsökkentek: a 2010-es évekre sikerült azt ezer dollár alá vinni.[94]
A rendelkezésre álló szekvenciaadatok nagy mennyisége létrehozta létre a genomika tudományágát (tulajdonképpen a bioinformatika egyik részterülete), ahol számítógép segítségével keresnek és elemeznek mintázatokat a genomban.[forrás?]
Kapcsolódó szócikkek
[szerkesztés]- Molekuláris biológia
- Növényhibridizációs kísérletek
- Genetikai kutató szervezetek
- Genetikusok, biokémikusok
- Mitokondriális genetika
- Genetikai betegség
- Genetikai betegségek listája
Jegyzetek
[szerkesztés]- ↑ Genetikos (γενετ-ικός). Henry George Liddell, Robert Scott, A Greek-English Lexicon. Perseus Digital Library, Tufts University. [2010. június 15-i dátummal az eredetiből archiválva]. (Hozzáférés: 2012. február 20.)
- ↑ Genesis (γένεσις). Henry George Liddell, Robert Scott, A Greek-English Lexicon. Perseus Digital Library, Tufts University. [2010. június 15-i dátummal az eredetiből archiválva]. (Hozzáférés: 2012. február 20.)
- ↑ Science: The Definitive Visual Guide. Penguin, 362. o. (2009). ISBN 978-0-7566-6490-9
- ↑ (2022. július 1.) „Themes of Biological Inheritance in Early Nineteenth Century Sheep Breeding as Revealed by J. M. Ehrenfels”. Genes 13 (8), 1311. o. DOI:10.3390/genes13081311. PMID 35893050. PMC 9332421.
- ↑ (1991. július 1.) „Historical study: Johann Gregor Mendel 1822-1884”. American Journal of Medical Genetics 40 (1), 1–25; discussion 26. o. DOI:10.1002/ajmg.1320400103. PMID 1887835.
- ↑ (2019. június 1.) „The emergence of genetics from Festetics' sheep through Mendel's peas to Bateson's chickens”. Journal of Genetics 98 (2), 63. o. DOI:10.1007/s12041-019-1108-z. PMID 31204695.
- ↑ (2014. január 1.) „Imre Festetics and the Sheep Breeders' Society of Moravia: Mendel's Forgotten "Research Network"”. PLOS Biology 12 (1), e1001772. o. DOI:10.1371/journal.pbio.1001772. PMID 24465180. PMC 3897355.
- ↑ Population Genetics. Georgetown University, 26. o. (2011). ISBN 978-1-4443-6245-9
- ↑ Lamarck, J-B (2008). Encyclopædia Britannica. Encyclopædia Britannica Online Archiválva 2020. április 14-i dátummal a Wayback Machine-ben. on 16 March 2008.
- ↑ Peter J. Bowler, The Mendelian Revolution: The Emergency of Hereditarian Concepts in Modern Science and Society (Baltimore: Johns Hopkins University Press, 1989): chapters 2 & 3.
- ↑ a b Mendel's Paper in English. [2016. január 13-i dátummal az eredetiből archiválva].
- ↑ genetics, n., Oxford English Dictionary, 3rd ed.
- ↑ Letter from William Bateson to Alan Sedgwick in 1905. The John Innes Centre. [2007. október 13-i dátummal az eredetiből archiválva]. (Hozzáférés: 2008. március 15.)
- ↑ (1983) „Thomas Hunt Morgan – The Geneticist”. Integrative and Comparative Biology 23 (4), 855–865. o. DOI:10.1093/icb/23.4.855.
- ↑ (1913) „The linear arrangement of six sex-linked factors in Drosophila, as shown by their mode of association”. Journal of Experimental Biology 14 (1), 43–59. o. DOI:10.1002/jez.1400140104.
- ↑ (1944. február 1.) „STUDIES ON THE CHEMICAL NATURE OF THE SUBSTANCE INDUCING TRANSFORMATION OF PNEUMOCOCCAL TYPES : INDUCTION OF TRANSFORMATION BY A DESOXYRIBONUCLEIC ACID FRACTION ISOLATED FROM PNEUMOCOCCUS TYPE III”. The Journal of Experimental Medicine 79 (2), 137–158. o. DOI:10.1084/jem.79.2.137. PMID 19871359. PMC 2135445.
- ↑ Cell and Molecular Biology. I.K. International Pvt Ltd, 221. o. (2008. március 7.). ISBN 978-81-89866-59-4
- ↑ (1952. május 1.) „Independent functions of viral protein and nucleic acid in growth of bacteriophage”. The Journal of General Physiology 36 (1), 39–56. o. DOI:10.1085/jgp.36.1.39. PMID 12981234. PMC 2147348.
- ↑ The Eighth Day of Creation: Makers of the Revolution in Biology. Cold Spring Harbor Laboratory Press, 51–169. o. (1979). ISBN 978-0-87969-477-7
- ↑ (1953. április 1.) „Molecular structure of nucleic acids; a structure for deoxyribose nucleic acid”. Nature 171 (4356), 737–738. o. DOI:10.1038/171737a0. PMID 13054692.
- ↑ (1953. május 1.) „Genetical implications of the structure of deoxyribonucleic acid”. Nature 171 (4361), 964–967. o. DOI:10.1038/171964b0. PMID 13063483.
- ↑ (2014. február 1.) „DNA replication at the single-molecule level”. Chemical Society Reviews 43 (4), 1201–1220. o. DOI:10.1039/c3cs60391a. PMID 24395040.
- ↑ Managing Science: Methodology and Organization of Research. Springer, 76. o. (2010). ISBN 978-1-4419-7488-4
- ↑ Encyclopedia of Evolution. Infobase Publishing, 134. o. (2009). ISBN 978-1-4381-1005-9
- ↑ Genetics and Reductionism. Cambridge University Press, 140. o. (1998). ISBN 978-0-521-63713-8
- ↑ Ohta T., Gillespie J.H. (1996). „Development of neutral and nearly neutral theories”. Theoretical Population Biology 49 (2), 128–142. o. DOI:10.1006/tpbi.1996.0007. PMID 8813019.
- ↑ (1977. december 1.) „DNA sequencing with chain-terminating inhibitors”. Proceedings of the National Academy of Sciences of the United States of America 74 (12), 5463–5467. o. DOI:10.1073/pnas.74.12.5463. PMID 271968. PMC 431765.
- ↑ (1985. december 1.) „Enzymatic amplification of beta-globin genomic sequences and restriction site analysis for diagnosis of sickle cell anemia”. Science 230 (4732), 1350–1354. o. DOI:10.1126/science.2999980. PMID 2999980.
- ↑ a b Human Genome Project Information. Human Genome Project. [2008. március 15-i dátummal az eredetiből archiválva]. (Hozzáférés: 2008. március 15.)
- ↑ „The sequence of the human genome”. Science 291.
- ↑ Patterns of Inheritance: Introduction, An Introduction to Genetic Analysis, 7th, New York: W.H. Freeman (2000). ISBN 978-0-7167-3520-5
- ↑ Mendel's experiments, An Introduction to Genetic Analysis, 7th, New York: W.H. Freeman (2000). ISBN 978-0-7167-3520-5
- ↑ a b c Mendelian genetics in eukaryotic life cycles, An Introduction to Genetic Analysis, 7th, New York: W.H. Freeman (2000). ISBN 978-0-7167-3520-5
- ↑ Interactions between the alleles of one gene, An Introduction to Genetic Analysis, 7th, New York: W.H. Freeman (2000). ISBN 978-0-7167-3520-5
- ↑ Gene interaction and modified dihybrid ratios, An Introduction to Genetic Analysis, 7th, New York: W.H. Freeman (2000). ISBN 978-0-7167-3520-5
- ↑ (2005. június 1.) „Mapping the new frontier: complex genetic disorders”. The Journal of Clinical Investigation 115 (6), 1404–1407. o. DOI:10.1172/JCI25421. PMID 15931374. PMC 1137013.
- ↑ Quantifying heritability, An Introduction to Genetic Analysis, 7th, New York: W. H. Freeman (2000). ISBN 978-0-7167-3520-5
- ↑ (2001. július 1.) „Heritability of obesity-related traits among Nigerians, Jamaicans and US black people”. International Journal of Obesity and Related Metabolic Disorders 25 (7), 1034–1041. o. DOI:10.1038/sj.ijo.0801650. PMID 11443503.
- ↑ Urry L, Cain M, Wasserman S, Minorsky P, Reece J, Campbell N: Campbell Biology. plus.pearson.com . (Hozzáférés: 2022. szeptember 28.)
- ↑ (2006. május 1.) „Genetics: what is a gene?”. Nature 441 (7092), 398–401. o. DOI:10.1038/441398a. PMID 16724031.
- ↑ Histone (angol nyelven). Genome.gov . (Hozzáférés: 2022. szeptember 28.)
- ↑ Microbiology, 3rd, Wm. C. Brown, 343. o. (1996). ISBN 0-697-21865-1
- ↑ Mechanism of DNA Replication, An Introduction to Genetic Analysis, 7th, New York: W.H. Freeman (2000). ISBN 978-0-7167-3520-5
- ↑ (2006. május 1.) „The DNA sequence and biological annotation of human chromosome 1”. Nature 441 (7091), 315–321. o. DOI:10.1038/nature04727. PMID 16710414.
- ↑ Alberts et al. (2002), II.4. DNA and chromosomes: Chromosomal DNA and Its Packaging in the Chromatin Fiber Archiválva 2007. október 18-i dátummal a Wayback Machine-ben.
- ↑ Sex chromosomes and sex-linked inheritance, An Introduction to Genetic Analysis, 7th, New York: W.H. Freeman (2000). ISBN 978-0-7167-3520-5
- ↑ a b (2015. február 1.) „Mary F. Lyon (1925-2014)”. Nature 518 (7537), 36. o, Kiadó: Springer Nature Limited. DOI:10.1038/518036a. PMID 25652989.
- ↑ clone. Merriam-Webster Dictionary . (Hozzáférés: 2023. november 13.)
- ↑ Haploid (angol nyelven). www.genome.gov . (Hozzáférés: 2024. február 10.)
- ↑ Bacterial conjugation, An Introduction to Genetic Analysis, 7th, New York: W.H. Freeman (2000). ISBN 978-0-7167-3520-5
- ↑ Bacterial transformation, An Introduction to Genetic Analysis, 7th, New York: W.H. Freeman (2000). ISBN 978-0-7167-3520-5
- ↑ (2018. január 1.) „Sex in microbial pathogens”. Infection, Genetics and Evolution 57, 8–25. o. DOI:10.1016/j.meegid.2017.10.024. PMID 29111273.
- ↑ Nature of crossing-over, An Introduction to Genetic Analysis, 7th, New York: W. H. Freeman (2000). ISBN 978-0-7167-3520-5
- ↑ Crossover: Concepts and Applications in Genetics, Evolution, and Breeding. University of Wisconsin Press, 55. o. (1994). ISBN 978-0-299-13564-5
- ↑ Linkage maps, An Introduction to Genetic Analysis, 7th, New York: W. H. Freeman (2000). ISBN 978-0-7167-3520-5
- ↑ I. 5. DNA, RNA, and the Flow of Genetic Information: Amino Acids Are Encoded by Groups of Three Bases Starting from a Fixed Point, Biochemistry, 5th, New York: W.H. Freeman and Company (2002)
- ↑ (1970. augusztus 1.) „Central dogma of molecular biology”. Nature 227 (5258), 561–563. o. DOI:10.1038/227561a0. PMID 4913914.
- ↑ Alberts et al. (2002), I.3. Proteins: The Shape and Structure of Proteins Archiválva 2023. január 1-ji dátummal a Wayback Machine-ben.
- ↑ Alberts et al. (2002), I.3. Proteins: Protein Function Archiválva 2006. április 25-i dátummal a Wayback Machine-ben.
- ↑ How Does Sickle Cell Cause Disease?. Brigham and Women's Hospital: Information Center for Sickle Cell and Thalassemic Disorders, 2002. április 11. [2010. szeptember 23-i dátummal az eredetiből archiválva]. (Hozzáférés: 2007. július 23.)
- ↑ (2006. április 1.) „Albinism in the domestic cat (Felis catus) is associated with a tyrosinase (TYR) mutation”. Animal Genetics 37 (2), 175–178. o. DOI:10.1111/j.1365-2052.2005.01409.x. PMID 16573534. PMC 1464423.
- ↑ MedlinePlus: Phenylketonuria. NIH: National Library of Medicine. [2008. július 25-i dátummal az eredetiből archiválva]. (Hozzáférés: 2008. március 15.)
- ↑ For example, Nature via Nurture: Genes, Experience and What Makes Us Human. Fourth Estate, 73. o. (2003). ISBN 978-1-84115-745-0
- ↑ (1964) „The Genain Quadruplets: A Case Study and Theoretical Analysis of Heredity and Environment in Schizophrenia”. Behavioral Science 9 (4), 371. o. DOI:10.1002/bs.3830090407.
- ↑ (2002. február 1.) „Signal transduction and the control of gene expression”. Science 295 (5556), 813–818. o. DOI:10.1126/science.1066355. PMID 11823631.
- ↑ Alberts et al. (2002), II.3. Control of Gene Expression – The Tryptophan Repressor is a Simple Switch That Turns Genes On and Off in Bacteria Archiválva 2007. június 29-i dátummal a Wayback Machine-ben.
- ↑ (2003. március 1.) „Epigenetic regulation of gene expression: how the genome integrates intrinsic and environmental signals”. Nature Genetics 33 (Suppl), 245–254. o. DOI:10.1038/ng1089. PMID 12610534.
- ↑ (2007. február 1.) „Paramutation: from maize to mice”. Cell 128 (4), 641–645. o. DOI:10.1016/j.cell.2007.02.007. PMID 17320501.
- ↑ Spontaneous mutations, An Introduction to Genetic Analysis, 7th, New York: W.H. Freeman (2000). ISBN 978-0-7167-3520-5
- ↑ (2004. április 1.) „Lesion (in)tolerance reveals insights into DNA replication fidelity”. The EMBO Journal 23 (7), 1494–1505. o. DOI:10.1038/sj.emboj.7600158. PMID 15057282. PMC 391067.
- ↑ Induced mutations, An Introduction to Genetic Analysis, 7th, New York: W. H. Freeman (2000). ISBN 978-0-7167-3520-5
- ↑ (2013. február 1.) „DNA base damage by reactive oxygen species, oxidizing agents, and UV radiation”. Cold Spring Harbor Perspectives in Biology 5 (2), a012559. o. DOI:10.1101/cshperspect.a012559. PMID 23378590. PMC 3552502.
- ↑ Chromosome Mutation I: Changes in Chromosome Structure: Introduction, An Introduction to Genetic Analysis, 7th, New York: W.H. Freeman (2000). ISBN 978-0-7167-3520-5
- ↑ Encyclopedia of Microbiology. Academic Press, 551. o. (2009). ISBN 978-0-12-373944-5
- ↑ Environmental Biology. Cambridge University Press, 118. o. (2009). ISBN 978-0-521-67982-4
- ↑ (2007. április 1.) „Prevalence of positive selection among nearly neutral amino acid replacements in Drosophila”. Proceedings of the National Academy of Sciences of the United States of America 104 (16), 6504–6510. o. DOI:10.1073/pnas.0701572104. PMID 17409186. PMC 1871816.
- ↑ Variation and its modulation, An Introduction to Genetic Analysis, 7th, New York: W.H. Freeman (2000). ISBN 978-0-7167-3520-5
- ↑ Selection, An Introduction to Genetic Analysis, 7th, New York: W. H. Freeman (2000). ISBN 978-0-7167-3520-5
- ↑ (2001. november 1.) „Is the population size of a species relevant to its evolution?”. Evolution; International Journal of Organic Evolution 55 (11), 2161–2169. o. DOI:10.1111/j.0014-3820.2001.tb00732.x. PMID 11794777.
- ↑ Random events, An Introduction to Genetic Analysis, 7th, New York: W.H. Freeman (2000). ISBN 978-0-7167-3520-5
- ↑ On the Origin of Species. John Murray, 1. o. (1859). ISBN 978-0-8014-1319-3
- ↑ (2003. október 1.) „Perspective: models of speciation: what have we learned in 40 years?”. Evolution; International Journal of Organic Evolution 57 (10), 2197–2215. o. DOI:10.1554/02-727. PMID 14628909.
- ↑ (2002. szeptember 1.) „Genome trees and the tree of life”. Trends in Genetics 18 (9), 472–479. o. DOI:10.1016/S0168-9525(02)02744-0. PMID 12175808.
- ↑ The Use of Model Organisms in Instruction. University of Wisconsin: Wisconsin Outreach Research Modules. [2008. március 13-i dátummal az eredetiből archiválva]. (Hozzáférés: 2008. március 15.)
- ↑ NCBI: Genes and Disease. NIH: National Center for Biotechnology Information. [2007. február 20-i dátummal az eredetiből archiválva]. (Hozzáférés: 2008. március 15.)
- ↑ Pharmacogenetics Fact Sheet. NIH: National Institute of General Medical Sciences. [2008. május 12-i dátummal az eredetiből archiválva]. (Hozzáférés: 2008. március 15.)
- ↑ (2004. október 1.) „Genetic predisposition to cancer - insights from population genetics”. Nature Reviews. Genetics 5 (10), 764–772. o. DOI:10.1038/nrg1450. PMID 15510167.
- ↑ Human Molecular Genetics 2, second, John Wiley & Sons Inc. (1999) Chapter 18: Cancer Genetics Archiválva 2005. szeptember 26-i dátummal a Wayback Machine-ben.
- ↑ Lodish et al. (2000), Chapter 7: 7.1. DNA Cloning with Plasmid Vectors Archiválva 2009. május 27-i dátummal a Wayback Machine-ben.
- ↑ (2015. július 1.) „Artificial cloning of domestic animals”. Proceedings of the National Academy of Sciences of the United States of America 112 (29), 8874–8878. o. DOI:10.1073/pnas.1501718112. PMID 26195770. PMC 4517265.
- ↑ Lodish et al. (2000), Chapter 7: 7.7. Polymerase Chain Reaction: An Alternative to Cloning
- ↑ Section 2, Chapter 6: 6.1. The Methodology for DNA Sequencing, Genomes 2, 2nd, Oxford: Bios (2002). ISBN 978-1-85996-228-2
- ↑ Brown (2002), Section 2, Chapter 6: 6.2. Assembly of a Contiguous DNA Sequence Archiválva 2007. február 8-i dátummal a Wayback Machine-ben.
- ↑ Dante Labs Offers EUR 850 Whole Genome Sequencing and Interpretation for the First Time in the World PR Newswire
Fordítás
[szerkesztés]- Ez a szócikk részben vagy egészben a Genetics című angol Wikipédia-szócikk ezen változatának fordításán alapul. Az eredeti cikk szerkesztőit annak laptörténete sorolja fel. Ez a jelzés csupán a megfogalmazás eredetét és a szerzői jogokat jelzi, nem szolgál a cikkben szereplő információk forrásmegjelöléseként.
