5S riboszomális RNS
Az 5S riboszomális RNS (5S rRNS) körülbelül 120 nukleotidos riboszomális RNS, tömege 40 kDa. A riboszóma nagy alegységének szerkezeti és funkciós része minden doménben, kivéve az állatok és gombák mitokondriális riboszómáit. Az 5S a molekula ultracentrifugában mutatott szedimentációs sebességére utal, ennek mértékegysége a Svedberg-egység (S).[1]

Bioszintézis
[szerkesztés]A prokariótákban az 5S rRNS-gén jellemzően az rRNS-operonokban található a kis és nagy rRNS-alegység után, és policisztronos prekurzorrá íródik át.[3] Az eukarióta magi genomokra jellemző a több 5S rRNS-génmásolat (5S rDNS) tandem ismétlődésekben, példányszám fajonként eltérő példányszámmal.[4][5] Az eukarióta 5S rRNS-t az RNS-polimeráz III állítja elő, míg a többi eukarióta rRNS az RNS-polimeráz I által átírt 45S prekurzorról válik le. Xenopus-oocitákban a 9 cinkujjas TFIIIA transzkripciós faktor 4–7. ujja az 5S rRNS központi részéhez köthet.[6][7] Ez gátolja az 5S rRNS további transzkripcióját és stabilizálja az átírt rRNS-t a riboszóma-összeállításig.[8]
Szerkezet
[szerkesztés]Az 5S rRNS másodlagos szerkezetében 5 hélix (I–V.), 4 kör (B–E) és 1 zsanér (A) van, ezek együtt Y alakú szerkezetet alkotnak. A C és D körök terminális hajtűk, a B és E belsők.[4] Filogenetikai tanulmányok alapján az I. és III. hélix valószínűleg ősi.[9] A III. hélixben 2 erősen állandósult adenozin van.[10] A hajtűszerkezetű V. hélix feltehetően kölcsönhat a TFIIIA-val.[4]
Helye a riboszómában
[szerkesztés]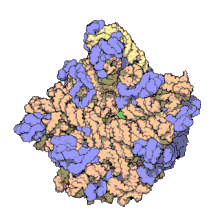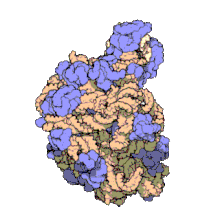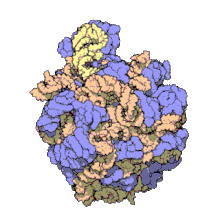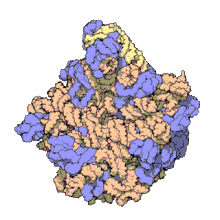
Több molekuláris technika, például immun-elektronmikroszkópia, krioelektron-mikroszkópia, molekulaközi keresztkötések és röntgenkrisztallográfia használatával az 5S rRNS helye a nagy riboszóma-alegységben nagy pontossággal ismert. Baktériumokban és archeákban ezen egység 2 RNS-ből áll, az 5S és a 23S rRNS-ből, valamint számos kapcsolódó fehérjéből áll.[3][12]
Az eukarióta LSU 5S, 5,8S és 28S rRNS-ből és még több fehérjéből áll.[13][14] Az LSU 3 dimenziós szerkezete viszonylag sima felszínt mutat, az átellenes oldalon 3 kiemelkedéssel, az L1, a központi kiemelkedéssel (CP) és az L7/L12-tönkkel. Az L1 kiemelkedés és az L7/L12-tönk a CP-t laterálisan veszi körül. Az 5S rRNS a CP-ben van, létrejöttében fontos. A CP többi fő alkotói a 23S (eukariótákban 28S) rRNS és több fehérje, például az L5, az L18, az L25 és az L27.[15]
Riboszómafunkciók
[szerkesztés]Az 5S rRNS pontos funkciója nem ismert. E. coliban az 5S rRNS-deléciók csökkentik a fehérjeszintézis-sebességet és jobban hatnak az életképességre, mint más (16S és 23S) rRNS-gének hasonló arányú deléciója.[16] Krisztallográfiai tanulmányok alapján az 5S rRNS-kötő fehérjék és a központi kiemelkedés más hasonló fehérjéi a tRNS-kötésben fontosak.[15] Ezenkívül a peptidiltranszferáz- és GTPáz-asszociáló központot alkotó 5S és 23S rRNS topográfiai és fizikai közelsége alapján az 5S rRNS mediátoor a riboszóma két funkciós központja közt az 5S rRNS-kötő fehérjék és a központi kiemelkedés más központikiemelkedés-alkotókkal együttes alkotóegységközihíd- és tRNS-kötőhely-keletkezés révén.[15]
Funkció a riboszómakeletkezésben
[szerkesztés]Az eukarióta citoszol-riboszóma 4 rRNS-ből és több mint 80 fehérjéből áll.[14][17] Az 5S rRNS 3’-végeit transzkripció után csak működő ribonukleáz T-homológok, például Saccharomyces cerevisiae esetén a Rex1p vághatják az érett hosszra.[18] A 60S és 40S riboszómaalegységek a magból a citoplazmába kerülnek, ahol érett és transzlációképes 80S riboszómát alkotnak. Hogy mikor kerül ebbe 5S rRNS, nem ismert,[4] de általánosan elfogadott, hogy az 5S rRNS a 60S-prekurzor 90S-be kerül kis riiboszómafüggetlen 5S–L5 RNP-komplexként.[17]
Kölcsönhatások fehérjékkel
[szerkesztés]Több 5S rRNS-kölcsönható fehérje szerepel alább.
La
[szerkesztés]Az 5S rRNS–La fehérje kölcsönhatás megakadályozza az exonukleázok általi bontását.[19] A La minden eukarióta sejtmagjában megtalálható, és több, az RNS pol III által átírt RNS-sel asszociál a 3’-oligouridin révén, stabilizálva és szerkezetet adva nekik.[4][20]
L5
[szerkesztés]Az eukarióta sejtekben az L5 riboszómafehérje az 5S rRNS-sel asszociál és stabilizálja azt, preriboszomális ribonukleoproteint (RNP) alkotva, mely a citoszolban és a magban is megtalálható. Hiánya akadályozza az 5S magba kerülését és csökkenti a riboszómakeletkezést.[4]
Egyéb riboszómafehérjék
[szerkesztés]A prokariótákban az 5S rRNS az L5, L18 és L25 riboszómafehérjékhez köt, eukariótákban csak az L5-tel ismert kölcsönhatása.[21] A Trypanosoma brucei, a tripanoszomiázis okozója esetén az 5S rRNS két közeli rokon RNS-kötő fehérjével, a P34-gyel és a P37-tel kölcsönhat, ezek elvesztése csökkenti a szintjét.[4]
Jelenléte sejtalkotó-riboszómákban
[szerkesztés]
A mitokondriumok és plasztiszok (endoszimbiontabaktérium-eredetű sejtalkotók) és bakteriális rokonaik transzlációs szerkezetei számos közös jellemzővel rendelkeznek, de sok a különbség is. A sejtszervecskegenomok az SSU- és LSU-rRNS-eket kivétel nélkül kódolják, de az 5S rRNS-gének (rrn5) eloszlása a legegyenlőtlenebb. Az rrn5 a legtöbb plasztiszban könnyen azonosítható és gyakori. Ezzel szemben a mitokondriális rrn5-öt eleinte növényekre és kevés protisztára korlátozottnak gondolták.[22][23] További távolabbi sejtalkotó-5S-rRNS-eket szekvencia-összetételi torzításról és szerkezeti variációról szóló információval rendelkező kovarianciamodellekkel azonosítottak.[24] Ez további 5S rRNS-géneket azonosított a legtöbb protiszta mitokondriumai és bizonyos apikoplasztiszok genomjaiban.

A legtöbb sárgásmoszat mitokondriális 5S rRNS-ei másodlagos szerkezetei a legsokszínűbbek.[24] A barnamoszatok permutált másodlagos szerkezetei a legkülönösebb esetek, ahol az 5′- és 3′-végeket összekapcsolja I. záróhélix helyén zárt hajtű van, nyílt háromirányú kapcsolatot adva.
2014-es ismeretek szerint csak kevés csoport, például az állatok, a gombák, az Alveolata és az ostoros moszatok mitokondriális DNS-ében nincs ily gén.[24] Az egyébként az 5S rRNS és kapcsolódó fehérjéi által elfoglalt központi kiemelkedés különböző módokon átalakult. Gombák mitokondriális riboszómáiban az 5S rRNS-t LSU-rRNS-bővítő szekvenciák váltották fel.[25] A Kinetoplastida központi kiemelkedését evolúciósan új mitokondriális riboszomális fehérjék foglalják el.[26] Az állatok mitokondriális riboszómáiban speciális mitokondriális tRNS (gerincesekben Val) van a hiányzó 5S rRNS helyén.[27][28]
Jegyzetek
[szerkesztés]- ↑ Szymanski M, Barciszewska MZ, Erdmann VA, Barciszewski J (2002. január 1.). „5S Ribosomal RNA Database”. Nucleic Acids Research 30 (1), 176–178. o. DOI:10.1093/nar/30.1.176. PMID 11752286. PMC 99124.
- ↑ Mueller F, Sommer I, Baranov P, Matadeen R, Stoldt M, Wöhnert J, Görlach M, van Heel M, Brimacombe R (2000. április 1.). „The 3D arrangement of the 23 S and 5 S rRNA in the Escherichia coli 50 S ribosomal subunit based on a cryo-electron microscopic reconstruction at 7.5 A resolution”. Journal of Molecular Biology 298 (1), 35–59. o. DOI:10.1006/jmbi.2000.3635. PMID 10756104.
- ↑ a b Kaczanowska M, Rydén-Aulin M (2007. szeptember 1.). „Ribosome biogenesis and the translation process in Escherichia coli”. Microbiology and Molecular Biology Reviews 71 (3), 477–494. o. DOI:10.1128/MMBR.00013-07. PMID 17804668. PMC 2168646.
- ↑ a b c d e f g Ciganda M, Williams N (2011). „Eukaryotic 5S rRNA biogenesis”. Wiley Interdisciplinary Reviews. RNA 2 (4), 523–533. o. DOI:10.1002/wrna.74. PMID 21957041. PMC 3278907.
- ↑ Douet J, Tourmente S (2007. július 1.). „Transcription of the 5S rRNA heterochromatic genes is epigenetically controlled in Arabidopsis thaliana and Xenopus laevis”. Heredity 99 (1), 5–13. o. DOI:10.1038/sj.hdy.6800964. PMID 17487217.
- ↑ McBryant SJ, Veldhoen N, Gedulin B, Leresche A, Foster MP, Wright PE, Romaniuk PJ, Gottesfeld JM (1995. április 1.). „Interaction of the RNA binding fingers of Xenopus transcription factor IIIA with specific regions of 5 S ribosomal RNA”. Journal of Molecular Biology 248 (1), 44–57. o. DOI:10.1006/jmbi.1995.0201. PMID 7731045.
- ↑ Searles MA, Lu D, Klug A (2000. augusztus 1.). „The role of the central zinc fingers of transcription factor IIIA in binding to 5 S RNA”. Journal of Molecular Biology 301 (1), 47–60. o. DOI:10.1006/jmbi.2000.3946. PMID 10926492.
- ↑ Pelham HR, Brown DD (1980. július 1.). „A specific transcription factor that can bind either the 5S RNA gene or 5S RNA”. Proceedings of the National Academy of Sciences of the United States of America 77 (7), 4170–4174. o. DOI:10.1073/pnas.77.7.4170. PMID 7001457. PMC 349792.
- ↑ Sun FJ, Caetano-Anollés G (2009. november 1.). „The evolutionary history of the structure of 5S ribosomal RNA”. Journal of Molecular Evolution 69 (5), 430–443. o. DOI:10.1007/s00239-009-9264-z. PMID 19639237.
- ↑ DiNitto JP, Huber PW (2001. október 1.). „A role for aromatic amino acids in the binding of Xenopus ribosomal protein L5 to 5S rRNA”. Biochemistry 40 (42), 12645–12653. o. DOI:10.1021/bi011439m. PMID 11601989.
- ↑ Ban N, Nissen P, Hansen J, Moore PB, Steitz TA (2000. augusztus 1.). „The complete atomic structure of the large ribosomal subunit at 2.4 A resolution”. Science 289 (5481), 905–920. o. DOI:10.1126/science.289.5481.905. PMID 10937989.
- ↑ Tirumalai MR, Kaelber JT, Park DR, Tran Q, Fox GE (2020. október 1.). „Cryo-electron microscopy visualization of a large insertion in the 5S ribosomal RNA of the extremely halophilic archaeon Halococcus morrhuae”. FEBS Open Bio 10 (10), 1938–1946. o. DOI:10.1002/2211-5463.12962. PMID 32865340. PMC 7530397.
- ↑ Turowski TW, Tollervey D (2015). „Cotranscriptional events in eukaryotic ribosome synthesis”. Wiley Interdisciplinary Reviews. RNA 6 (1), 129–139. o. DOI:10.1002/wrna.1263. PMID 25176256.
- ↑ a b Yusupova G, Yusupov M (2014. február 1.). „High-resolution structure of the eukaryotic 80S ribosome”. Annual Review of Biochemistry 83, 467–486. o. DOI:10.1146/annurev-biochem-060713-035445. PMID 24580643.
- ↑ a b c Gongadze GM (2011. december 1.). „5S rRNA and ribosome”. Biochemistry. Biokhimiia 76 (13), 1450–1464. o. DOI:10.1134/S0006297911130062. PMID 22339598.
- ↑ Ammons D, Rampersad J, Fox GE (1999. január 1.). „5S rRNA gene deletions cause an unexpectedly high fitness loss in Escherichia coli”. Nucleic Acids Research 27 (2), 637–642. o. DOI:10.1093/nar/27.2.637. PMID 9862991. PMC 148226.
- ↑ a b Henras AK, Soudet J, Gérus M, Lebaron S, Caizergues-Ferrer M, Mougin A, Henry Y (2008. augusztus 1.). „The post-transcriptional steps of eukaryotic ribosome biogenesis”. Cellular and Molecular Life Sciences 65 (15), 2334–2359. o. DOI:10.1007/s00018-008-8027-0. PMID 18408888.
- ↑ van Hoof A, Lennertz P, Parker R (2000. március 1.). „Three conserved members of the RNase D family have unique and overlapping functions in the processing of 5S, 5.8S, U4, U5, RNase MRP and RNase P RNAs in yeast”. The EMBO Journal 19 (6), 1357–1365. o. DOI:10.1093/emboj/19.6.1357. PMID 10716935. PMC 305676.
- ↑ Wolin SL, Cedervall T (2002). „The La protein”. Annual Review of Biochemistry 71, 375–403. o. DOI:10.1146/annurev.biochem.71.090501.150003. PMID 12045101.
- ↑ Maraia RJ, Intine RV (2002). „La protein and its associated small nuclear and nucleolar precursor RNAs”. Gene Expression 10 (1–2), 41–57. o. PMID 11868987. PMC 5977531.
- ↑ Moore PB (2001. március 1.). „The ribosome at atomic resolution”. Biochemistry 40 (11), 3243–3250. o. DOI:10.1021/bi0029402. PMID 11258942.
- ↑ Bullerwell CE, Schnare MN, Gray MW (2003. március 1.). „Discovery and characterization of Acanthamoeba castellanii mitochondrial 5S rRNA”. RNA 9 (3), 287–292. o. DOI:10.1261/rna.2170803. PMID 12592002. PMC 1370395.
- ↑ Bullerwell CE, Burger G, Gott JM, Kourennaia O, Schnare MN, Gray MW (2010. május 1.). „Abundant 5S rRNA-like transcripts encoded by the mitochondrial genome in amoebozoa”. Eukaryotic Cell 9 (5), 762–773. o. DOI:10.1128/EC.00013-10. PMID 20304999. PMC 2863963.
- ↑ a b c Valach M, Burger G, Gray MW, Lang BF (2014. december 1.). „Widespread occurrence of organelle genome-encoded 5S rRNAs including permuted molecules”. Nucleic Acids Research 42 (22), 13764–13777. o. DOI:10.1093/nar/gku1266. PMID 25429974. PMC 4267664.
- ↑ Amunts A, Brown A, Bai XC, Llácer JL, Hussain T, Emsley P, Long F, Murshudov G, Scheres SH, Ramakrishnan V (2014. március 1.). „Structure of the yeast mitochondrial large ribosomal subunit”. Science 343 (6178), 1485–1489. o. DOI:10.1126/science.1249410. PMID 24675956. PMC 4046073.
- ↑ Sharma MR, Booth TM, Simpson L, Maslov DA, Agrawal RK (2009. június 1.). „Structure of a mitochondrial ribosome with minimal RNA”. Proceedings of the National Academy of Sciences of the United States of America 106 (24), 9637–9642. o. DOI:10.1073/pnas.0901631106. PMID 19497863. PMC 2700991.
- ↑ Brown A, Amunts A, Bai XC, Sugimoto Y, Edwards PC, Murshudov G, Scheres SH, Ramakrishnan V (2014. november 1.). „Structure of the large ribosomal subunit from human mitochondria”. Science 346 (6210), 718–722. o. DOI:10.1126/science.1258026. PMID 25278503. PMC 4246062.
- ↑ Greber BJ, Boehringer D, Leibundgut M, Bieri P, Leitner A, Schmitz N, Aebersold R, Ban N (2014. november 1.). „The complete structure of the large subunit of the mammalian mitochondrial ribosome”. Nature 515 (7526), 283–286. o. DOI:10.1038/nature13895. PMID 25271403.
Fordítás
[szerkesztés]Ez a szócikk részben vagy egészben a(z) 5S ribosomal RNA című angol Wikipédia-szócikk ezen változatának fordításán alapul. Az eredeti cikk szerkesztőit annak laptörténete sorolja fel. Ez a jelzés csupán a megfogalmazás eredetét és a szerzői jogokat jelzi, nem szolgál a cikkben szereplő információk forrásmegjelöléseként.
További információk
[szerkesztés]- 5SData Archiválva 2010. április 27-i dátummal a Wayback Machine-ben.
- 5S+Ribosomal+RNA a U.S. National Library of Medicine Medical Subject Headings (MeSH) honlapján
- Halococcus morrhuae (archea) 5S rRNS-e
| Az itt található információk kizárólag tájékoztató jellegűek, nem minősülnek orvosi szakvéleménynek, nem pótolják az orvosi kivizsgálást és kezelést. A cikk tartalmát a Wikipédia önkéntes szerkesztői alakítják ki, és bármikor módosulhat. |
